Содержание
- 2. Амины
- 3. Амины – органические соединения, являющиеся производными аммиака, в молекуле которого один, два или три атома водорода
- 4. По характеру органической группы, связанной с азотом: алифатические, ароматические (анилины) жирно-ароматические (содержат ароматический и алифатический радикалы)
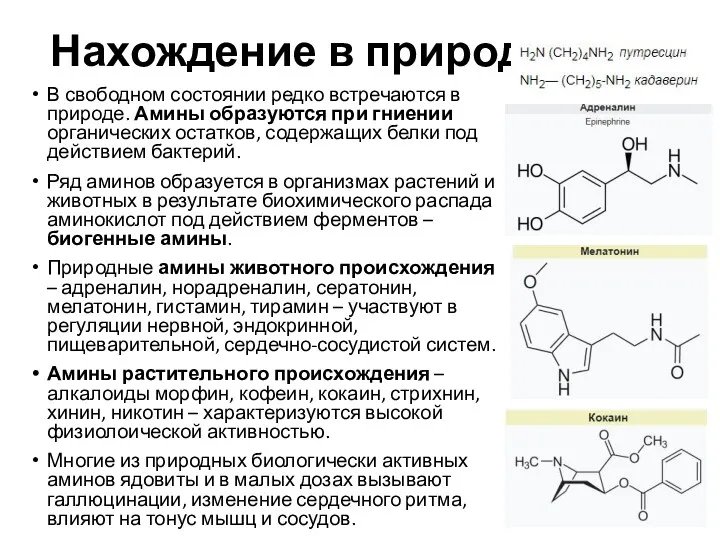
- 5. Нахождение в природе В свободном состоянии редко встречаются в природе. Амины образуются при гниении органических остатков,
- 6. Физические свойства аминов Низшие амины – метиламин, диметиламин, триметиламин и этиламин – при комнатной температуре являются
- 7. Способы получения аминов Из природных объектов Перегонка обезжиренных костей Из селедочного рассола Разложением аминокислот и белков
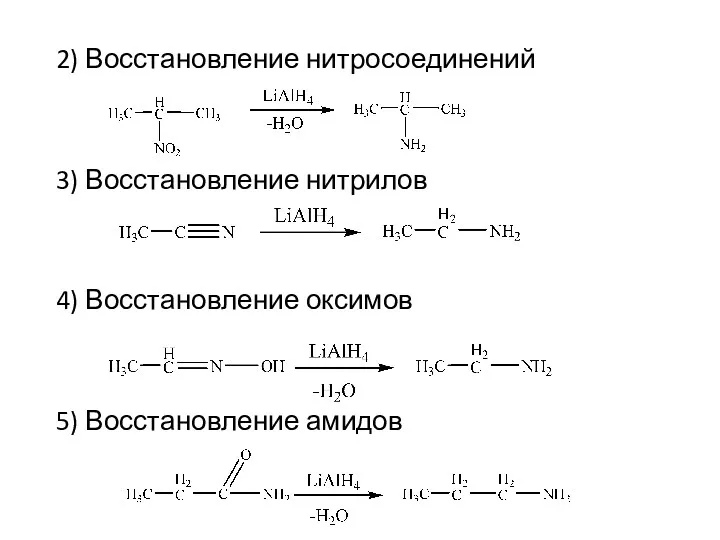
- 8. 2) Восстановление нитросоединений 3) Восстановление нитрилов 4) Восстановление оксимов 5) Восстановление амидов
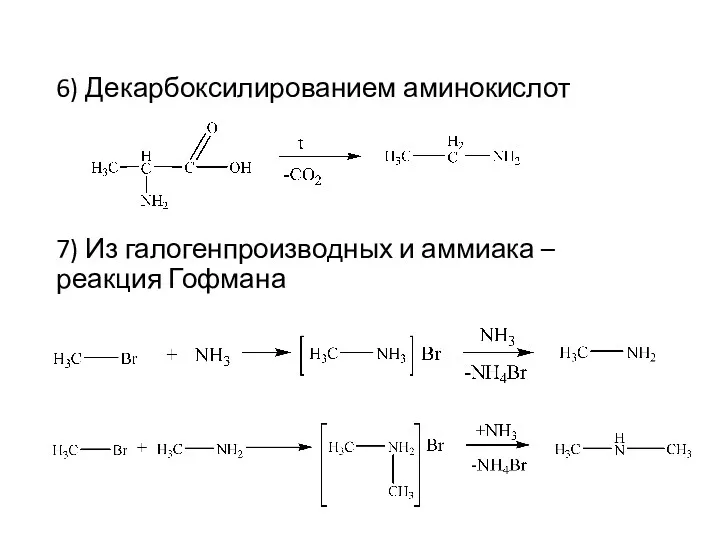
- 9. 6) Декарбоксилированием аминокислот 7) Из галогенпроизводных и аммиака – реакция Гофмана
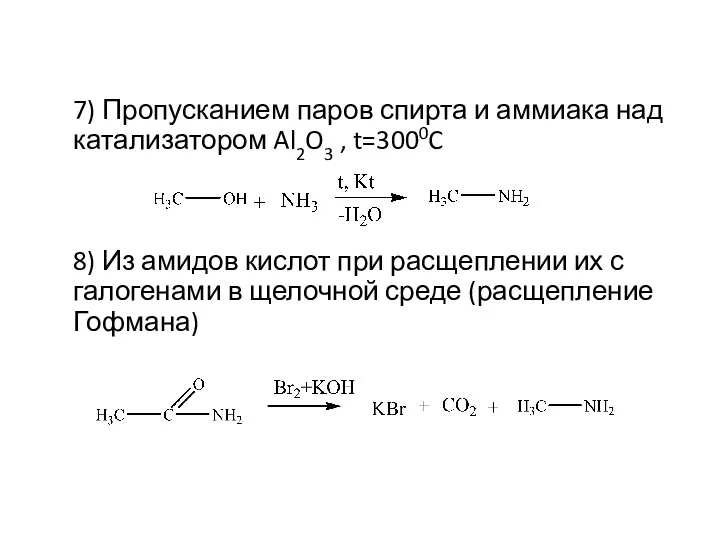
- 10. 7) Пропусканием паров спирта и аммиака над катализатором Al2O3 , t=3000C 8) Из амидов кислот при
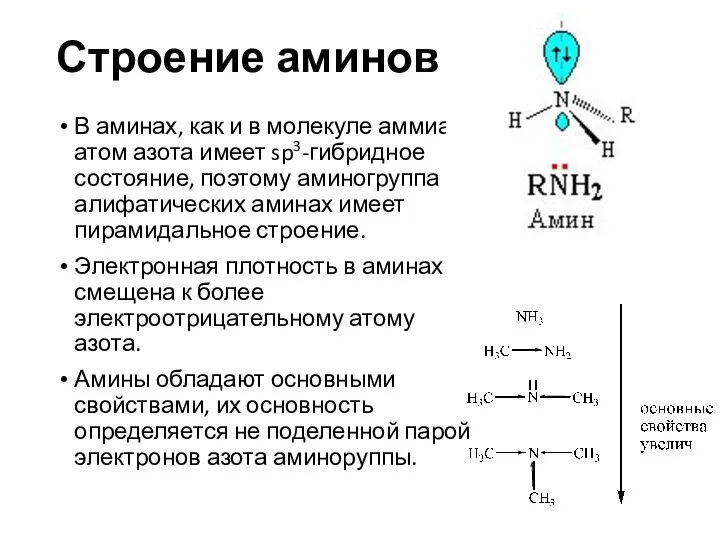
- 11. Строение аминов В аминах, как и в молекуле аммиака, атом азота имеет sp3-гибридное состояние, поэтому аминогруппа
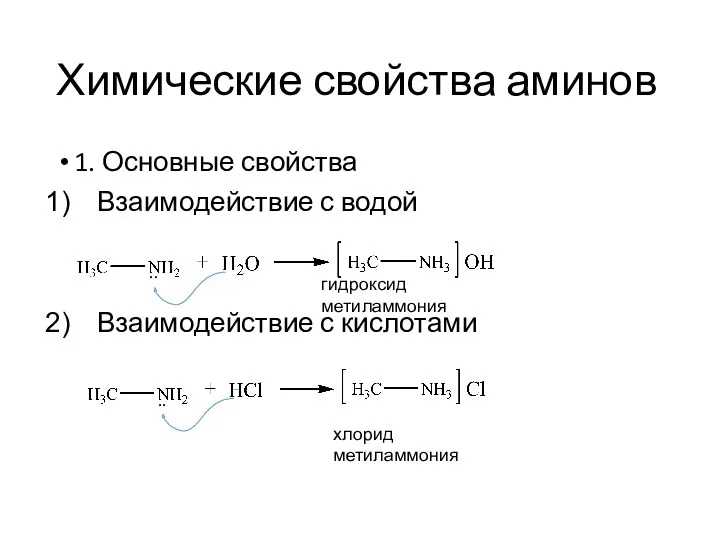
- 12. Химические свойства аминов 1. Основные свойства Взаимодействие с водой Взаимодействие с кислотами гидроксид метиламмония хлорид метиламмония
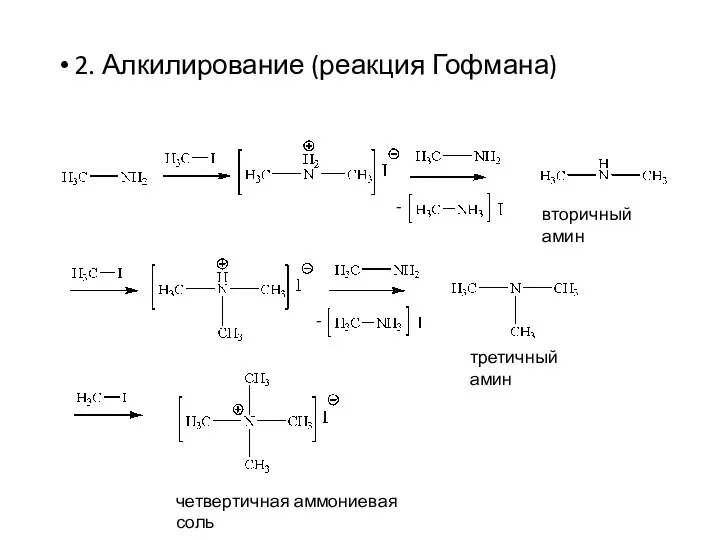
- 13. 2. Алкилирование (реакция Гофмана) вторичный амин третичный амин четвертичная аммониевая соль - -
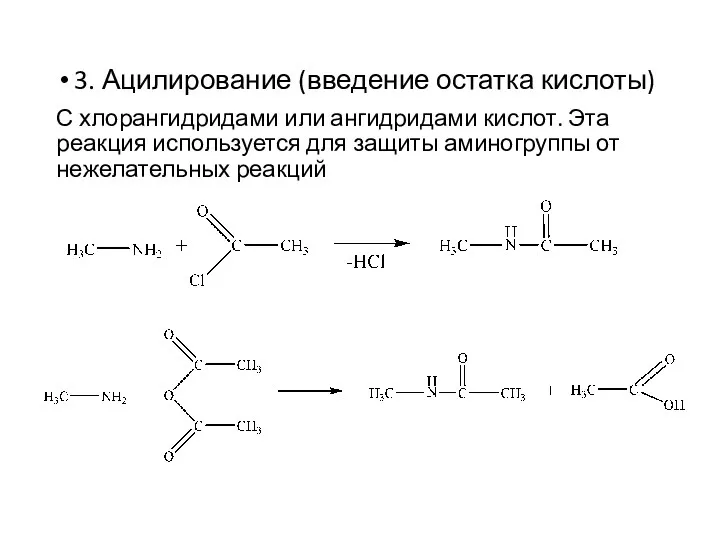
- 14. 3. Ацилирование (введение остатка кислоты) С хлорангидридами или ангидридами кислот. Эта реакция используется для защиты аминогруппы
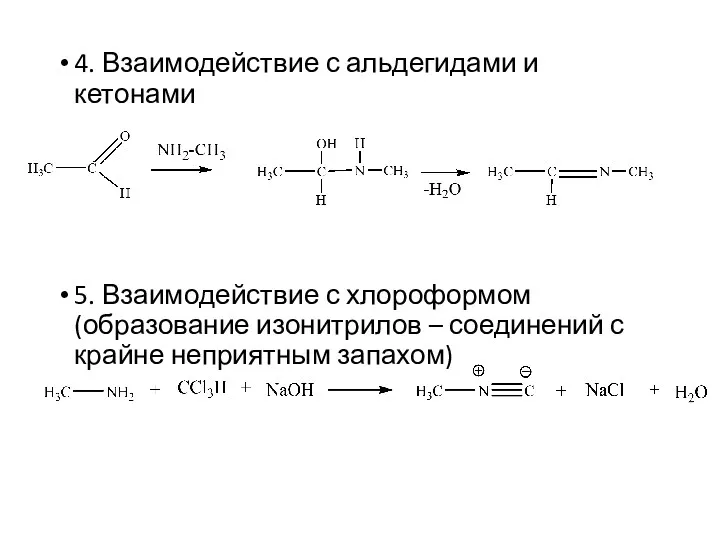
- 15. 4. Взаимодействие с альдегидами и кетонами 5. Взаимодействие с хлороформом (образование изонитрилов – соединений с крайне
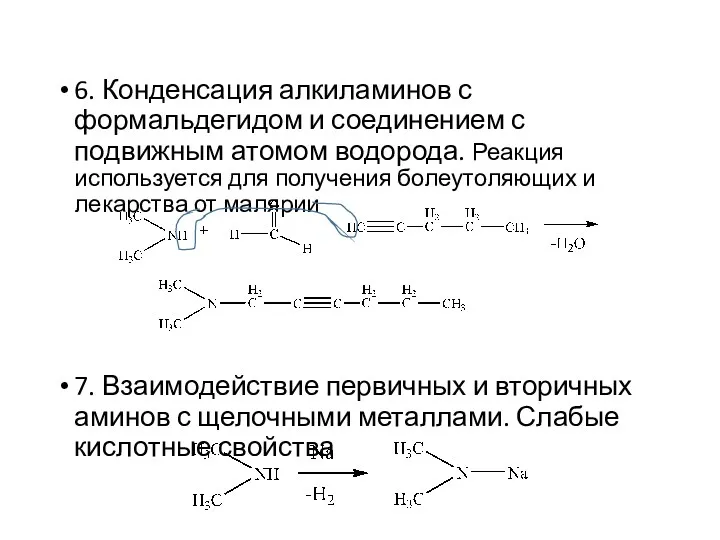
- 16. 6. Конденсация алкиламинов с формальдегидом и соединением с подвижным атомом водорода. Реакция используется для получения болеутоляющих
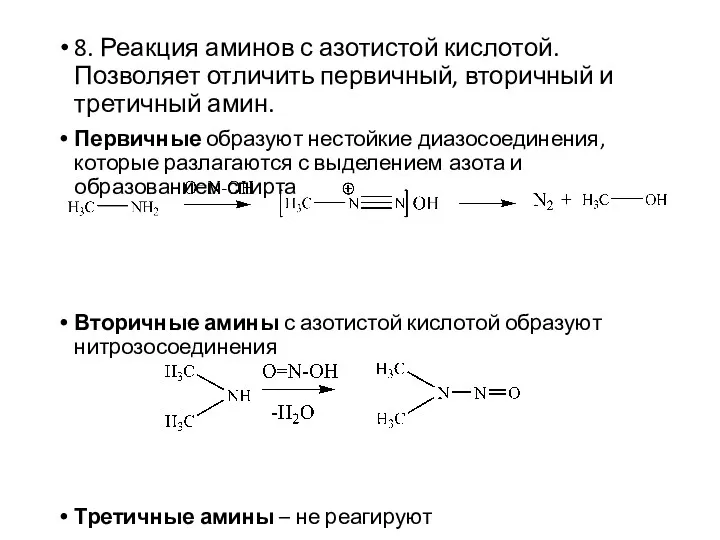
- 17. 8. Реакция аминов с азотистой кислотой. Позволяет отличить первичный, вторичный и третичный амин. Первичные образуют нестойкие
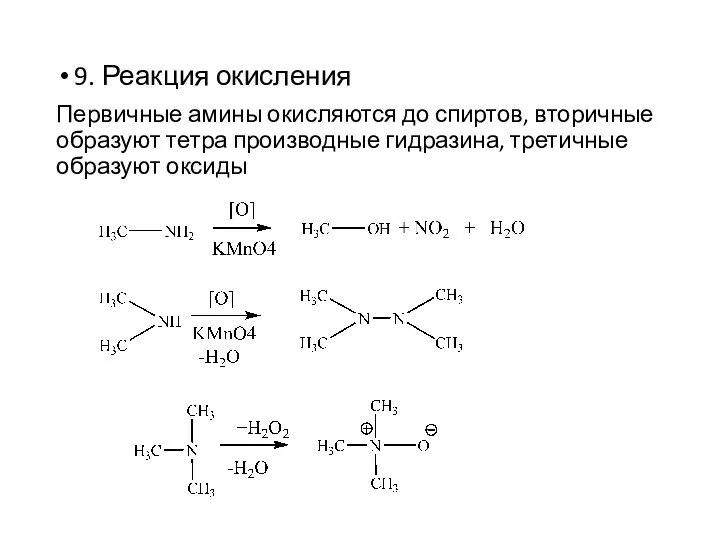
- 18. 9. Реакция окисления Первичные амины окисляются до спиртов, вторичные образуют тетра производные гидразина, третичные образуют оксиды
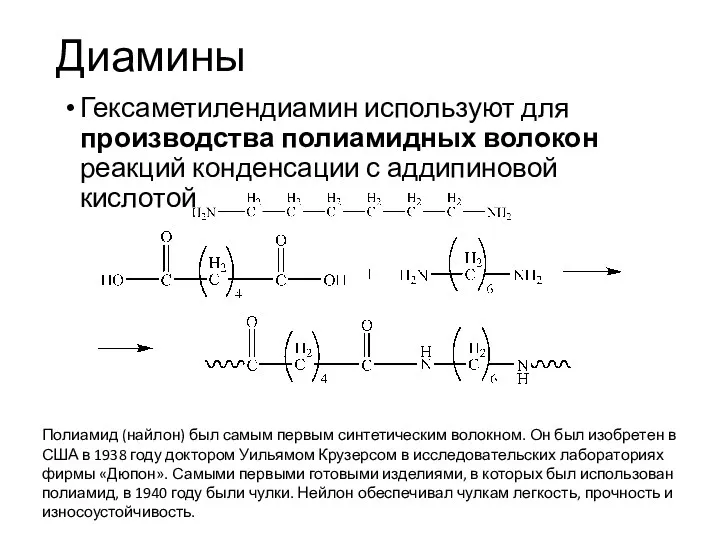
- 19. Диамины Гексаметилендиамин используют для производства полиамидных волокон реакций конденсации с аддипиновой кислотой Полиамид (найлон) был самым
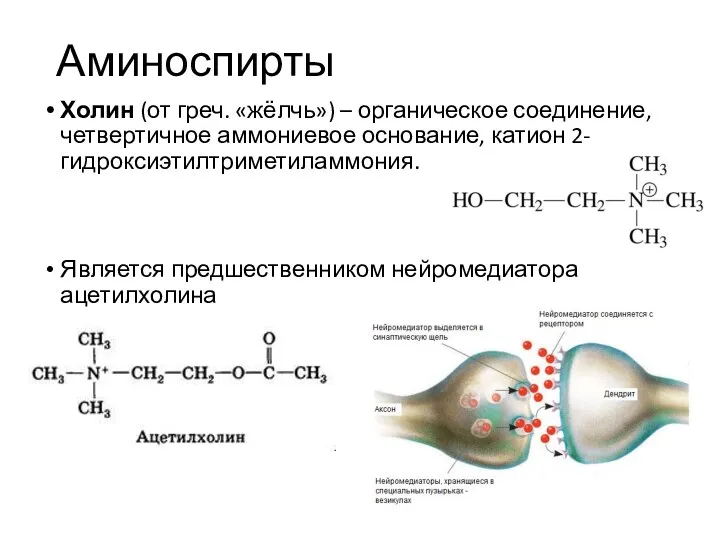
- 20. Аминоспирты Холин (от греч. «жёлчь») – органическое соединение, четвертичное аммониевое основание, катион 2-гидроксиэтилтриметиламмония. Является предшественником нейромедиатора
- 21. Нитросоединения
- 22. Нитросоединения – органические соединения, содержащие одну или несколько нитрогрупп – NO2. Под нитросоединениями обычно подразумевают C-нитросоединения,
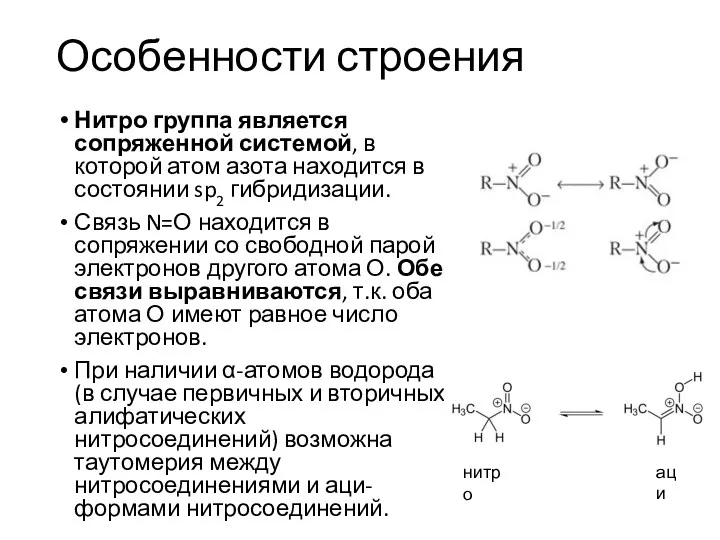
- 23. Особенности строения Нитро группа является сопряженной системой, в которой атом азота находится в состоянии sp2 гибридизации.
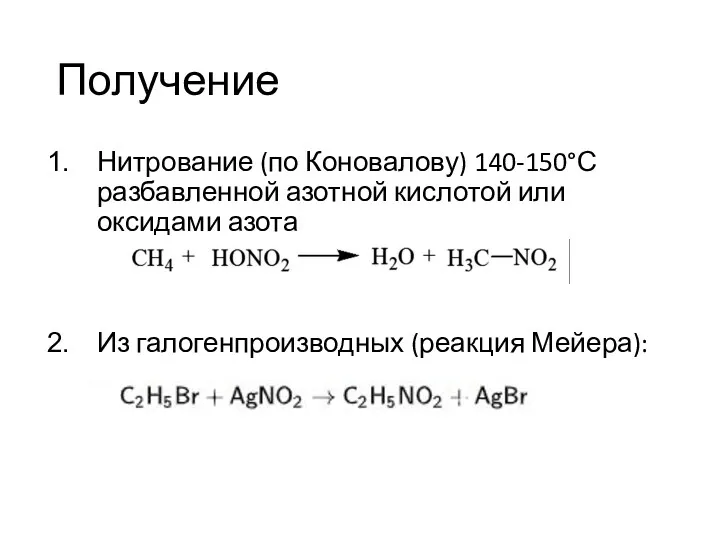
- 24. Получение Нитрование (по Коновалову) 140-150°С разбавленной азотной кислотой или оксидами азота Из галогенпроизводных (реакция Мейера):
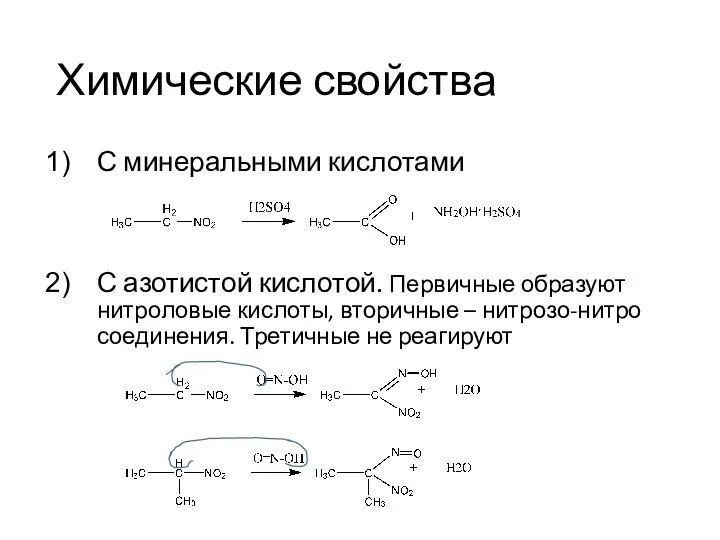
- 25. Химические свойства С минеральными кислотами С азотистой кислотой. Первичные образуют нитроловые кислоты, вторичные – нитрозо-нитро соединения.
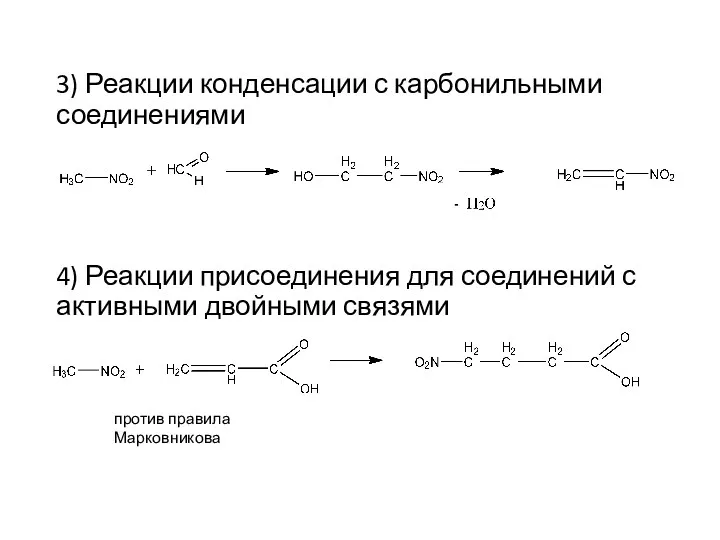
- 26. 3) Реакции конденсации с карбонильными соединениями 4) Реакции присоединения для соединений с активными двойными связями против
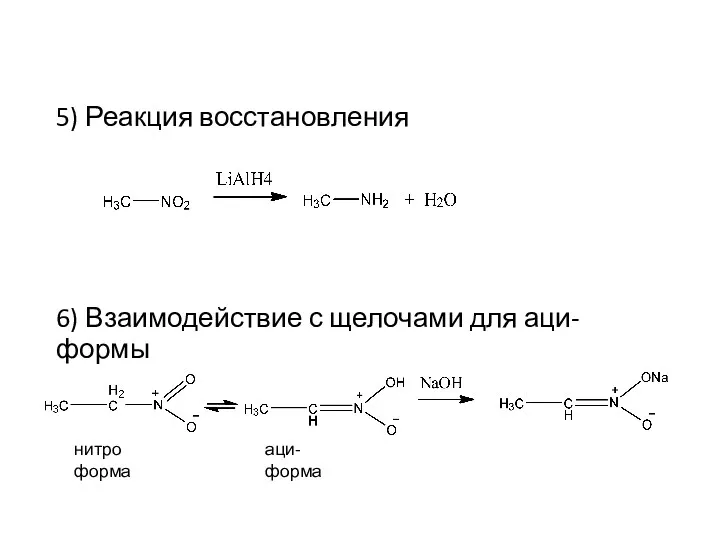
- 27. 5) Реакция восстановления 6) Взаимодействие с щелочами для аци-формы нитро форма аци-форма
- 29. Скачать презентацию







 Генетическая связь между классами веществ
Генетическая связь между классами веществ Эколого-химическая характеристика качества почвы
Эколого-химическая характеристика качества почвы Химический эквивалент. Формульные единицы
Химический эквивалент. Формульные единицы Свойства алкадиенов и их получение
Свойства алкадиенов и их получение Ионные уравнения реакций
Ионные уравнения реакций Элементы VII группы периодической таблицы Д.И. Менделеева
Элементы VII группы периодической таблицы Д.И. Менделеева Свойства фосфора
Свойства фосфора Азотсодержащие органические соединения
Азотсодержащие органические соединения Ерiтiндiлер туралы iлiм. Сұйытылған бейэлектролит және электролит ерiтiнндiлерiнiң коллигативтiк қасиеттерi
Ерiтiндiлер туралы iлiм. Сұйытылған бейэлектролит және электролит ерiтiнндiлерiнiң коллигативтiк қасиеттерi Месторождения нефрита
Месторождения нефрита Значение органической химии в жизни человека
Значение органической химии в жизни человека Получение и распознавание водорода
Получение и распознавание водорода Метаморфогенные месторождения
Метаморфогенные месторождения Теоретические аспекты химического осаждения из газовой фазы
Теоретические аспекты химического осаждения из газовой фазы Обчислення швидкості хімічних реакцій в залежності від концентрації реагуючих речовин і температури
Обчислення швидкості хімічних реакцій в залежності від концентрації реагуючих речовин і температури Геохимия ландшафтов
Геохимия ландшафтов ПРИРОДНЫЕ ИСТОЧНИКИ УГЛЕВОДОРОДОВ
ПРИРОДНЫЕ ИСТОЧНИКИ УГЛЕВОДОРОДОВ Цветные металлы и сплавы
Цветные металлы и сплавы Серебро. История
Серебро. История Оксиды (1 этап изучения). 8 класс
Оксиды (1 этап изучения). 8 класс Базовое нефтехимическое сырье
Базовое нефтехимическое сырье Күйдіргіш натрий
Күйдіргіш натрий Никель – тяжелый металл
Никель – тяжелый металл Prezentatsia
Prezentatsia Серная кислота H2SO4
Серная кислота H2SO4 Застосування неметалів
Застосування неметалів Кислород
Кислород Периодическая система химических элементов Д.И.Менделеева
Периодическая система химических элементов Д.И.Менделеева