Содержание
Слайд 2
Натрий(Natrіum), Na – элементтердің периодтық жүйесінің І тобындағы химиялық элемент, атомдық
Натрий(Natrіum), Na – элементтердің периодтық жүйесінің І тобындағы химиялық элемент, атомдық
нейтрондары 11, атомдық моллекулласы 22,98977; сілтілік металдарға жатады. Табиғатта тұрақты бір изотопы (23Na) бар. Натрий-ды алғаш 1807 жылы ағылшын химигі Г.Дэви (1778 – 1829) күйдіргіш натрийды (NaOH) электролиздеу арқылы бөліп алған. Жер қыртысындағы орташа массалық мөлшері 2,64%. Маңызды минералдары: галит (тас тұзы) – NaCl,мирабилит (глаубер тұзы) – Na2SO410H2O, чили селитрасы – NaNO3, криолит – Na3AlF6, трона – NaHCO3Na2CO32H2O. Натрий жұмсақ, күмістей ақ металл, тығыздығы 0,968 г/см3, балқу t 97,83С, қайнау t 882,9С. Тотығу дәрежесі +1. Қатты Натрий ауада тез тотығады, сұйық күйінде тұтанады. Сумен өте күшті, оттек, фтор, хлор, күкіртпен белсенді, 200С-та сутекпен, 800 – 900С-та көміртекпен әрекеттеседі.
Слайд 3
Химиялық қасиеттері
1. Бейметалдармен әрекеттескенде екі түрлі қышкылдың тұзы түзіледі.
2. Қышкылдық және
Химиялық қасиеттері 1. Бейметалдармен әрекеттескенде екі түрлі қышкылдың тұзы түзіледі. 2. Қышкылдық және
екідайлы оксидтермен тұз және су түзе әрекеттеседі.
3. Қышқылдармен де осы тектес заттар береді;
4. Тұздармен реакцияласуы:
a) орта тұздармен: 3NaOH + ҒеС13 = NaCl + Ғе(ОН)3
ә) қышқыл тұздармен: NaOH + NaHS04 = Na2S04 + Н20
в) негіздік тұздармен: 2NaOH + А1(ОН)С12 = А1(ОН)3 + 2NaCl


 Тема. Водородная связь
Тема. Водородная связь Анализ жидких средств для мытья посуды
Анализ жидких средств для мытья посуды Углерод. Аллотропные модификации
Углерод. Аллотропные модификации Материалы с малой плотностью
Материалы с малой плотностью Полимеры. Степень полимеризации
Полимеры. Степень полимеризации Застосування алканів
Застосування алканів Классы неорганических веществ
Классы неорганических веществ Индикаторы на кухне
Индикаторы на кухне Чисті речовини і суміші
Чисті речовини і суміші Синтетикалық пиретроидтар. Инсектицидтердің тиомочевиндер, нейтротоксиндер, гормоналды, авермектиндер, карбаматтар
Синтетикалық пиретроидтар. Инсектицидтердің тиомочевиндер, нейтротоксиндер, гормоналды, авермектиндер, карбаматтар Решение задач по теме: «Электролиз»
Решение задач по теме: «Электролиз» Углеводы. Урок по химии для 9 класса
Углеводы. Урок по химии для 9 класса Химическая промышленность России
Химическая промышленность России Кислоты. Состав и классификация кислот. Формулы и названия основных неорганических кислот
Кислоты. Состав и классификация кислот. Формулы и названия основных неорганических кислот Кривая охлаждения железа и структуры сплавов
Кривая охлаждения железа и структуры сплавов Основные классы неорганических соединений
Основные классы неорганических соединений Альбитит-грейзеновые месторождения
Альбитит-грейзеновые месторождения Жёсткость воды и способы её устранения. Практическая работа №6. 9 класс
Жёсткость воды и способы её устранения. Практическая работа №6. 9 класс Теория строения органического вещества. 10 класс
Теория строения органического вещества. 10 класс Катионы 1, 2 аналитических групп
Катионы 1, 2 аналитических групп Периодические системы химических элементов
Периодические системы химических элементов Токсикология пестицидов
Токсикология пестицидов Алкадиены
Алкадиены Электролитическая диссоциация. Реакции ионного обмена
Электролитическая диссоциация. Реакции ионного обмена Чистые вещества и смеси. Способы разделения смесей
Чистые вещества и смеси. Способы разделения смесей Нуклеозиды. Нуклеиновые кислоты
Нуклеозиды. Нуклеиновые кислоты Чипсы: польза или вред. Химия
Чипсы: польза или вред. Химия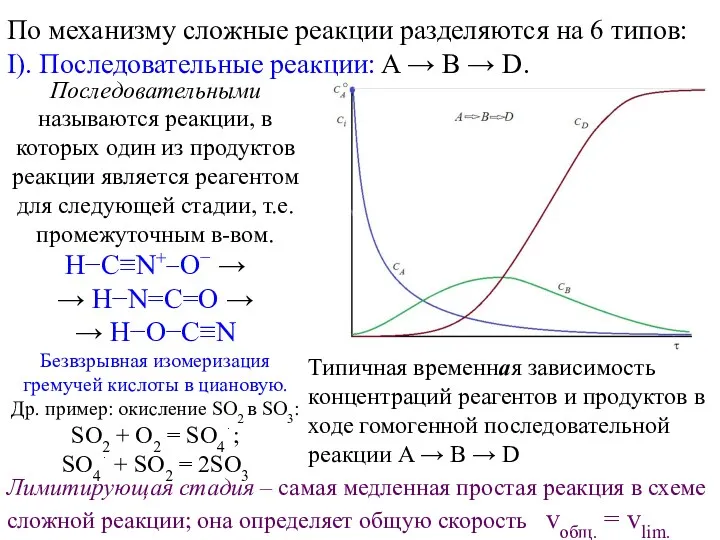 Сложные реакции по механизму
Сложные реакции по механизму