Содержание
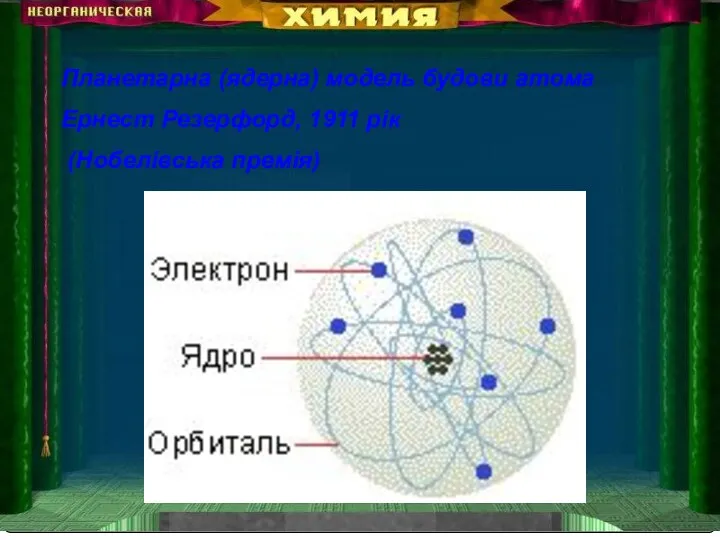
- 3. Планетарна (ядерна) модель будови атома Ернест Резерфорд, 1911 рік (Нобелівська премія)
- 4. Суть моделі В центрі атома знаходиться позитивно заряджене ядро. Навколо ядра рухаються негативно заряджені електрони, що
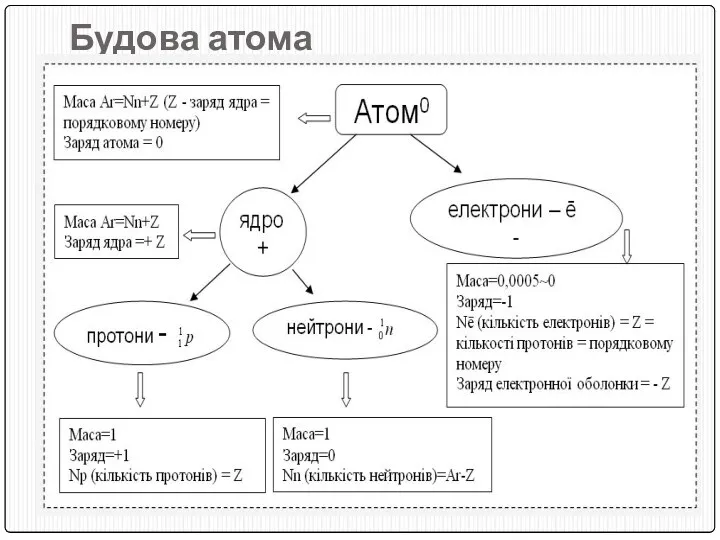
- 5. Склад ядра Які частинки входять до складу ядра? Які їх маси? Заряди? Як визначити їх число
- 6. Будова атома
- 7. Знаючи порядковий номер елемента та відносну атомну масу можна довідатися заряд ядра, кількість протонів, електронів, нейтронів.
- 8. Перевірка P -фосфор, порядковий номер 15 Z ядра= +15 Число e- = 15 Число p+ =
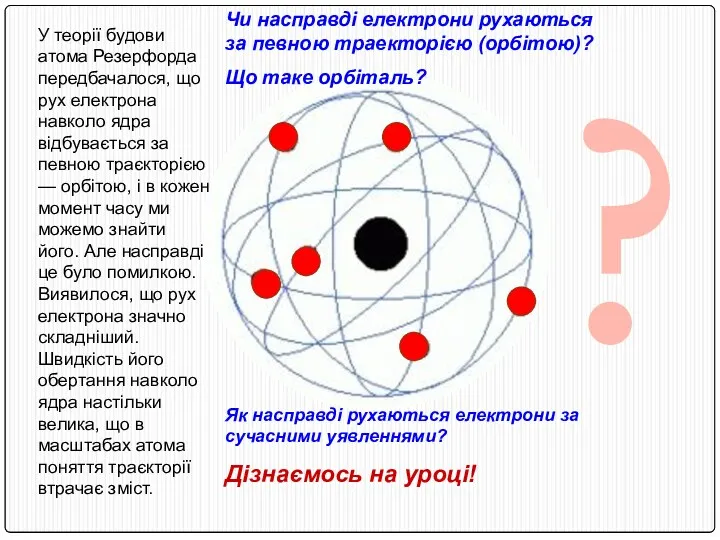
- 9. ? У теорії будови атома Резерфорда передбачалося, що рух електрона навколо ядра відбувається за певною траєкторією
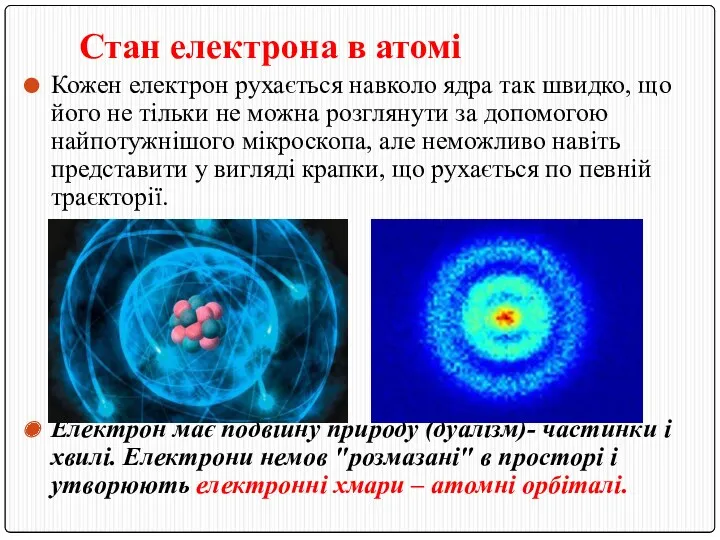
- 10. Стан електрона в атомі Кожен електрон рухається навколо ядра так швидко, що його не тільки не
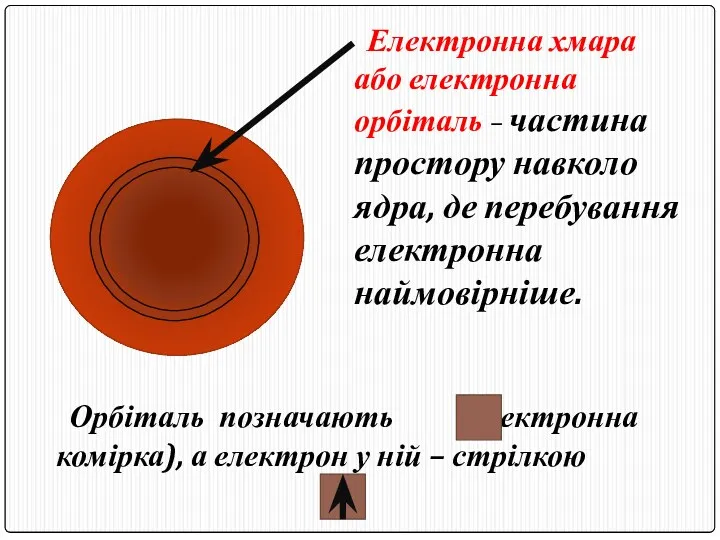
- 11. Електронна хмара або електронна орбіталь – частина простору навколо ядра, де перебування електронна наймовірніше. Орбіталь позначають
- 12. Навколо ядра електрони можуть утворювати орбіталі (хмари) різної форми: s-орбіталь сферичну s-орбіталь – кулеподібну електронну хмару
- 13. Електронні орбіталі S - орбіталь 1 квантова комірка Вчені домовились позначати кожну орбіталь коміркою – квадратиком.
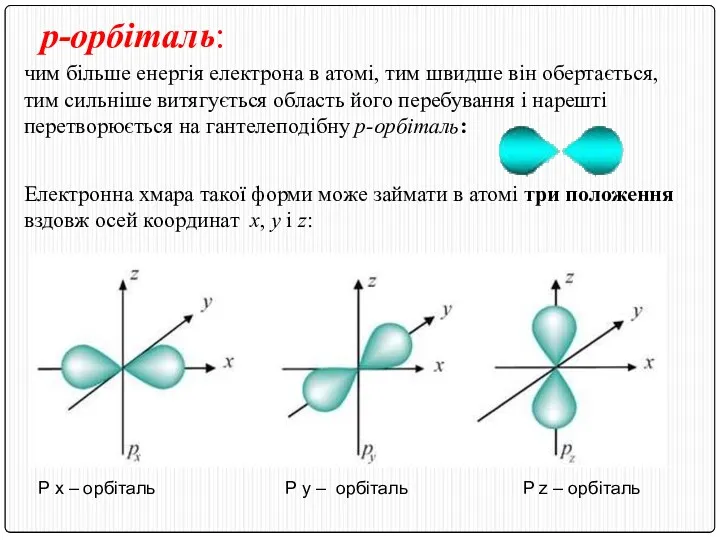
- 14. p-орбіталь: чим більше енергія електрона в атомі, тим швидше він обертається, тим сильніше витягується область його
- 15. Всі разом три електронні хмари, які називають px-, py- або pz-орбіталями, утворюють симетричну геометричну фігуру, в
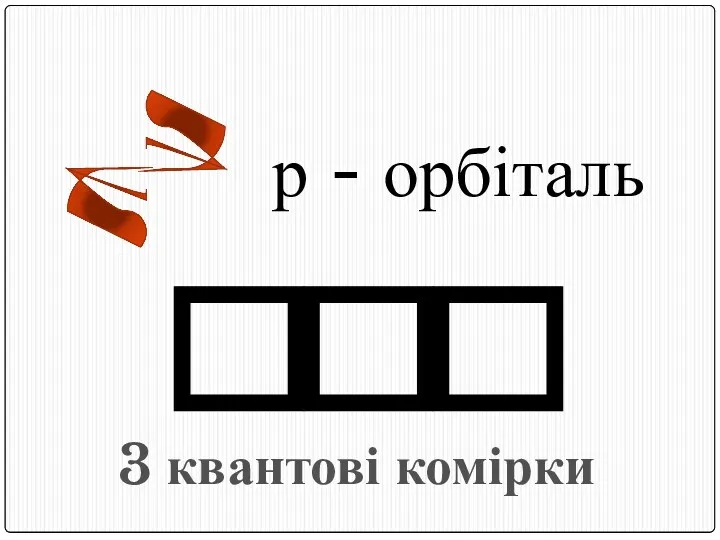
- 16. р - орбіталь 3 квантові комірки
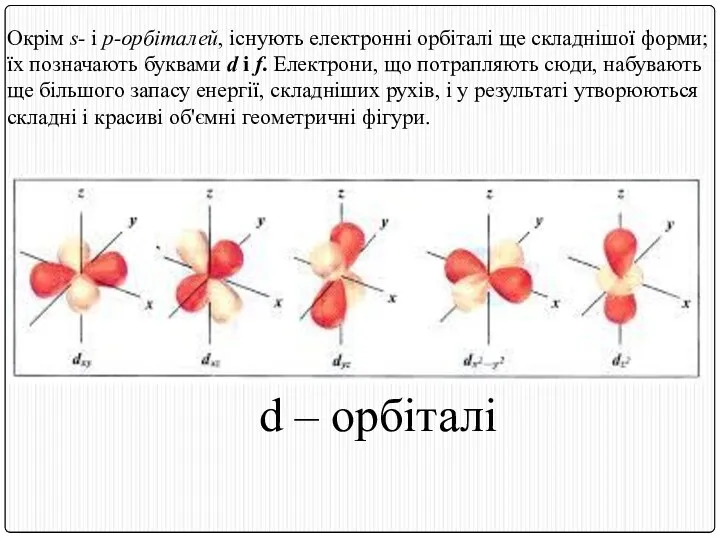
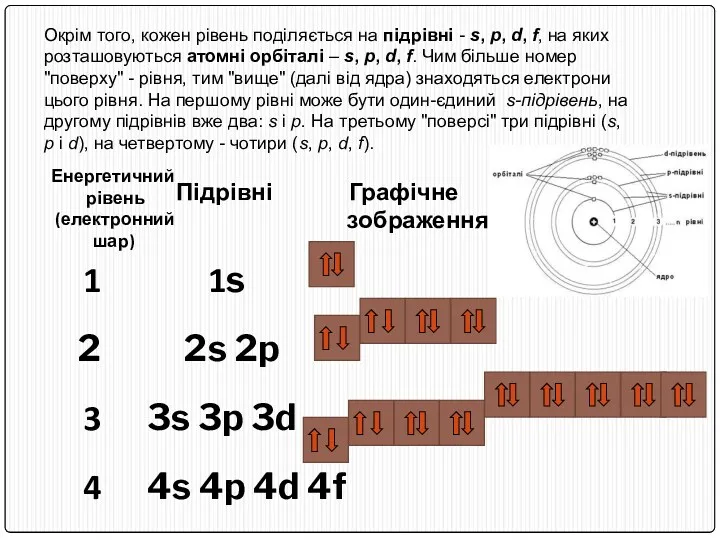
- 17. Окрім s- і p-орбіталей, існують електронні орбіталі ще складнішої форми; їх позначають буквами d і f.
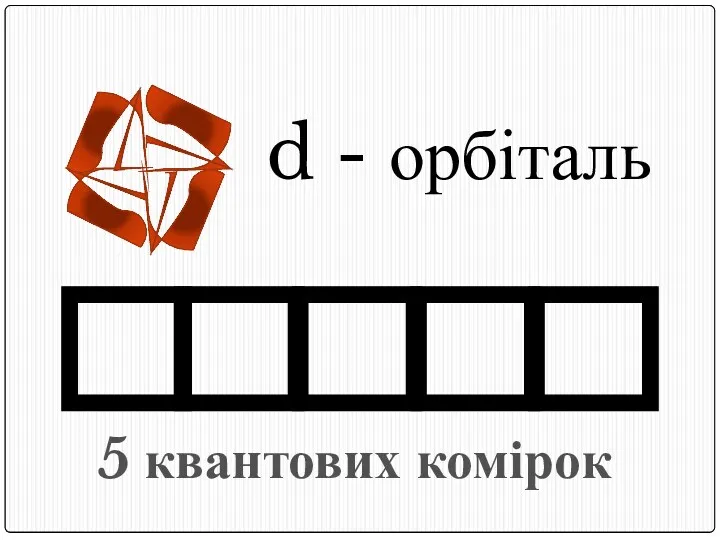
- 18. d - орбіталь 5 квантових комірок
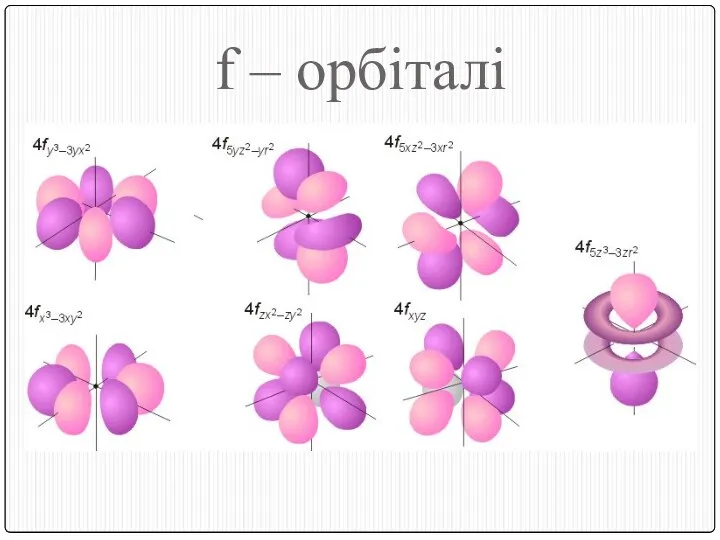
- 19. f – орбіталі
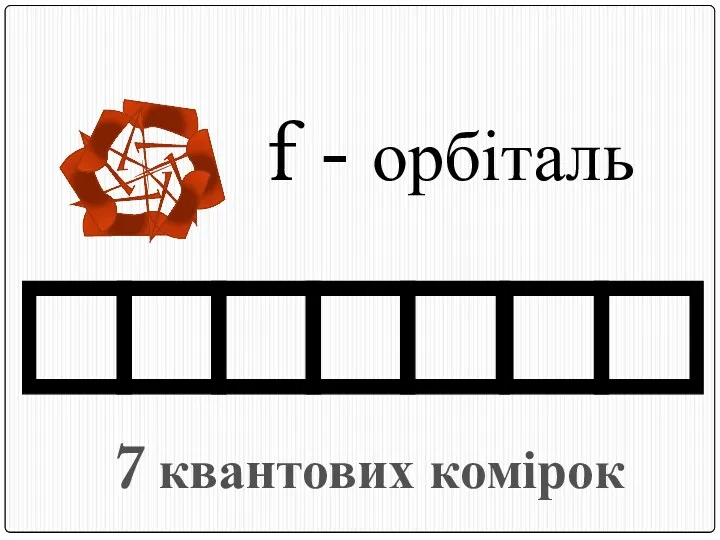
- 20. f - орбіталь 7 квантових комірок
- 21. Запам’ятай! Кількість орбіталей певного виду чітко визначена такими числами: s-орбіталь – 1, p-орбіталей – 3, d-орбіталей
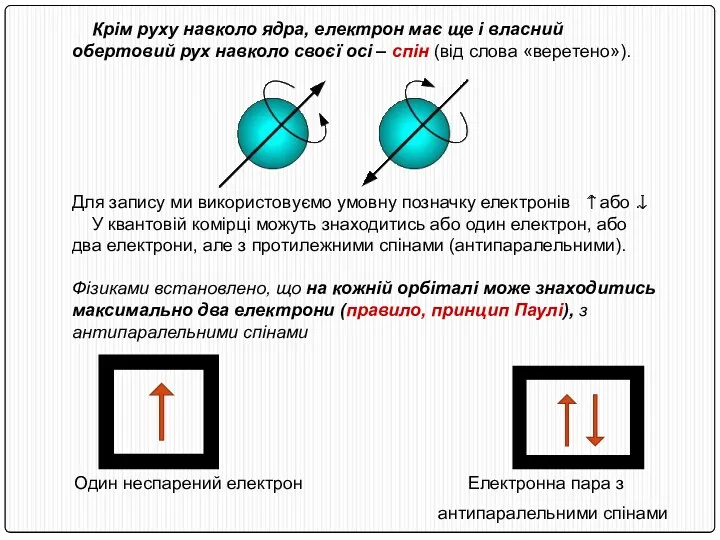
- 22. Крім руху навколо ядра, електрон має ще і власний обертовий рух навколо своєї осі – спін
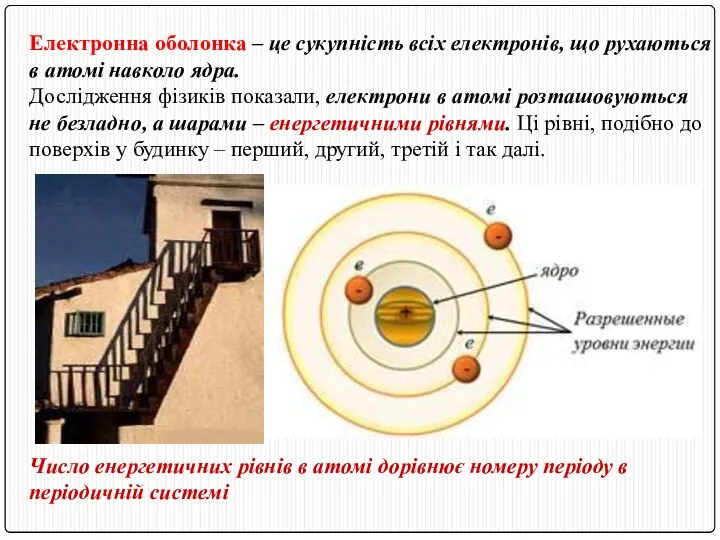
- 23. Електронна оболонка – це сукупність всіх електронів, що рухаються в атомі навколо ядра. Дослідження фізиків показали,
- 24. Енергетичний рівень (електронний шар) Підрівні Графічне зображення 1s 2s 2p 3 3s 3p 3d 4 4s
- 25. Домашнє завдання Прочитати параграфи 33 Опрацювати питання (1-7) с. 155
- 27. Скачать презентацию










 Типы химических реакций
Типы химических реакций Закон сохранения массы веществ
Закон сохранения массы веществ Современная химия. (Лекция 6)
Современная химия. (Лекция 6) Зиянды организмдерге қарсы органикалық және органикалық емес қосылыстарды қолдануға негізделген тәсіл
Зиянды организмдерге қарсы органикалық және органикалық емес қосылыстарды қолдануға негізделген тәсіл Кристаллические решетки
Кристаллические решетки Аналитические химические реакции. Классификация аналитических химических реакций
Аналитические химические реакции. Классификация аналитических химических реакций Материаловедение и технологии конструкционных материалов
Материаловедение и технологии конструкционных материалов Хімічний склад жувальної гумки
Хімічний склад жувальної гумки Мыльное чудо своими руками. История мыловарения. Изготовление мыла в домашних условиях
Мыльное чудо своими руками. История мыловарения. Изготовление мыла в домашних условиях Элементы триады железа: Fe, Co, Ni. (Лекция 16)
Элементы триады железа: Fe, Co, Ni. (Лекция 16) Техника безопасности в химической лаборатории и на уроках химии
Техника безопасности в химической лаборатории и на уроках химии Моющие средства
Моющие средства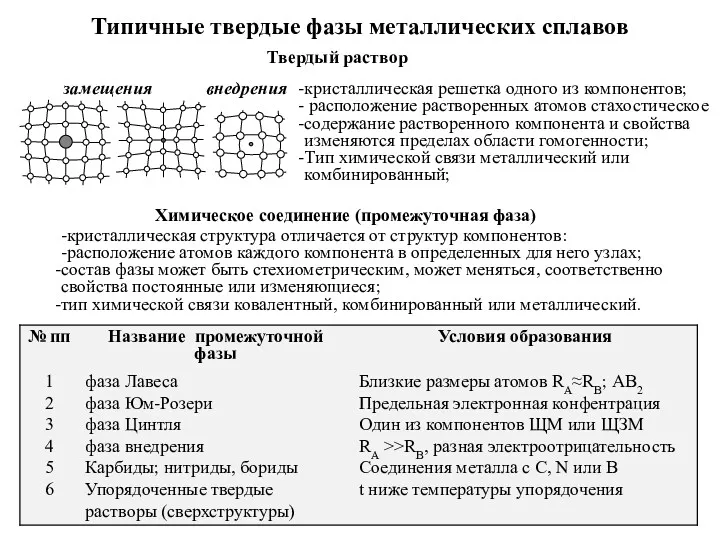 Типичные твердые фазы металлических сплавов
Типичные твердые фазы металлических сплавов Гигиена питания школьников
Гигиена питания школьников Классификация химических реакций
Классификация химических реакций Геохимия литосферы
Геохимия литосферы Гомополисахариды (углеводы растений)
Гомополисахариды (углеводы растений) Простые вещества. Металлы и неметаллы
Простые вещества. Металлы и неметаллы Полифенолды қосылыстар. Флавоноидтар
Полифенолды қосылыстар. Флавоноидтар Физико-химические свойства белков. Количественные (колориметрические) методы определения концентрации белка
Физико-химические свойства белков. Количественные (колориметрические) методы определения концентрации белка Гидролиз солей
Гидролиз солей Необоротні і оборотні хімічні процеси. Хімічна рівновага. Принцип Ле Шательє
Необоротні і оборотні хімічні процеси. Хімічна рівновага. Принцип Ле Шательє Введение. Развитие химической технологии как науки
Введение. Развитие химической технологии как науки Кислородсодержащие органические соединения
Кислородсодержащие органические соединения Щелочные металлы IА группы. Литий
Щелочные металлы IА группы. Литий Окисно-відновні реакції. 9 клас
Окисно-відновні реакції. 9 клас Пластмассы, синтетические каучуки
Пластмассы, синтетические каучуки Роль химии в создании новых материалов
Роль химии в создании новых материалов