Содержание
- 2. Ф. Вёлер 1800–1882 гг. Выделил металлический алюминий иным и более эффективным методом: нагреванием безводного хлорида алюминия
- 3. Анри Сент-Клер Девиль 1811–1881 гг. Разработал другой химический процесс получения алюминия: хлористый алюминий нагревали с натрием,
- 5. Название элемента образовано от латинского alumen — квасцы. Данный элемент носил несколько названий. Так, Дэви, предполагая
- 6. До открытия промышленного способа получения алюминия этот металл был дороже золота. В 1889 г. британцы, желая
- 7. Materialscientist Физические свойства алюминия
- 8. Физические свойства алюминия Алюмосиликаты Бокситы
- 10. Температура плавления алюминия довольно низкая (660 °C). Алюминий — хороший проводник теплоты и электрического тока. Имеет
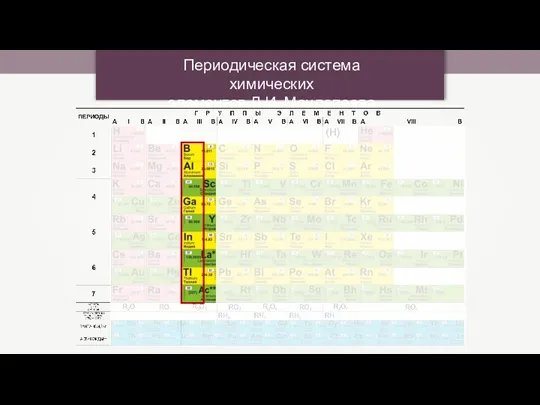
- 11. Периодическая система химических элементов Д.И. Менделеева
- 13. Li, K, Ba, Ca, Na, Mg, Al, Mn, Zn, Cr, Fe, Co, Sn, Pb, H, Cu,
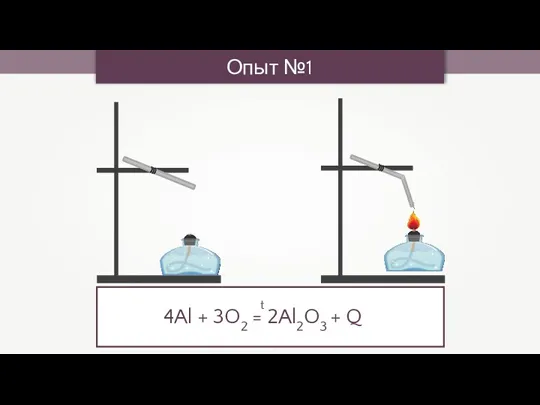
- 14. Опыт №1 4Al + 3O2 = 2Al2O3 + Q t
- 15. Алюминий легко реагирует с неметаллами, реакции проходят бурно с выделением большого количества теплоты, но для начала
- 16. 2Al + 3Br2 = 2AlBr3 0 0 +3 –1 При взаимодействии алюминия с бромом получаем бромид
- 17. 2Al + 3S = Al2S3 0 0 +3 –2 При взаимодействии алюминия с серой получаем сульфид
- 18. 4Al + 3С = Al4С3 0 0 +3 –4 При взаимодействии алюминия с углеродом образуется карбид
- 19. Реакция алюминия с водой 2Al + 6H2O = 2Al(OH)3 + 3H2
- 20. Реакция алюминия со щелочами 2Al + 2NaOH + 6H2O = 2Na[Al(OH)4] + 3H2
- 21. Опыт №2 2Al + 6HCl = 2AlCl3 + 3H2↑ 2Al + 3H2SO4(разб.)= Al2(SO4)3 + 3H2↑
- 22. С концентрированной азотной и серной кислотой алюминий при обычной температуре не реагирует. Поэтому их кислоту можно
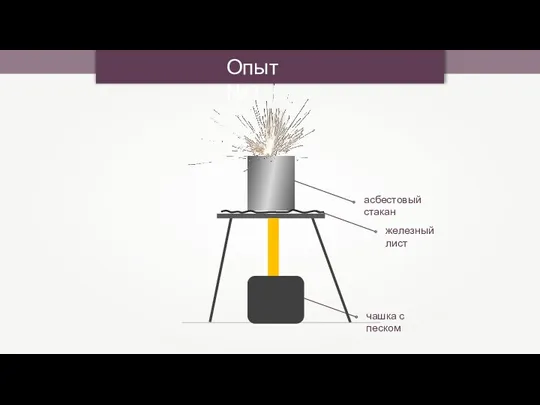
- 23. Метод алюминотермии 8Al + 3Fe3O4 = 4Al2O3 + 9Fe t
- 24. Опыт №3 асбестовый стакан железный лист чашка с песком
- 25. Амфотерный характер оксида алюминия и особенности свойств соединения показывают, что металлические свойства у алюминия выражены несколько
- 26. Оксид алюминия Al2O3
- 27. Корунд
- 28. Al2O3+6HCl=2AlCl3+3H2O Оксид алюминия не растворяется в воде и не реагирует с ней. Оксид алюминия амфотерен. По
- 29. По отношению к щелочам оксид алюминия ведет себя как кислотный оксид. Al2O3 + 2NaOH + 3H2O
- 30. Гидроксид алюминия Al(OH)3
- 31. Получение гидроксида алюминия AlCl3+3NaOH=Al(OH)3+3NaCl
- 32. Если на гидроксид алюминия подействовать какой-либо кислотой, например, соляной, то осадок исчезнет и получится прозрачный раствор:
- 33. Алюминий в природе
- 34. По распространённости в земной коре среди металлов занимает первое место и третье место после кислорода и
- 35. Природные соединения, содержащие алюминий Алюмосиликаты Бокситы
- 36. Алюмосиликаты Эти соединения можно рассматривать как соли, образованные оксидами алюминия, кремния, щелочных и щёлочноземельных металлов.
- 37. Бокситы
- 38. Применение алюминия
- 42. Высокая электрическая проводимость чистого алюминия используется в электротехнике.
- 44. Серебряная краска
- 48. Скачать презентацию
















![Реакция алюминия со щелочами 2Al + 2NaOH + 6H2O = 2Na[Al(OH)4] + 3H2](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/336761/slide-19.jpg)

























 Катализ. Классификация каталитических процессов. Механизм действия катализаторов
Катализ. Классификация каталитических процессов. Механизм действия катализаторов Растворимость веществ в воде. Растворы. 8 класс
Растворимость веществ в воде. Растворы. 8 класс Азот. Фосфор
Азот. Фосфор Нанотрубка - как аллотропная модификация углерода
Нанотрубка - как аллотропная модификация углерода Как трудно быть особенной…
Как трудно быть особенной… Массовая и объемная доля компонентов смеси
Массовая и объемная доля компонентов смеси Кремнекислые породы. Жильные и эффузивные породы
Кремнекислые породы. Жильные и эффузивные породы Электродные потенциалы
Электродные потенциалы Моносахариды, дисахариды
Моносахариды, дисахариды Значение органической химии в жизни человека
Значение органической химии в жизни человека Спирти. Класифікація спиртів. Властивості одноатомних спиртів
Спирти. Класифікація спиртів. Властивості одноатомних спиртів Химическая связь
Химическая связь Кількість речовини
Кількість речовини Закон сохранения массы веществ. Уравнения химических реакций
Закон сохранения массы веществ. Уравнения химических реакций Неметаллы: общая характеристика. 9 класс
Неметаллы: общая характеристика. 9 класс Щелочно-земельные металлы
Щелочно-земельные металлы Свинец — простое вещество, металл, химический элемент IV группы таблицы Менделеева
Свинец — простое вещество, металл, химический элемент IV группы таблицы Менделеева Горючее, смазочные материалы и специальные жидкости
Горючее, смазочные материалы и специальные жидкости Реакции окисления и восстановления органических соединений
Реакции окисления и восстановления органических соединений Путешествие на остров Соединений химических элементов. Урок-игра
Путешествие на остров Соединений химических элементов. Урок-игра Задачи
Задачи Средние породы. Типичный андезитовый вулкан
Средние породы. Типичный андезитовый вулкан Гидролиз солей
Гидролиз солей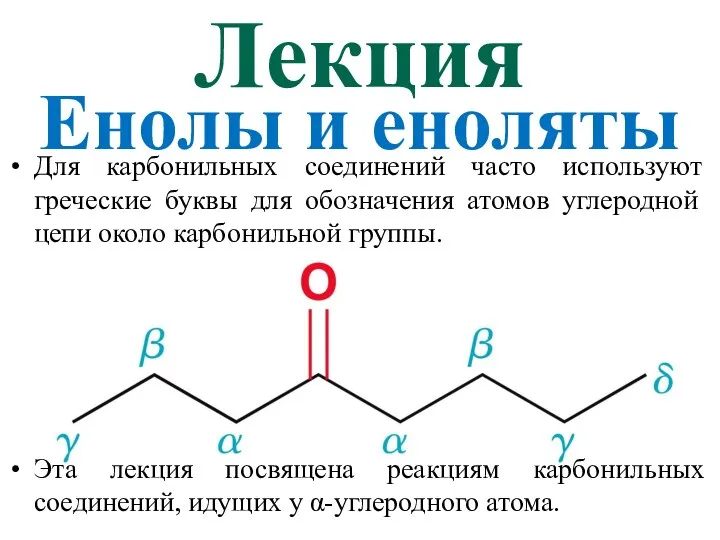 Енолы и еноляты
Енолы и еноляты Относительная атомная масса
Относительная атомная масса Химический элемент хлор
Химический элемент хлор Коррозия строительных материалов. Общие положения
Коррозия строительных материалов. Общие положения Д. И. Менделеев человек - загадка
Д. И. Менделеев человек - загадка