Содержание
- 2. Частицы растворенного вещества в воде окружены гидратной оболочкой. В некоторых случаях это приводит к химическому взаимодействию
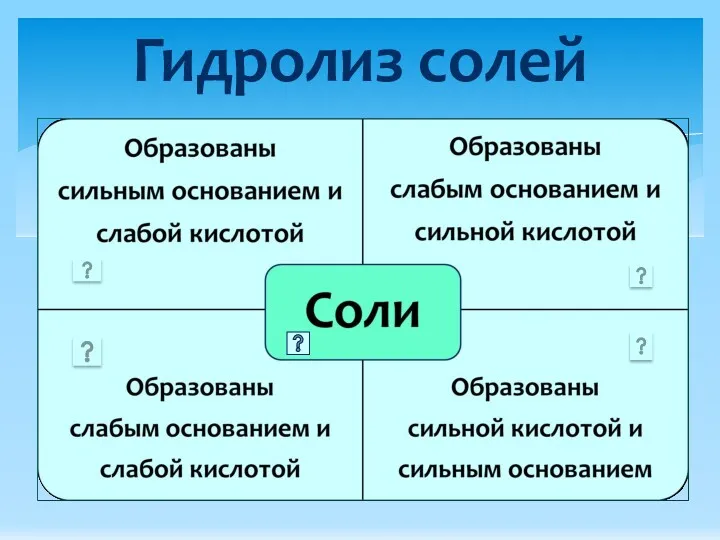
- 3. Гидролиз солей
- 4. Определение реакций среды растворов солей универсальным индикатором
- 5. Алгоритм составления уравнений гидролиза солей 1. Записать уравнение диссоциации соли; 2. Выбрать слабый ион; 3. Записать
- 6. Гидролиз солей, образованных слабым основанием и слабой кислотой: Al2 (CO3)3 ↔ 2Al3+ + 3CO32─ H2O ↔
- 7. Необратимый гидролиз солей, образованных слабым основанием и слабой кислотой: 3Na2CO3 + 2AlCl3 → Al2(CO3)3 + 6NaCl
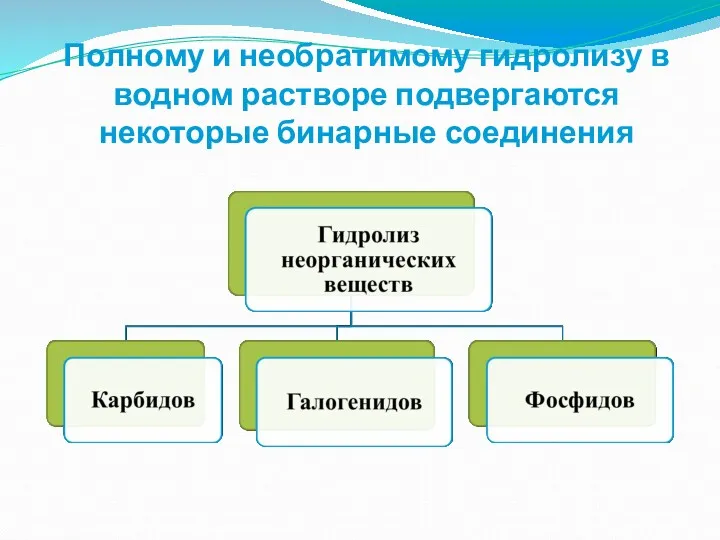
- 8. Полному и необратимому гидролизу в водном растворе подвергаются некоторые бинарные соединения
- 9. Гидролиз бинарных соединений Гидролиз фосфидов: Са3P2 + 6H2O = 3Са(OH)2 + 2PH3↑ фосфид фосфин кальция Гидролиз
- 10. Факторы, влияющие на условия протекания гидролиза 1. Химическая природа соли 2. Температура 3. Концентрация соли 4.
- 12. Условия смещения реакций обратимого гидролиза (согласно принципу Ле Шателье) Усилить гидролиз соли можно следующими способами: Добавить
- 13. Тест 1.Гидролизу по катиону и аниону подвергается соль : А) K2S, Б) KCl, В)(NH4)2CO3 , Г)
- 14. Ответы к тесту. 1. 1-3 2. А-2 Б-3 В-1 3. А-4 Б-1 В-2 Г-2 4. А-1
- 15. Роль гидролиза: В природе: преобразование земной коры; обеспечение слабощелочной среды морской воды. В народном хозяйстве: выработка
- 17. Скачать презентацию












 Хімічні властивості металів
Хімічні властивості металів Карбоновые кислоты. Тест
Карбоновые кислоты. Тест Материаловедение. Основные задачи материаловедения
Материаловедение. Основные задачи материаловедения Электролитическая диссоциация. Вещества в растворах
Электролитическая диссоциация. Вещества в растворах Общая электронная теория восстановления и окисления металлов
Общая электронная теория восстановления и окисления металлов Фосфор. Урок в 9 классе
Фосфор. Урок в 9 классе Химические свойства кислот
Химические свойства кислот Кристаллические решетки
Кристаллические решетки Пробоотбор других ООС. Лекция 3
Пробоотбор других ООС. Лекция 3 Дисперсные системы в атмосфере
Дисперсные системы в атмосфере Хром. Физические и химические свойства
Хром. Физические и химические свойства Титан және оның қорытпалары. Титанның физика-химиялық қасиеттері
Титан және оның қорытпалары. Титанның физика-химиялық қасиеттері Химический факультет
Химический факультет Химия как компонент системы естественнонаучного образования
Химия как компонент системы естественнонаучного образования Cromatografia ionică
Cromatografia ionică Основні класи неорганічних сполук
Основні класи неорганічних сполук Алюминий и сплавы на его основе
Алюминий и сплавы на его основе Комплексообразователь. (Лекция 5)
Комплексообразователь. (Лекция 5) Как и где используется соляная кислота
Как и где используется соляная кислота Электрохимические процессы
Электрохимические процессы Кислород. Атом кислорода
Кислород. Атом кислорода Тепловой эффект химических реакций. 8 класс
Тепловой эффект химических реакций. 8 класс Классификация и общая характеристика механизмов образования свободных радикалов и активных форм кислорода
Классификация и общая характеристика механизмов образования свободных радикалов и активных форм кислорода Гранулометрический состав горных пород
Гранулометрический состав горных пород Дезодоранты. Антиперспиранты
Дезодоранты. Антиперспиранты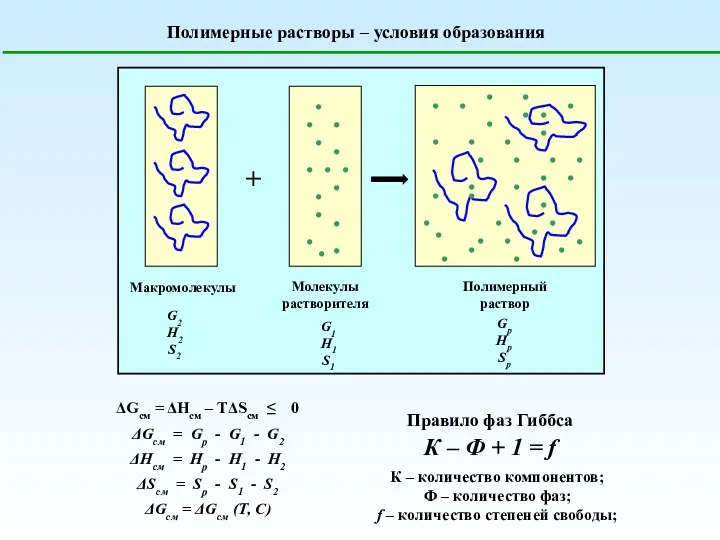 Полимерные растворы. Условия образования
Полимерные растворы. Условия образования Химиялық тепе-теңдік
Химиялық тепе-теңдік Неметаллы. Общая характеристика неметаллов
Неметаллы. Общая характеристика неметаллов