Содержание
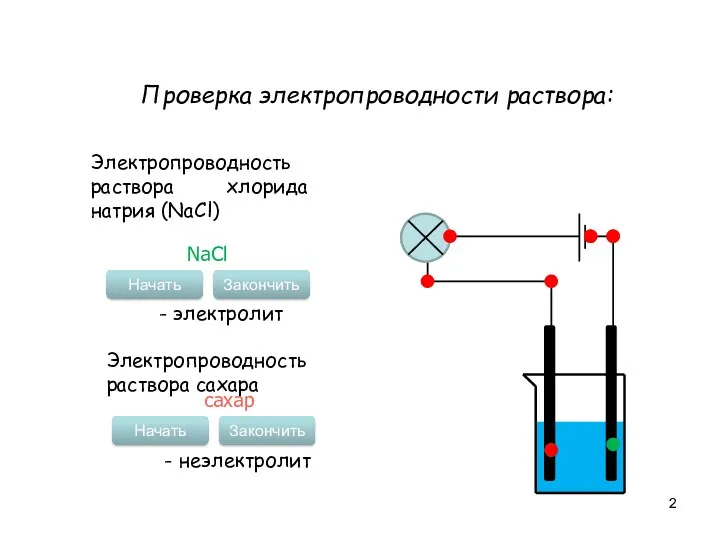
- 2. Проверка электропроводности раствора: Электропроводность раствора хлорида натрия (NaCl) Начать Закончить NaCl - электролит Электропроводность раствора сахара
- 3. Вещества (составить схему стр. 26) Название группы веществ примеры Название группы веществ примеры
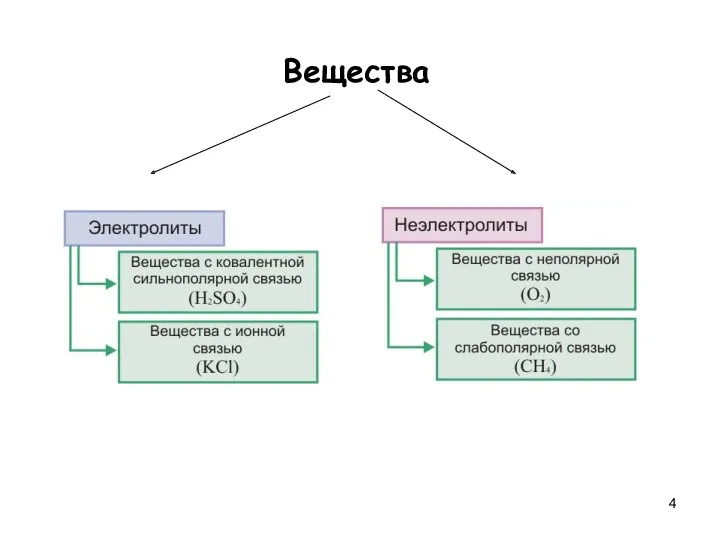
- 4. Вещества
- 5. Задание. Из предложенного списка выбери вещества, которые относятся к электролитам. 1) HCl; 6) H2SO4; 2) N2;
- 6. Электролитическая диссоциация - (написать определение - низ стр. 26, вверх стр.27) Сванте Август Аррениус 1859-1927гг. Шведский
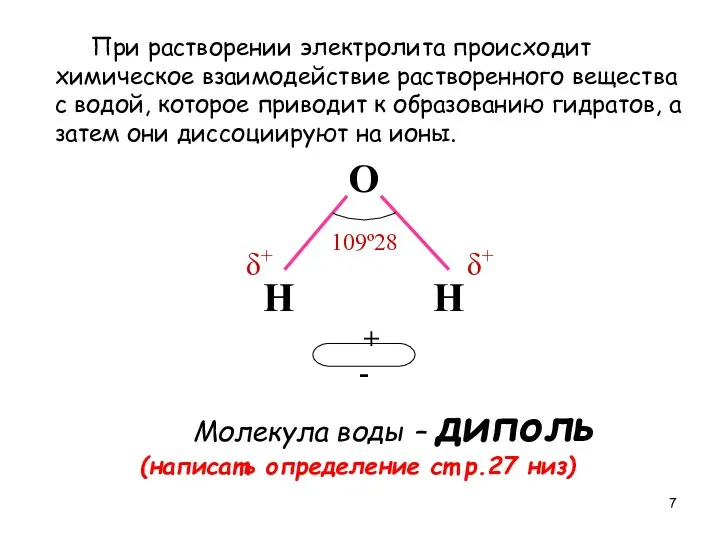
- 7. При растворении электролита происходит химическое взаимодействие растворенного вещества с водой, которое приводит к образованию гидратов, а
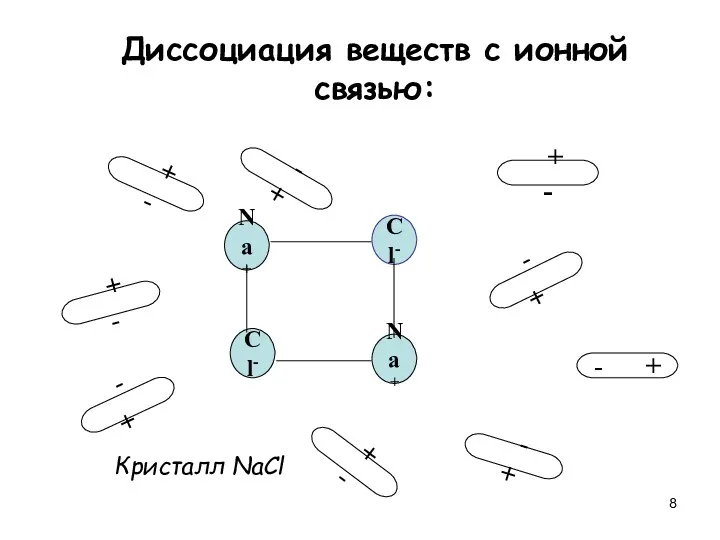
- 8. Диссоциация веществ с ионной связью: Na+ Cl- Cl- Na+ + - + - + - -
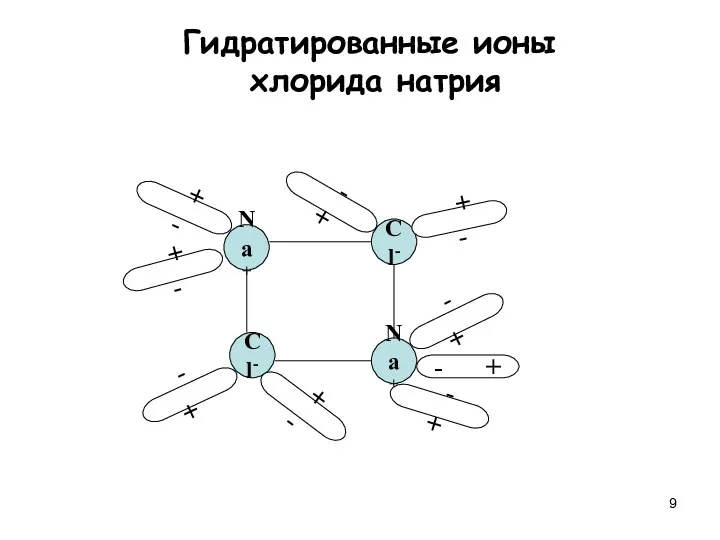
- 9. Na+ Cl- Cl- Na+ + - + - + - - + - + - +
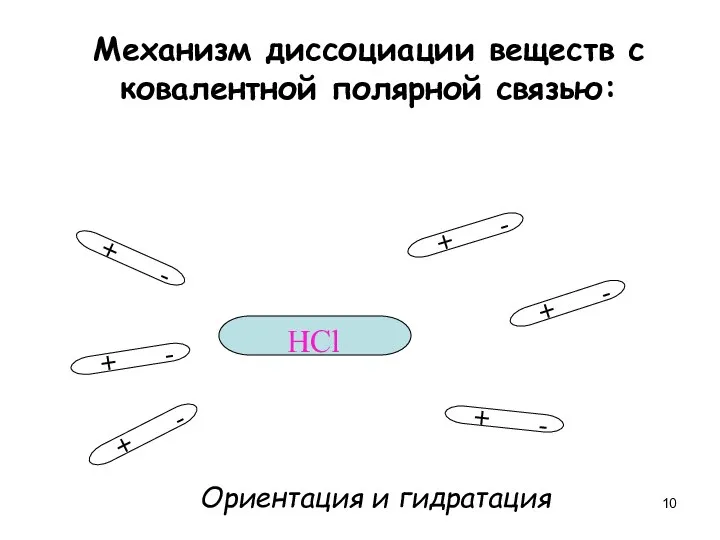
- 10. Механизм диссоциации веществ с ковалентной полярной связью: + - + - + - + - +
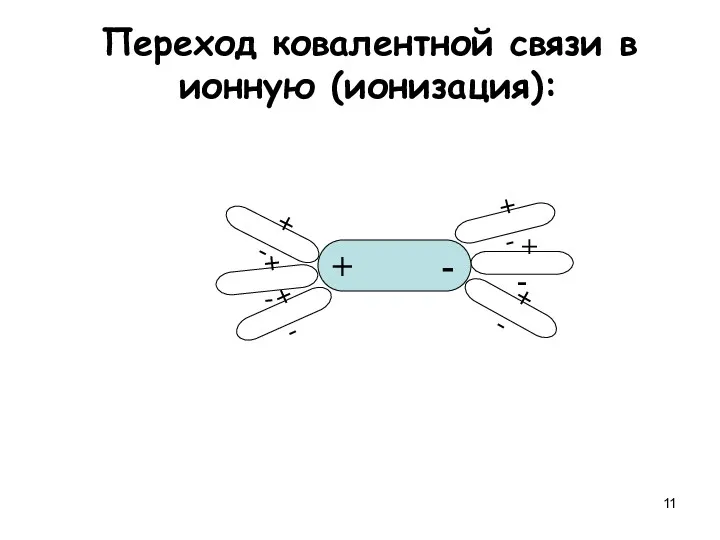
- 11. Переход ковалентной связи в ионную (ионизация): + - + - + - + - + -
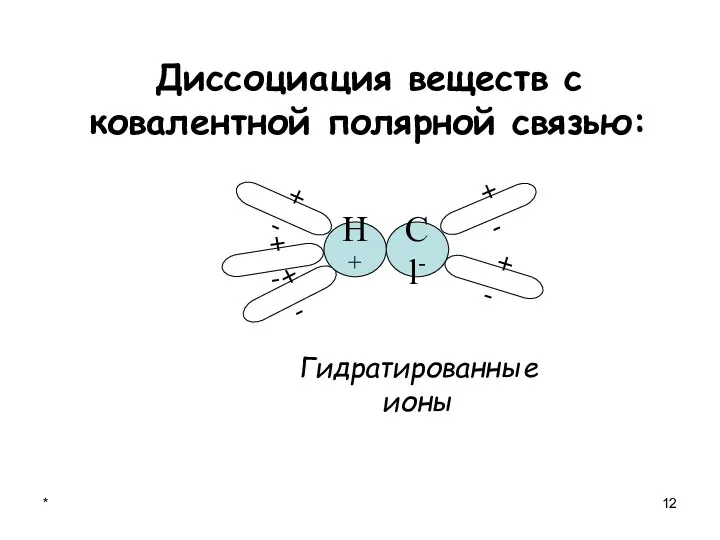
- 12. * Диссоциация веществ с ковалентной полярной связью: + - + - + - + - Гидратированные
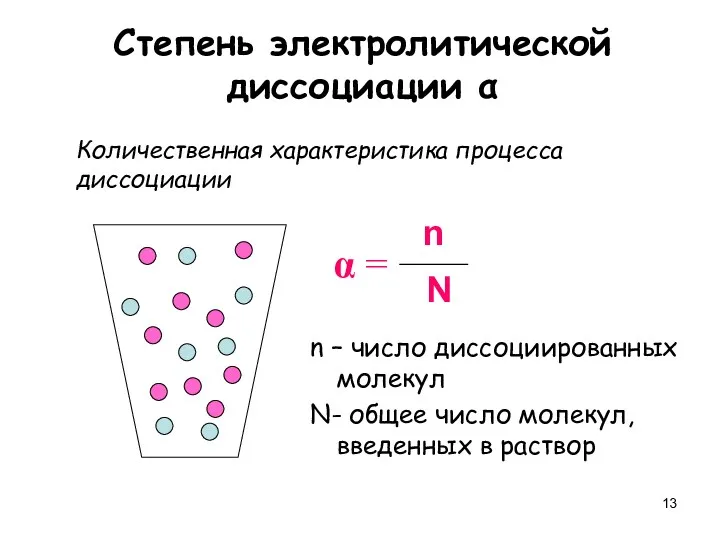
- 13. Степень электролитической диссоциации α Количественная характеристика процесса диссоциации n – число диссоциированных молекул N- общее число
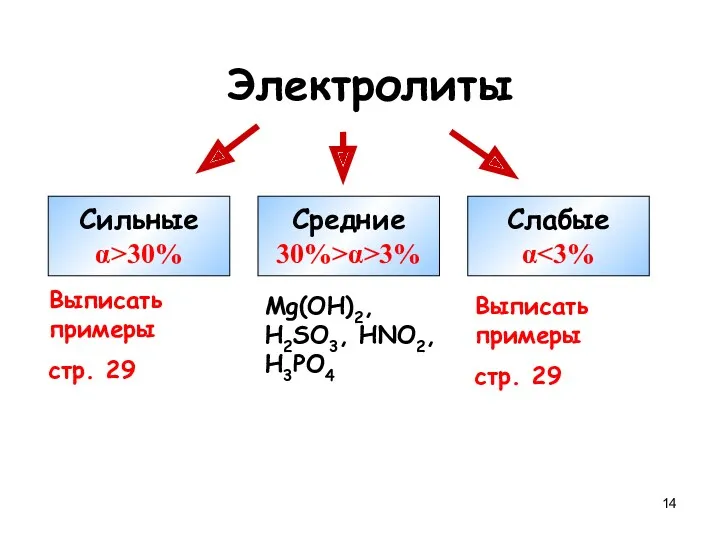
- 14. Электролиты Сильные α>30% Средние 30%>α>3% Слабые α Выписать примеры стр. 29 Mg(OH)2, H2SO3, HNO2, H3PO4 Выписать
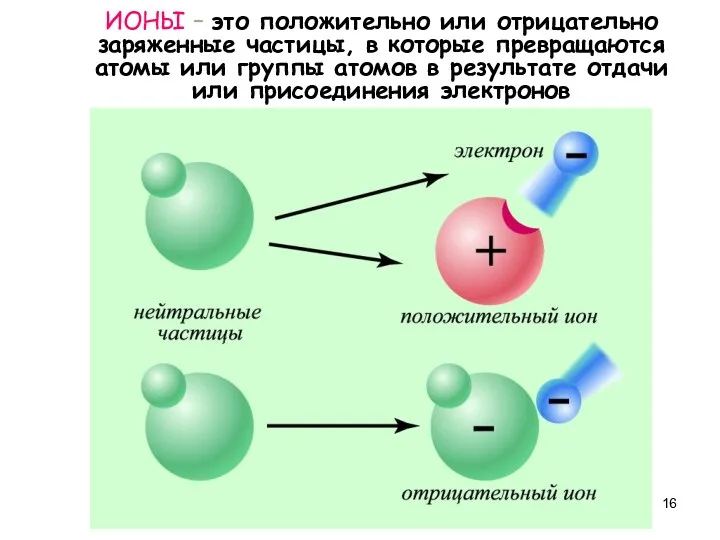
- 16. ИОНЫ – это положительно или отрицательно заряженные частицы, в которые превращаются атомы или группы атомов в
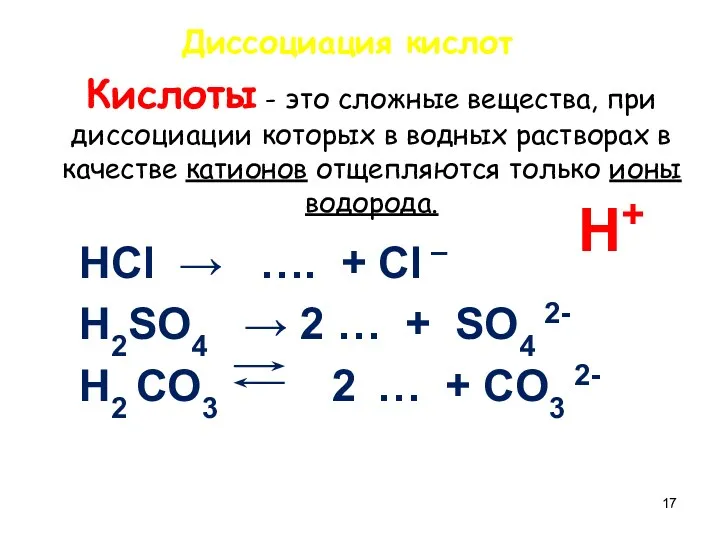
- 17. Кислоты - это сложные вещества, при диссоциации которых в водных растворах в качестве катионов отщепляются только
- 18. Основания - это сложные вещества, при диссоциации которых в водных растворах в качестве анионов отщепляются только
- 19. Диссоциация солей Соли -это сложные вещества, которые в водных растворах диссоциируют на катионы металла и анионы
- 20. Задание. Напишите уравнение диссоциации веществ. 1. KNO3 2. Mg(NO3)2 3. Ba(OH)2 4. HCl 5. Na2SO4 6.
- 21. Характерные симптомы дефицита химических элементов в организме человека
- 22. * Что называют электролитической диссоциацией? Какие вещества называют электролитами? Какие вещества к ним относятся? Какой тип
- 23. * Задание. Пользуясь таблицей растворимости, определите, водные растворы каких веществ будут диссоциировать на ионы: КСl, CuO,
- 25. Скачать презентацию


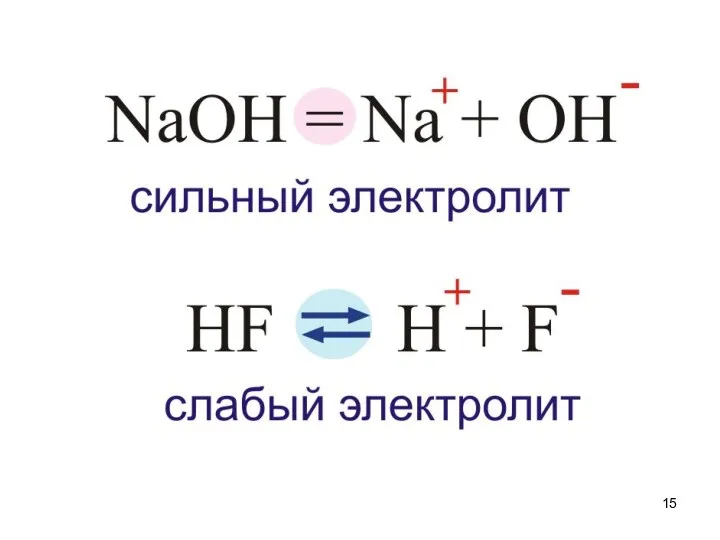






 Липиды. Классификация липидов
Липиды. Классификация липидов Галогены. Положение в ПСХЭ Д.И. Менделеева
Галогены. Положение в ПСХЭ Д.И. Менделеева Аминокислоты – структурные единицы белков
Аминокислоты – структурные единицы белков Фосфор и его соединения. 11 класс
Фосфор и его соединения. 11 класс Строение и свойства атомов в свете квантовомеханической теории. Периодический закон – основа основ химии
Строение и свойства атомов в свете квантовомеханической теории. Периодический закон – основа основ химии Растворы. Дисперсные системы. Термодинамика процесса растворения. (Лекция 2)
Растворы. Дисперсные системы. Термодинамика процесса растворения. (Лекция 2) Ферменты в пищевой промышленности
Ферменты в пищевой промышленности Основи. Хімія
Основи. Хімія Автомобильные пластичные смазки
Автомобильные пластичные смазки Характеристика химических элементов и химических реакций
Характеристика химических элементов и химических реакций Химический состав пресных вод рыбохозяйственного назначения
Химический состав пресных вод рыбохозяйственного назначения Горение вещества и способы его прекращения
Горение вещества и способы его прекращения Лекция Атомное строение твердых тел. 1-01
Лекция Атомное строение твердых тел. 1-01 Нефть
Нефть Металлы; их классификация, строения и свойства
Металлы; их классификация, строения и свойства Химическая промышленность
Химическая промышленность Группа редкоземельных элементов
Группа редкоземельных элементов Технологическое проектирование процессов переработки пэн
Технологическое проектирование процессов переработки пэн Электролиз водных растворов
Электролиз водных растворов Растворы. Способы выражения концентраций. Сильные и слабые электролиты. Закон разведения Оствальда. Лекция 02-1
Растворы. Способы выражения концентраций. Сильные и слабые электролиты. Закон разведения Оствальда. Лекция 02-1 Диаграмма состояния Железо – Углерод. Материаловедение. Лекция 2
Диаграмма состояния Железо – Углерод. Материаловедение. Лекция 2 Состав энергетических напитков
Состав энергетических напитков Химическая связь. (Лекция 4, 5)
Химическая связь. (Лекция 4, 5) Качественные реакции. Анионы
Качественные реакции. Анионы 20231110_amfoternye_oksidy_i_gidroksidy
20231110_amfoternye_oksidy_i_gidroksidy Детонаційна стійкість бензину
Детонаційна стійкість бензину Азот
Азот Оксид серы (IV) и серы (VI)
Оксид серы (IV) и серы (VI)