Содержание
- 2. Наиболее простыми органическими соединениями являются предельные углеводороды или алканы Углеродный скелет представляет собой открытую линейную или
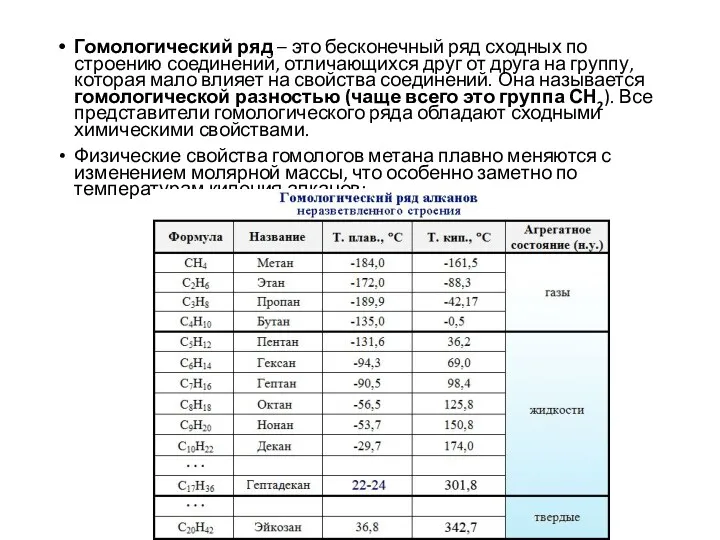
- 3. Гомологический ряд – это бесконечный ряд сходных по строению соединений, отличающихся друг от друга на группу,
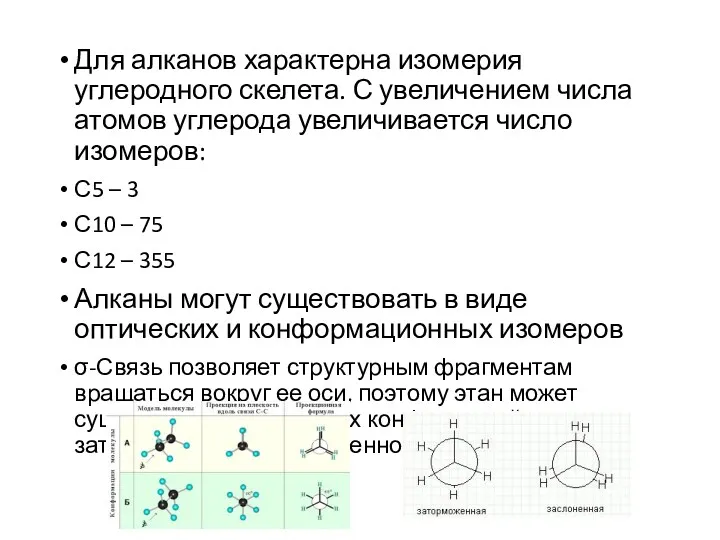
- 4. Для алканов характерна изомерия углеродного скелета. С увеличением числа атомов углерода увеличивается число изомеров: С5 –
- 5. Способы получения алканов Предельные углеводороды широко встречаются в природе. Источниками являются: Природный газ - основную часть
- 6. Лабораторные способы получения алканов 1. Реакции с сохранением углеродного скелета Гидрирование алкенов и алкинов Восстановление галогенпроизводных
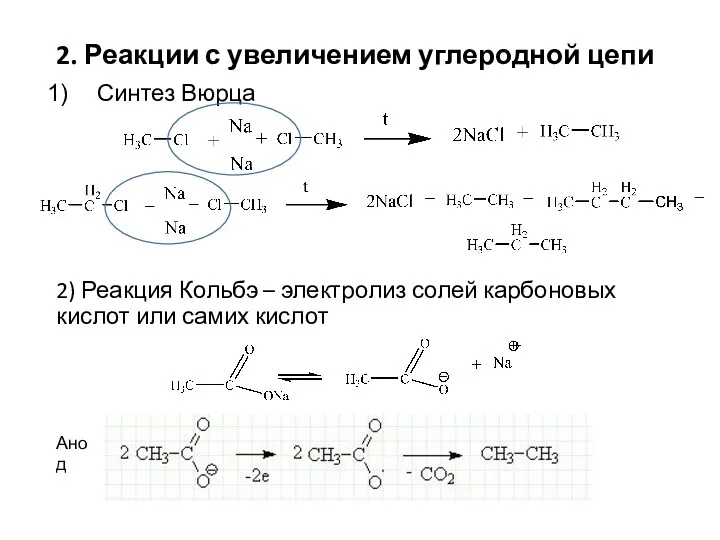
- 7. 2. Реакции с увеличением углеродной цепи Синтез Вюрца 2) Реакция Кольбэ – электролиз солей карбоновых кислот
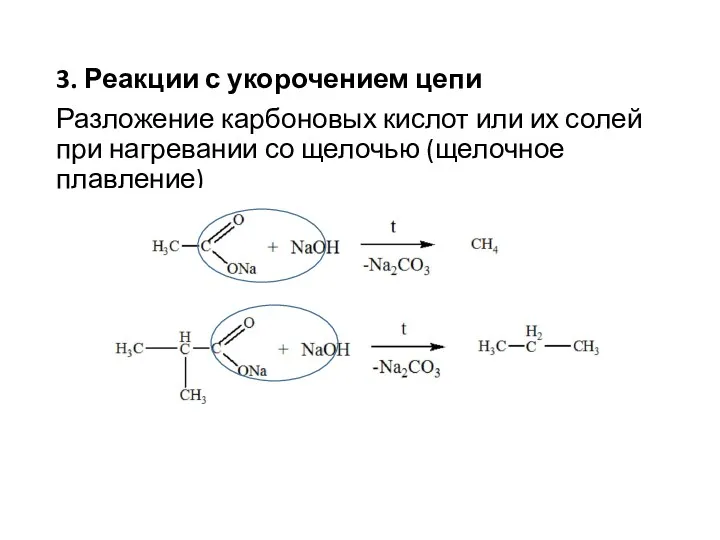
- 8. 3. Реакции с укорочением цепи Разложение карбоновых кислот или их солей при нагревании со щелочью (щелочное
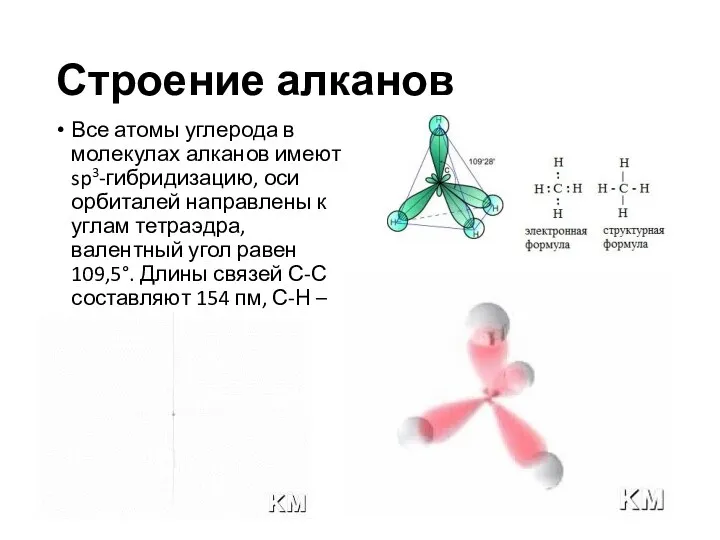
- 9. Строение алканов Все атомы углерода в молекулах алканов имеют sp3-гибридизацию, оси орбиталей направлены к углам тетраэдра,
- 10. Химические свойства алканов Алканы – химически устойчивые соединения. Причина: высокая прочность σ-связей С-С и С-Н; неполярность
- 11. 1. Реакции замещения (SR) Свободно-радикальный механизм Галогенирование. Скорость зависит от типа галогена. Активно с фтором, с
- 13. 2. Термические превращения алканов Крекинг (термический и каталитический) Пиролиз Циклизация (ароматизация)
- 14. 3. Изомеризация
- 15. 4. Окисление При высокой температуре на воздухе алканы сгорают до углекислого газа и воды их пары
- 16. Реакционная способность Реакционная способность алканов увеличивается начиная с метана с увеличением числа атомов углерода в молекуле
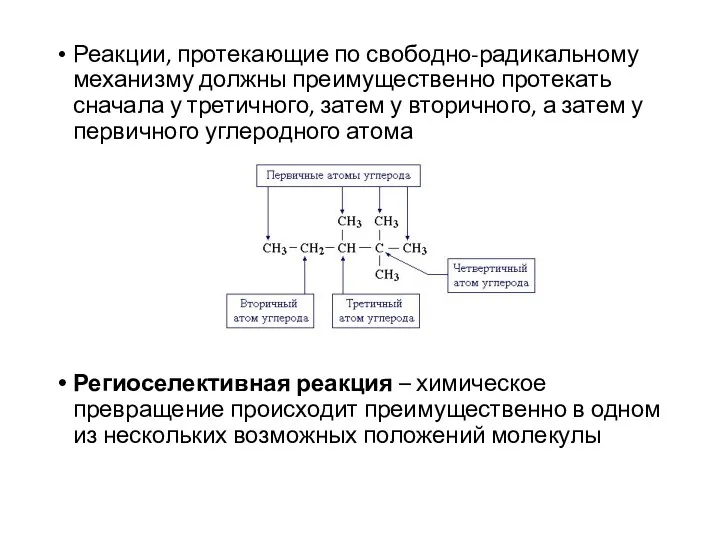
- 17. Реакции, протекающие по свободно-радикальному механизму должны преимущественно протекать сначала у третичного, затем у вторичного, а затем
- 18. Применение алканов Газообразные алканы (метан и пpопан-бутановая смесь) используются в качестве ценного топлива. Жидкие углеводоpоды составляют
- 19. Галогенпроизводные алканов
- 20. К галогеналканам причисляют предельные алифатические соединения, в молекулах которых присутствует атом галогена вместо одного (или нескольких)
- 21. Получение галогеналканов Реакции замещения из алканов (свободно-радикальное замещение, SR ) из спиртов (нуклеофильное замещение, SN )
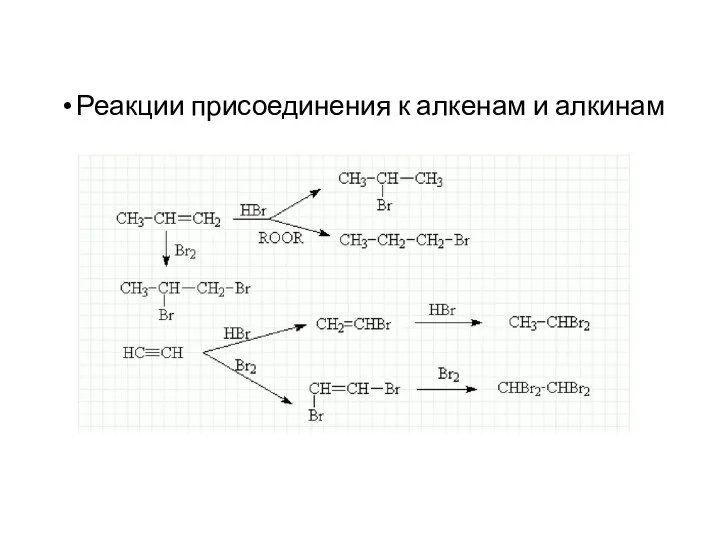
- 22. Реакции присоединения к алкенам и алкинам
- 23. Строение галогеналканов и реакционная способность Замена атомов водорода на галоген делает соединение химически активным, т.к. связь
- 24. Химические свойства Реакции замещения (нуклеофильное) Под действием нуклеофильного реагента (донора пары электронов) OH– происходит гетеролитический разрыв
- 25. Химические свойства Реакции отщепления (элиминирования) под действием спиртовой щелочи Атом водорода отщепляется от соседнего наименее гидрогенизированного
- 27. Скачать презентацию
















 Алканы. Строение, номенклатура, изомерия, химические и физические свойства
Алканы. Строение, номенклатура, изомерия, химические и физические свойства Химические волокна
Химические волокна Жидкие вещества
Жидкие вещества Натуральный каучук
Натуральный каучук Неметаллические материалы
Неметаллические материалы Химические реакции. Типы химических реакций
Химические реакции. Типы химических реакций Строение, свойства и применение алкенов
Строение, свойства и применение алкенов Химические уравнения. Типы химических реакций. А что такое химическая реакция?
Химические уравнения. Типы химических реакций. А что такое химическая реакция? Альдегидтер мен кетондар
Альдегидтер мен кетондар Органикалық қосылыстардың
Органикалық қосылыстардың Адсорбция на твердых телах
Адсорбция на твердых телах Фракционирование клеточных экстрактов
Фракционирование клеточных экстрактов Мир кристаллов
Мир кристаллов Комплексные соединения
Комплексные соединения Химический элемент кремний
Химический элемент кремний Химические свойства металлов
Химические свойства металлов Химия в строительстве
Химия в строительстве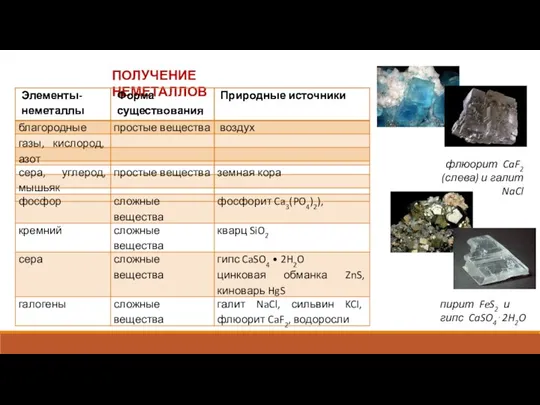 Получение неметаллов
Получение неметаллов Материаловедение. Основные задачи материаловедения
Материаловедение. Основные задачи материаловедения Периодический закон и периодическая система химических элементов Д.И. Менделеева
Периодический закон и периодическая система химических элементов Д.И. Менделеева Свойства воды
Свойства воды Диеновые углеводороды
Диеновые углеводороды Аминокислоты. Белки
Аминокислоты. Белки Конструкционные материалы
Конструкционные материалы Химическая промышленность
Химическая промышленность Строение атома. Периодический закон и периодическая система элементов
Строение атома. Периодический закон и периодическая система элементов Классификация, строение и номенклатура органически. Предмет органической химии
Классификация, строение и номенклатура органически. Предмет органической химии Химическая связь. (Лекция 3)
Химическая связь. (Лекция 3)