Содержание
- 2. План лекции Природа химической связи. Метод валентных связей. Типы химических связей. Ковалентная связь. Ее разновидности и
- 3. 1.Природа химической связи. По современным представлениям химическая связь между атомами имеет электростатическую природу. Под химической связью
- 4. Метод валентных связей. Метод валентных связей (локализованных электронных пар) предполагает, что каждая пара атомов в молекуле
- 5. Типы химических связей а) Ковалентная (полярная и неполярная): образуется между двумя атомами неметаллов за счет общих
- 6. 2. Ковалентная связь. Ее разновидности и свойства. Ковалентная химическая связь — это связь, возникающая между атомами
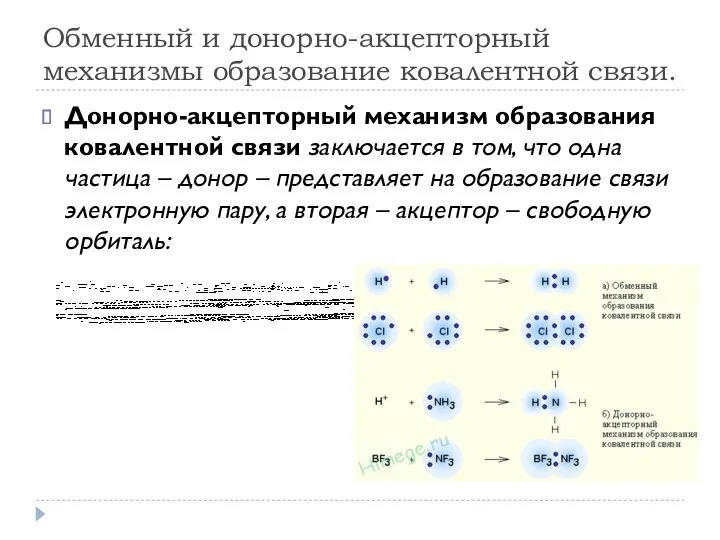
- 7. Обменный и донорно-акцепторный механизмы образование ковалентной связи. Донорно-акцепторный механизм образования ковалентной связи заключается в том, что
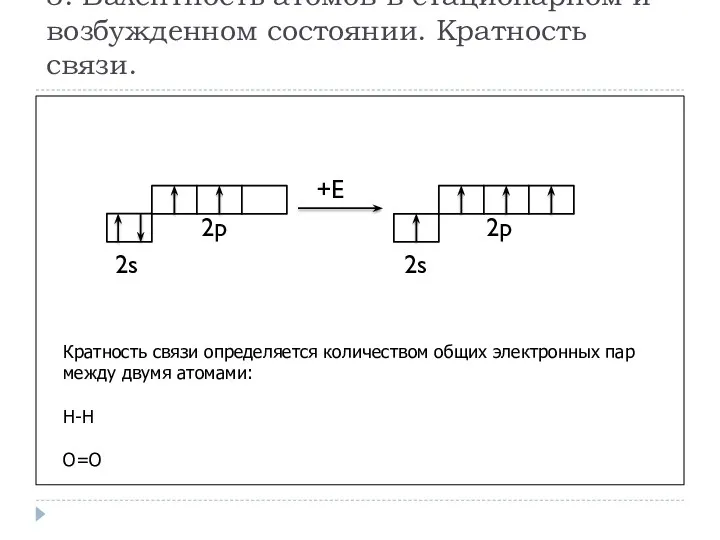
- 8. 3. Валентность атомов в стационарном и возбужденном состоянии. Кратность связи. +E 2p 2p 2s 2s Кратность
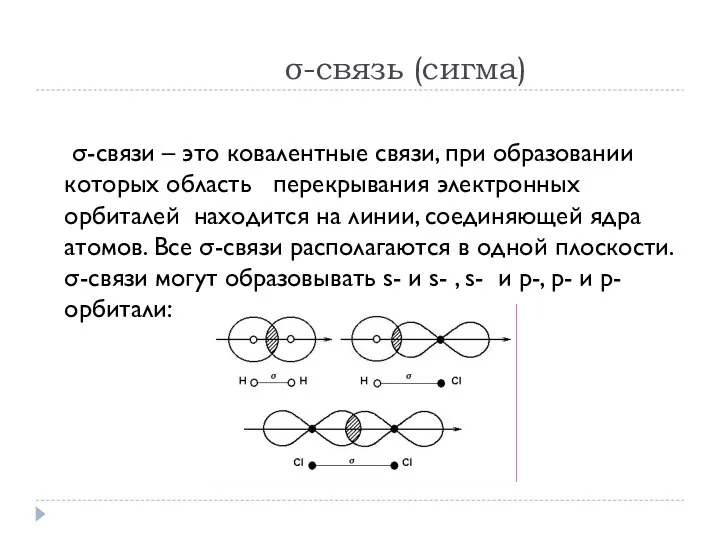
- 9. σ-связь (сигма) σ-связи – это ковалентные связи, при образовании которых область перекрывания электронных орбиталей находится на
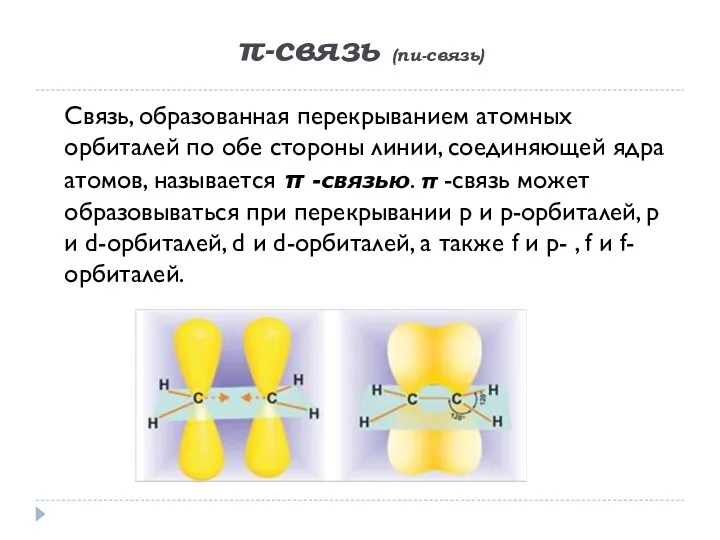
- 10. π-связь (пи-связь) Связь, образованная перекрыванием атомных орбиталей по обе стороны линии, соединяющей ядра атомов, называется π
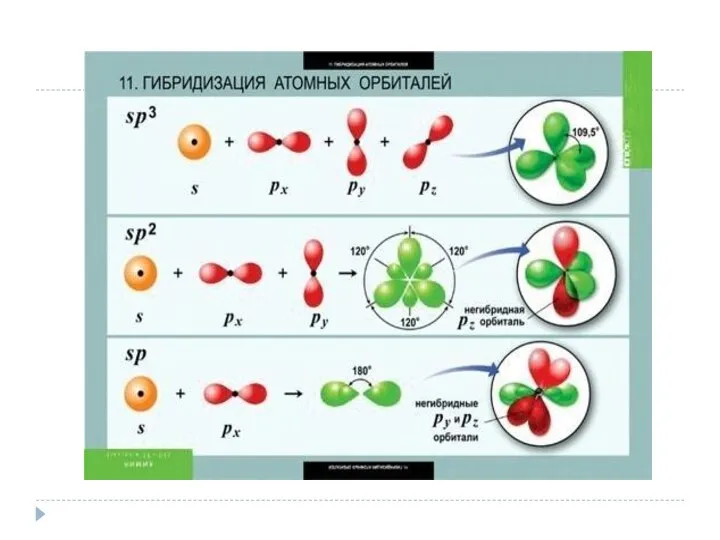
- 11. 4. Гибридизация атомных орбиталей. Примеры. Пространственная конфигурация молекул с sp, sp2, sp3 – гибридизацией. Гибридизация атомных
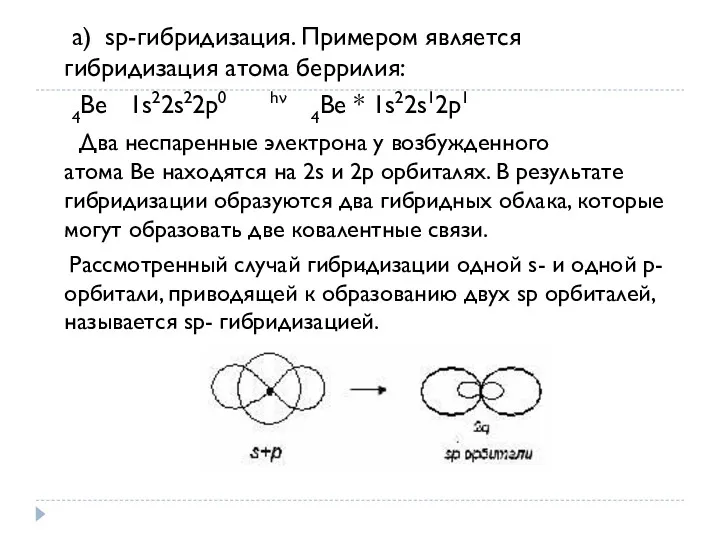
- 12. а) sp-гибридизация. Примером является гибридизация атома беррилия: 4Be 1s22s22p0 hν 4Be * 1s22s12p1 Два неспаренные электрона
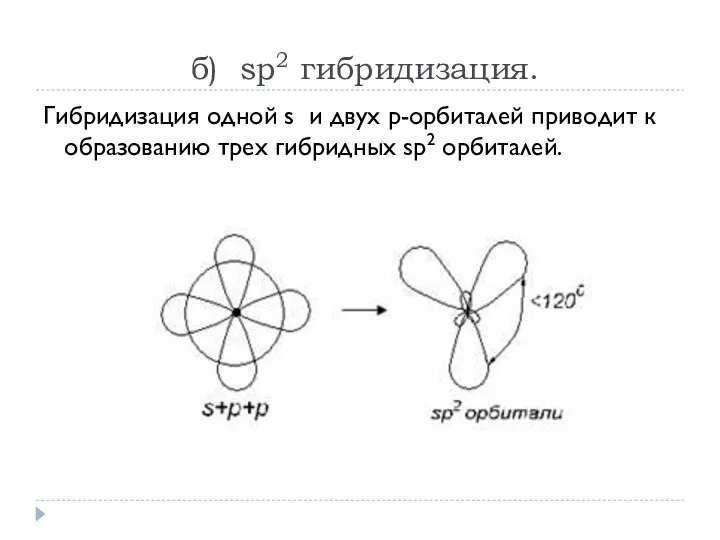
- 13. б) sp2 гибридизация. Гибридизация одной s и двух р-орбиталей приводит к образованию трех гибридных sp2 орбиталей.
- 14. Например, рассмотрим гибридизацию атома бора. Неспаренные электроны у возбужденного атома бора находятся на 2s и двух
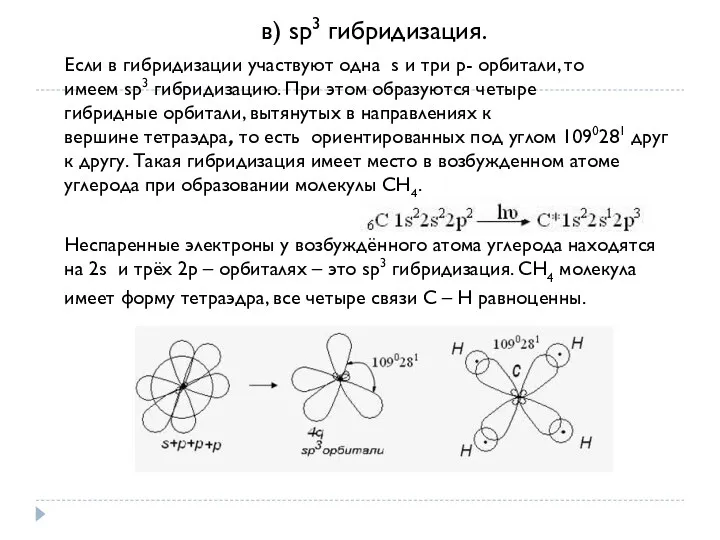
- 15. в) sp3 гибридизация. Если в гибридизации участвуют одна s и три p- орбитали, то имеем sp3
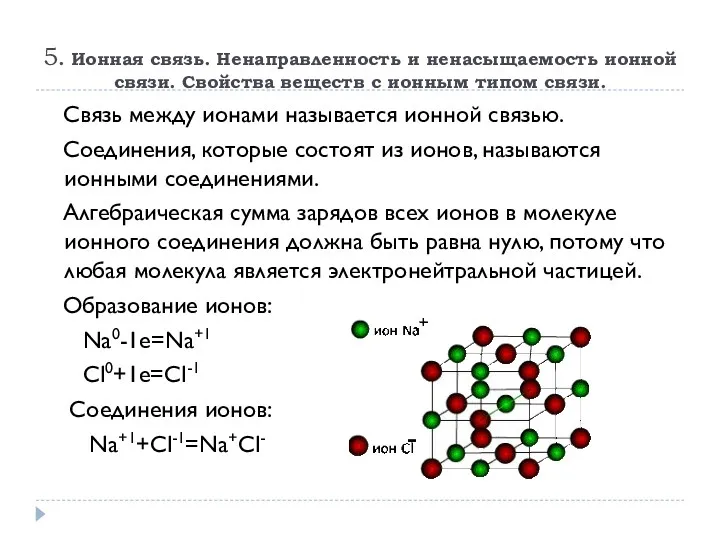
- 17. 5. Ионная связь. Ненаправленность и ненасыщаемость ионной связи. Свойства веществ с ионным типом связи. Связь между
- 18. 6. Виды межмолекулярного взаимодействия: а) ориентационное – между двумя полярными молекулами б) индукционное – между полярной
- 20. Скачать презентацию








 Оксиды
Оксиды Коррозия металлов и способы защиты от неё
Коррозия металлов и способы защиты от неё a27156dfd11d4f939d9a0cf3023d54c5
a27156dfd11d4f939d9a0cf3023d54c5 Химия p-элементов (лекция 12)
Химия p-элементов (лекция 12) Растворы ВМС и их свойства
Растворы ВМС и их свойства Переходные элементы
Переходные элементы Кремний и его соединения. Силикатная промышленность
Кремний и его соединения. Силикатная промышленность Альдегиды и кетоны. Определение
Альдегиды и кетоны. Определение Полимеры. Степень полимеризации
Полимеры. Степень полимеризации Карбоновые кислоты. Строение
Карбоновые кислоты. Строение Формы парфюмерно-косметической продукции
Формы парфюмерно-косметической продукции Химическая термодинамика
Химическая термодинамика Химическая картина мира
Химическая картина мира Основные виды химической связи
Основные виды химической связи Сорбіт C6H14O6
Сорбіт C6H14O6 Йод. Йодтың ашылуы
Йод. Йодтың ашылуы Жири як представники естерів. Класифікація жирів, їхні хімічні властивості
Жири як представники естерів. Класифікація жирів, їхні хімічні властивості Цитохромы P-450, b-5
Цитохромы P-450, b-5 Електроліти в сучасних акумуляторах
Електроліти в сучасних акумуляторах Галогены
Галогены Химическая посуда и ее назначения (5)
Химическая посуда и ее назначения (5) Көмірсутектерді пиролиздеу арқылы қарапайым олефиндерді алу
Көмірсутектерді пиролиздеу арқылы қарапайым олефиндерді алу Вода. Растворимость, растворы
Вода. Растворимость, растворы Решение комбинированных задач. Задачи на смеси
Решение комбинированных задач. Задачи на смеси Карбоновые кислоты и их функциональные производные
Карбоновые кислоты и их функциональные производные Строение атома. Лекция №2
Строение атома. Лекция №2 Соли в свете теории электролитической диссоциации
Соли в свете теории электролитической диссоциации Галогенопроизводные углеводородов 1
Галогенопроизводные углеводородов 1