Содержание
- 2. Важно: При образовании химических соединений атомы химических элементов стремятся приобрести устойчивую конфигурацию внешнего электронного слоя (из
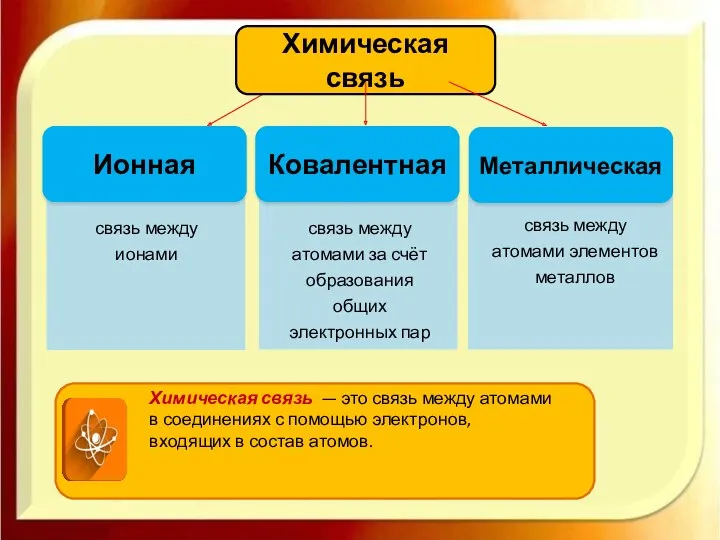
- 3. Ионная Химическая связь Ковалентная Металлическая Химическая связь — это связь между атомами в соединениях с помощью
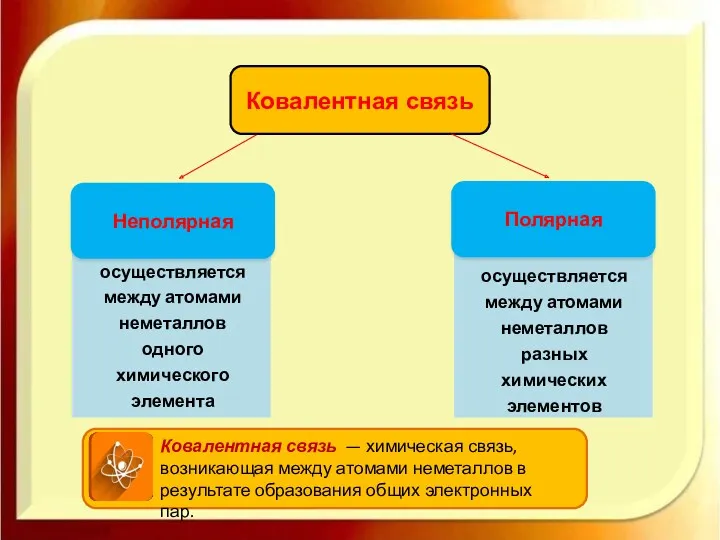
- 4. Полярная Ковалентная связь Неполярная Ковалентная связь — химическая связь, возникающая между атомами неметаллов в результате образования
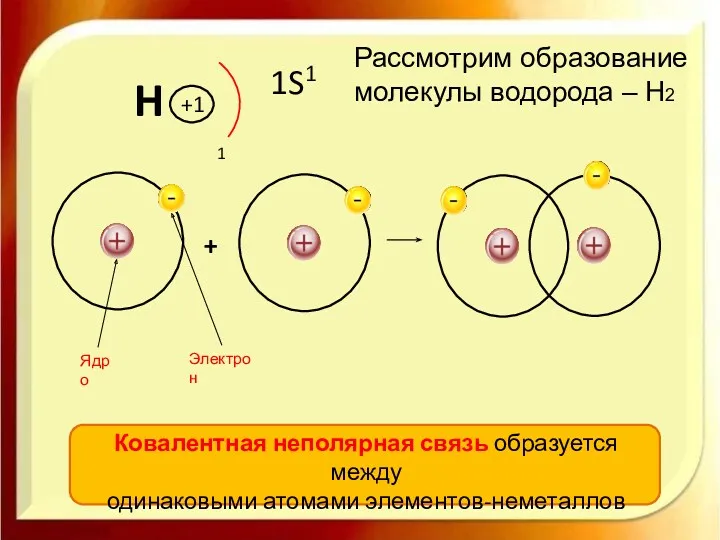
- 5. H 1S1 Рассмотрим образование молекулы водорода – Н2 Ковалентная неполярная связь образуется между одинаковыми атомами элементов-неметаллов
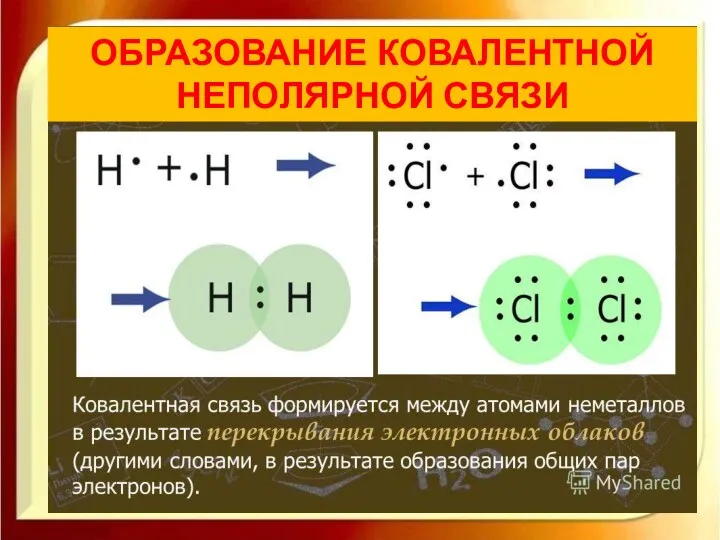
- 6. ОБРАЗОВАНИЕ КОВАЛЕНТНОЙ НЕПОЛЯРНОЙ СВЯЗИ
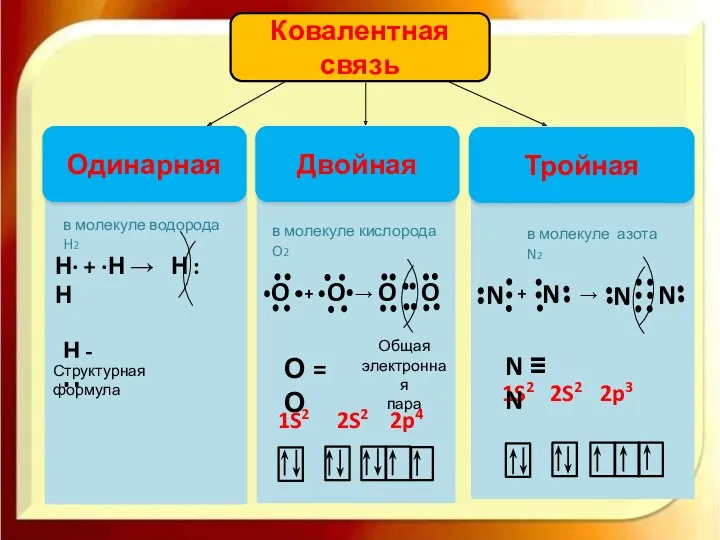
- 8. Ковалентная связь Одинарная Тройная Двойная Общая электронная пара О = О N ≡ N
- 9. Электроотрицательность — это способность атомов химического элемента смещать к себе общие электронные пары, участвующие в образовании
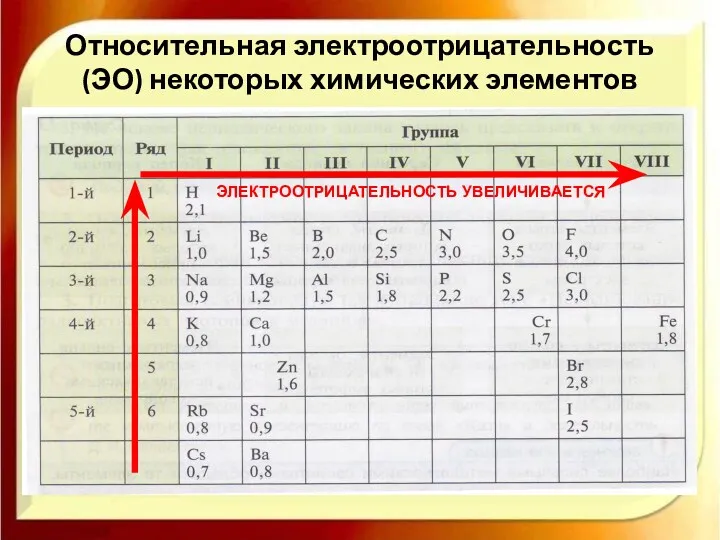
- 10. Ряд электроотрицательности (ЭО) С увеличением электроотрицательности (ЭО) увеличивается способность атома смещать общую электронную пару ближе к
- 11. Относительная электроотрицательность (ЭО) некоторых химических элементов ЭЛЕКТРООТРИЦАТЕЛЬНОСТЬ УВЕЛИЧИВАЕТСЯ
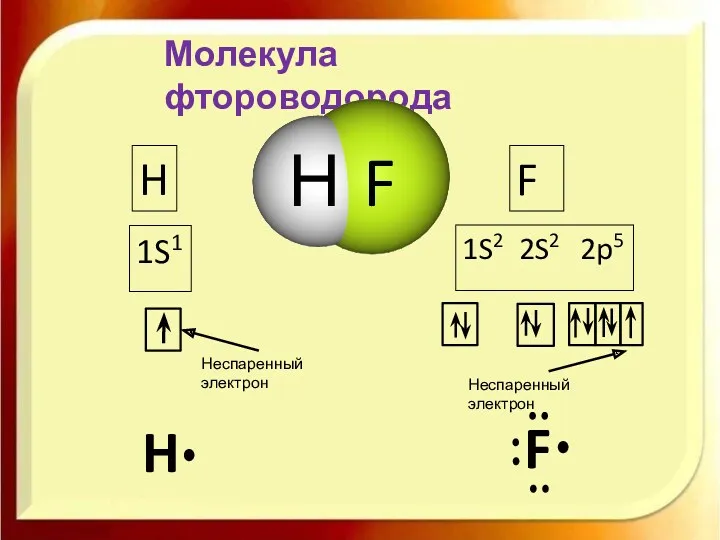
- 12. Молекула фтороводорода H 1S1 F 1S2 2S2 2p5 H F Неспаренный электрон Неспаренный электрон Н F
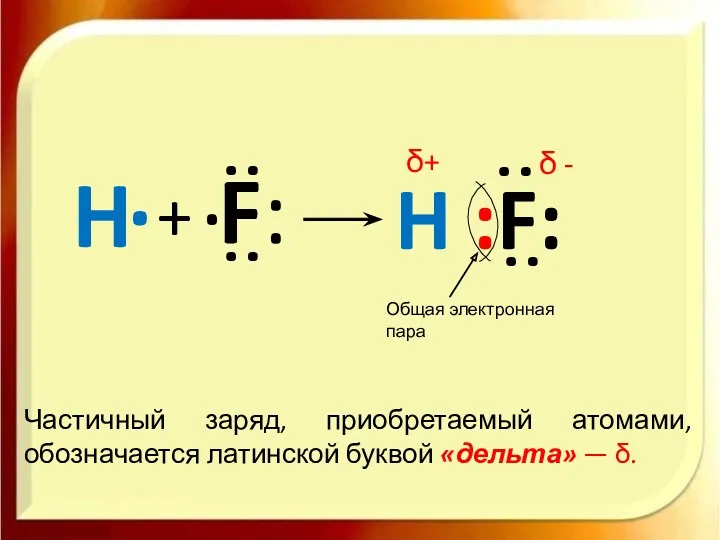
- 13. H . + F: . : : H :F: : : Общая электронная пара Частичный заряд,
- 16. Скачать презентацию





 Процессы алкилирования
Процессы алкилирования Растворы
Растворы Серная кислота
Серная кислота Главная подгруппа VIII группы периодической системы. Девятнадцатая лекция
Главная подгруппа VIII группы периодической системы. Девятнадцатая лекция Органические вещества: производные углеводородов
Органические вещества: производные углеводородов Химическая связь. (Лекция 4, 5)
Химическая связь. (Лекция 4, 5) Дисахариди. Амінокислоти. Пептиди
Дисахариди. Амінокислоти. Пептиди Валентность и степень окисления элементов
Валентность и степень окисления элементов Выращивание кристаллов
Выращивание кристаллов яжелые металлы полезны или вредны?
яжелые металлы полезны или вредны? Характеристика элементов VIII-В группы. Семейство железа
Характеристика элементов VIII-В группы. Семейство железа Необоротні і оборотні хімічні процеси. Хімічна рівновага. Принцип Ле Шательє
Необоротні і оборотні хімічні процеси. Хімічна рівновага. Принцип Ле Шательє Chemical reactions and heat. (Chapter 1)
Chemical reactions and heat. (Chapter 1) Соединения химических элементов. 8 класс
Соединения химических элементов. 8 класс Окислительно-восстановительные реакции. Лабораторная работа
Окислительно-восстановительные реакции. Лабораторная работа Гидролиз неорганических солей
Гидролиз неорганических солей Період як особлива синтаксична конструкція
Період як особлива синтаксична конструкція Натуральные, искуственные и синтетические материалы
Натуральные, искуственные и синтетические материалы Природные источники углеводородов
Природные источники углеводородов Минералы группы кварца
Минералы группы кварца Сложные углеводы. Олигосахариды и полисахариды
Сложные углеводы. Олигосахариды и полисахариды Поверхностные явления. Адсорбция. Изотерма Ленгмюра
Поверхностные явления. Адсорбция. Изотерма Ленгмюра Флокуляційне очищення питної води за допомогою катіонних та аніонних флокулянтів
Флокуляційне очищення питної води за допомогою катіонних та аніонних флокулянтів Металлы II группы главной подгруппы
Металлы II группы главной подгруппы Арены. Бензол
Арены. Бензол Игра по химии В рамках периодической таблицы
Игра по химии В рамках периодической таблицы 20230306_gidroliz
20230306_gidroliz Углекислый газ
Углекислый газ