Содержание
- 2. Состав обычной воды. Обычная вода- это раствор В этой воде растворены газы: N2, O2, CO2, Ar,
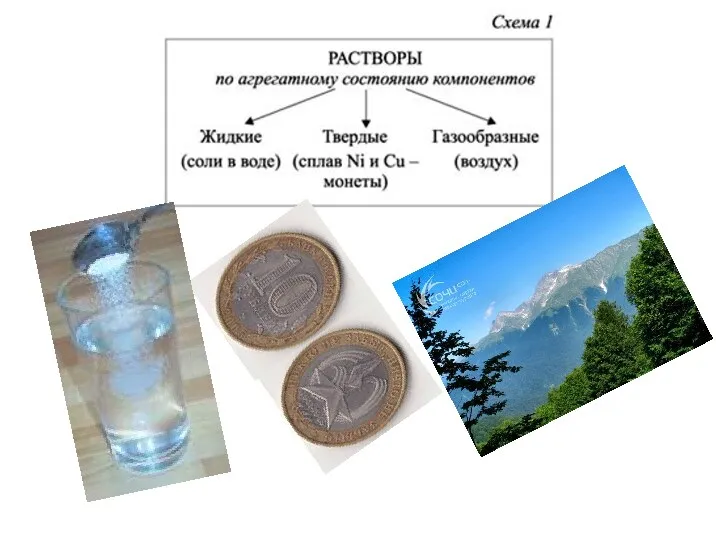
- 3. Это растворы
- 4. Растворы на нашей кухне и в домашней аптечке Уксусная кислота ( СН3СООН) Пероксид водорода (Н2О2 )
- 5. Растворы на кухне Водный раствор уксусной кислоты, полученный из вина (5-8%) называют винным уксусом. Разбавленный (6-10%)
- 6. Тема: Растворы.
- 7. «Растворы – это живая кровь, которая создаёт жизнь там, где её не было» Академик Карпинский А.П.
- 8. «В первичном океане ( во время появления жизни на Земле) массовая доля солей была низка около
- 9. Сложные физико-химические процессы, происходящие в организмах человека и животных, также протекают в растворах. Усвоение пищи связано
- 11. http://flavite.ru/Иммунитет и наше здоровье. Ольга Побудей http://flavite.ru/Иммунитет и наше здоровье. Ольга Побудей
- 12. Растворитель-это вещество растворяющее другие вещества В воде хорошо растворяются многие газы, жидкие и твёрдые вещества Вода-
- 13. Возьмите себе за правило пить только хорошую воду нe менее двух литров в дeнь и по
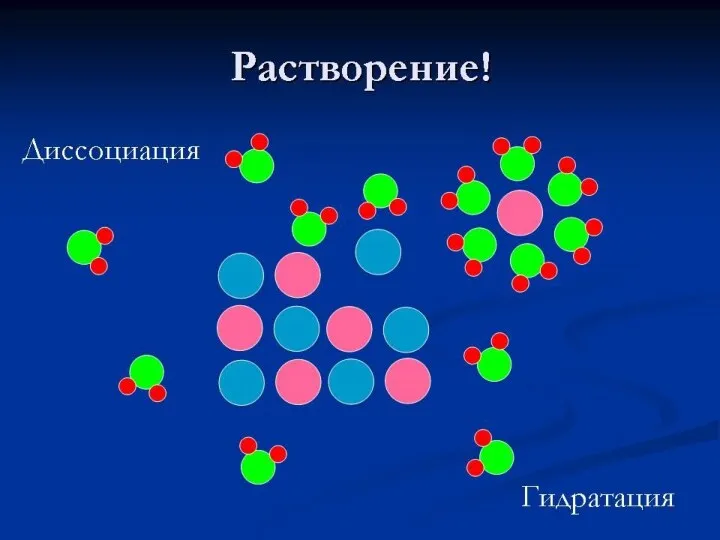
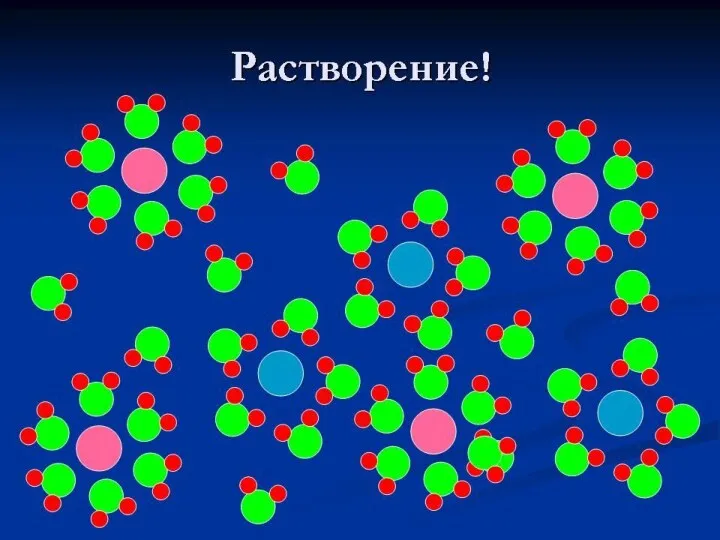
- 14. Раствор – однородная система, состоящая из частиц растворителя, растворённого вещества, продуктов их взаимодействия. Как происходит процесс
- 15. Процесс растворения сочетает в себе: физический процесс(дробление до молекул) и химическое взаимодействие компонентов Сторонники физической теории
- 16. Физико-химическая теория растворов Ивана Алексеевич Каблуков – сторонник физико-химической теории растворов
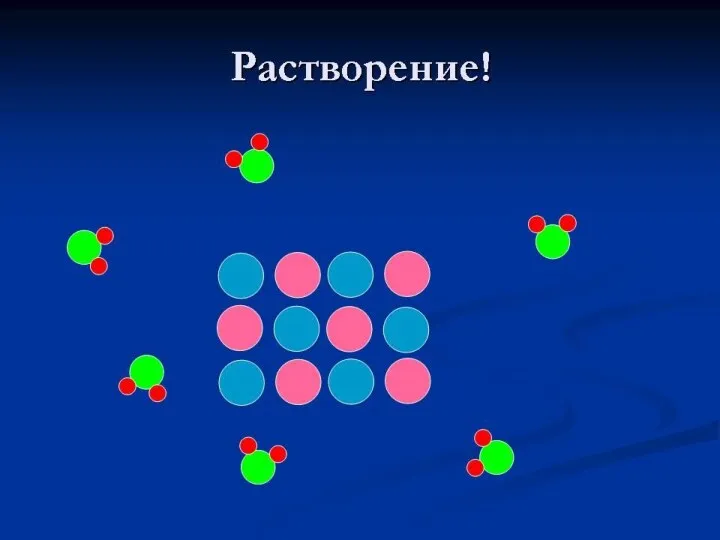
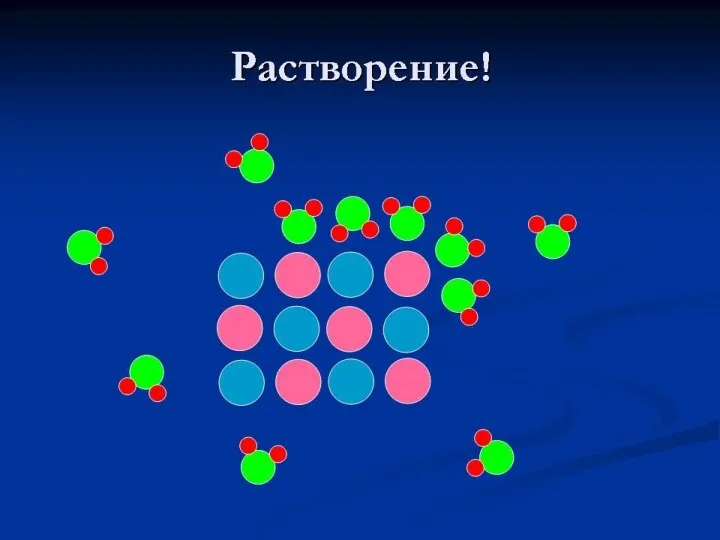
- 21. Растворение веществ можно сравнить с перетаскиванием мебели.
- 22. Молекулы сахара (белые кружочки), находящиеся на поверхности кристалла сахара, окружены молекулами воды (темные кружочки). Между молекулами
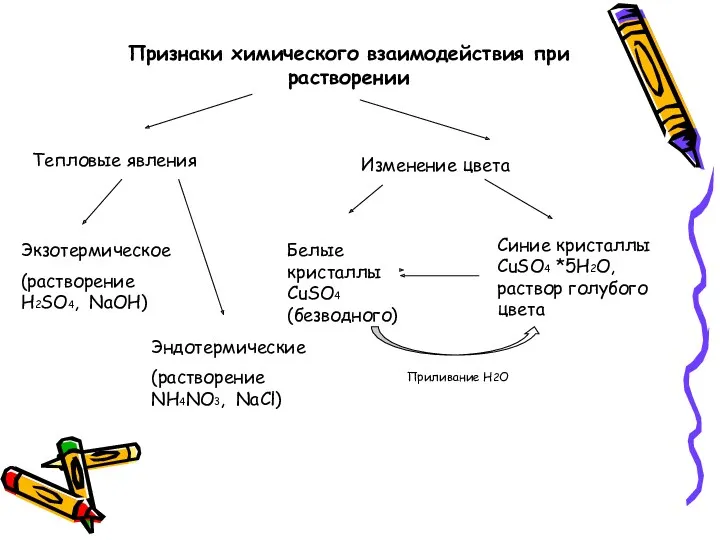
- 23. Признаки химического взаимодействия при растворении Тепловые явления Экзотермическое (растворение Н2SО4, NaOH) Эндотермические (растворение NH4NO3, NaCl) Изменение
- 24. Растворимость – способность веществ растворяться в каком-либо растворителе. Растворимость показывает сколько грамм вещества способно раствориться в
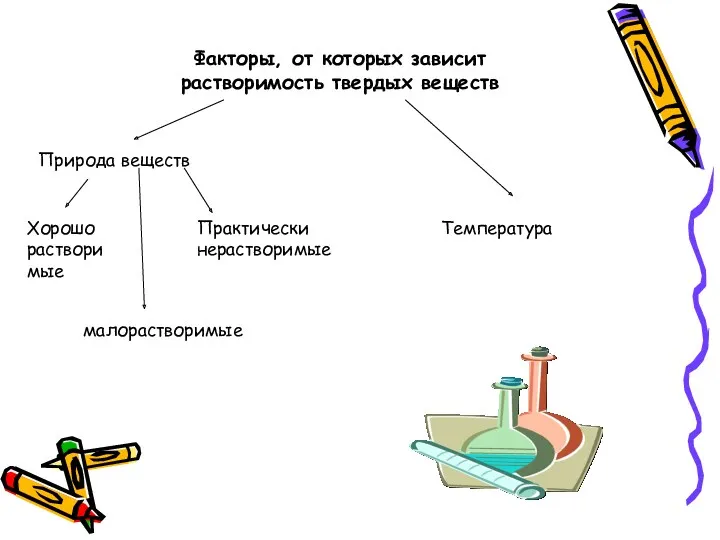
- 25. Факторы, от которых зависит растворимость твердых веществ Природа веществ Хорошо растворимые малорастворимые Практически нерастворимые Температура
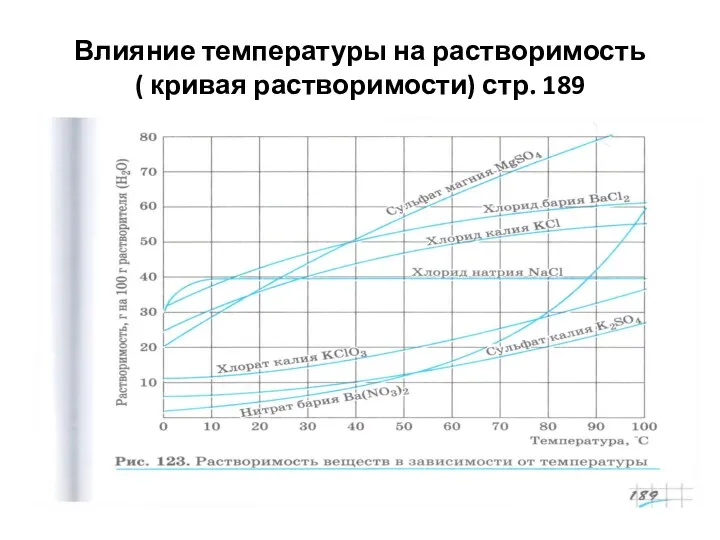
- 26. Влияние температуры на растворимость ( кривая растворимости) стр. 189
- 27. Решение задач с применением понятия растворимость Пользуясь кривой растворимости определите массовую долю хлорида калия , содержащегося
- 28. Влияние давления на растворимость Давление не оказывает заметного влияния на растворимость твердых веществ, потому что при
- 29. А можете ли вы сказать о растворимости СаSO4? Как же быть? Для того чтобы определить растворимость
- 30. Обозначения в таблице растворимости Н – нерастворимые вещества (меньше 0,01 г в 100 г воды), М
- 31. Задание делаем все вместе Задание. Определить растворимость следующих веществ по таблице растворимости AgNO3------------Р Fe(OH)2----------Н MgCO3----------Н
- 35. Используй формулы ω%= m(в-ва)= m (р-ра) • ω m(р-ра)= m(в-ва)/ω m(раствора)=m(р-ля)+m(в-ва) m(р-ля)=m(раствора)- m(в-ва)
- 37. Классификация растворов
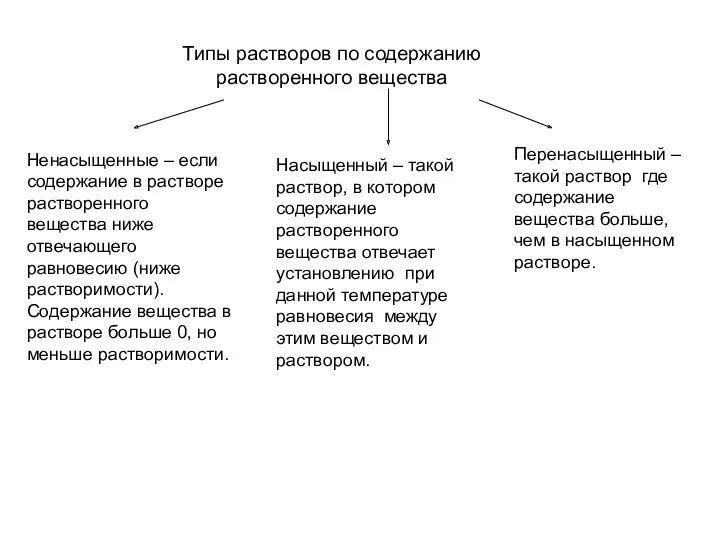
- 38. Типы растворов по содержанию растворенного вещества Ненасыщенные – если содержание в растворе растворенного вещества ниже отвечающего
- 41. Проверка заданий
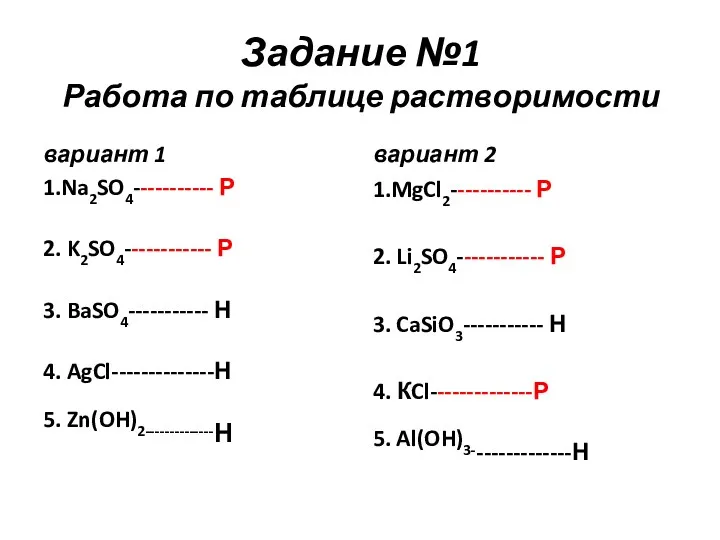
- 42. Задание №1 Работа по таблице растворимости вариант 1 1.Na2SO4- 2. K2SO4- 3. BaSO4- 4. AgCl- 5.
- 43. Задание №1 Работа по таблице растворимости вариант 1 1.Na2SO4----------- Р 2. K2SO4------------ Р 3. BaSO4----------- Н
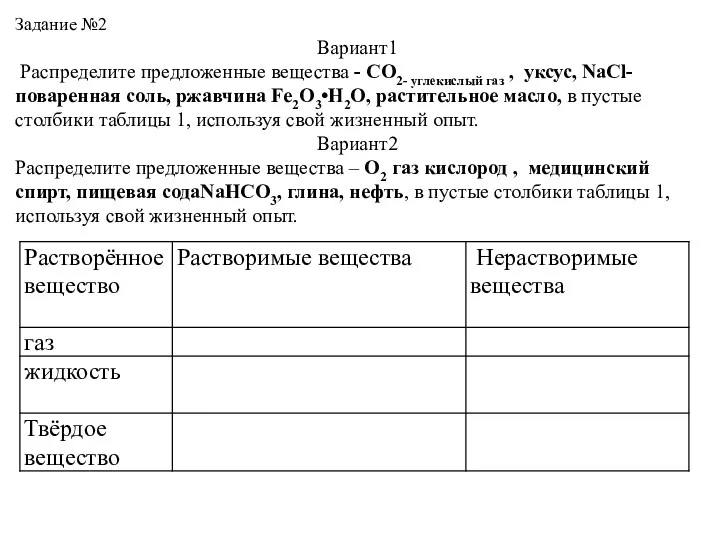
- 44. Задание №2 Вариант1 Распределите предложенные вещества - СO2- углекислый газ , уксус, NaCl- поваренная соль, ржавчина
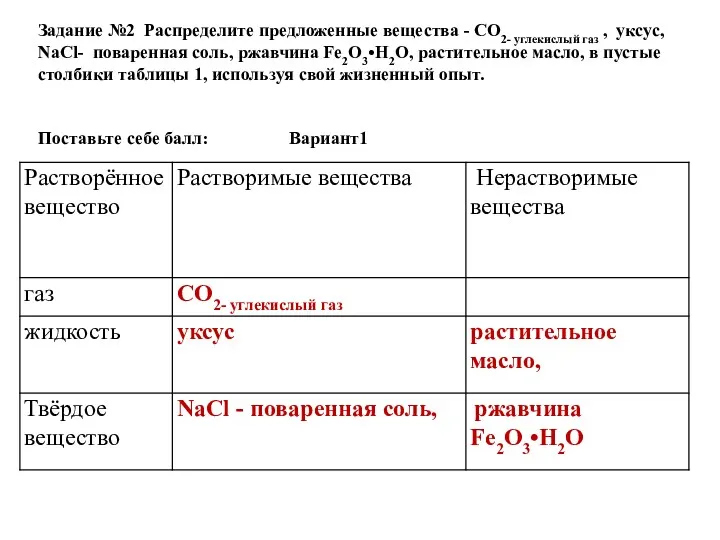
- 45. Задание №2 Распределите предложенные вещества - СO2- углекислый газ , уксус, NaCl- поваренная соль, ржавчина Fe2O3•H2О,
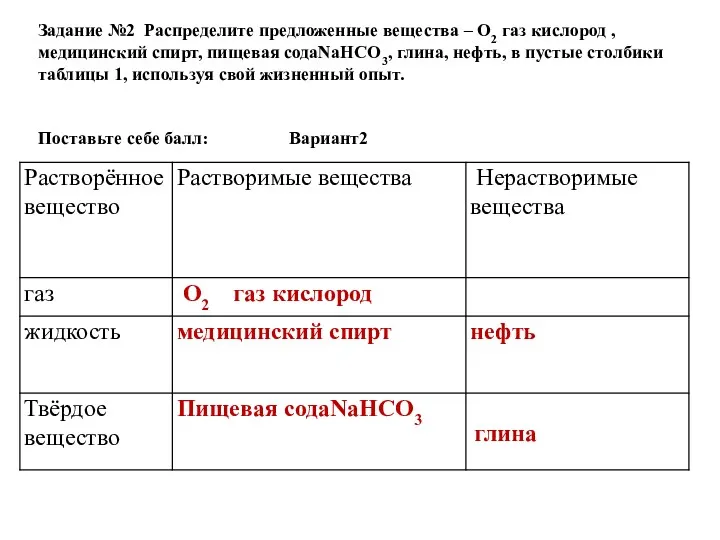
- 46. Задание №2 Распределите предложенные вещества – О2 газ кислород , медицинский спирт, пищевая содаNaHCO3, глина, нефть,
- 47. Урок понравился и тема понята: Урок понравился, но не всё ещё понятно: Урок не понравился и
- 49. Скачать презентацию

































 Фенолы
Фенолы Алюминий и бор
Алюминий и бор Одноатомные спирты
Одноатомные спирты Спирты
Спирты Пластмаси та їх роль у сучасному виробництві
Пластмаси та їх роль у сучасному виробництві Аргентум, или серебро
Аргентум, или серебро Генетическая связь между классами неорганических соединений
Генетическая связь между классами неорганических соединений Каменный уголь. Фенол
Каменный уголь. Фенол Органическая химия. Олигосахариды. Полисахариды
Органическая химия. Олигосахариды. Полисахариды 10 самых смертельно опасных камней и минералов
10 самых смертельно опасных камней и минералов Термодинамика химического равновесия
Термодинамика химического равновесия Зерттеу әдістері
Зерттеу әдістері Кремний и его соединения. Аллотропные модификации
Кремний и его соединения. Аллотропные модификации Химические понятия
Химические понятия Спирти
Спирти Необратимые электродные процессы. Часть 2
Необратимые электродные процессы. Часть 2 Химические свойства кислот как электролитов
Химические свойства кислот как электролитов Предмет органической химии. Органические вещества
Предмет органической химии. Органические вещества Алмаз. Алмаз дегеніміз не
Алмаз. Алмаз дегеніміз не Простые вещества - неметаллы
Простые вещества - неметаллы Обмен простых белков. Дезаминирование и трансаминирование аминокислот
Обмен простых белков. Дезаминирование и трансаминирование аминокислот Растворы. Массовая доля растворённого вещества
Растворы. Массовая доля растворённого вещества Валентность химических элементов. 8 класс
Валентность химических элементов. 8 класс В мире химии. Периодический закон и ПСХЭ
В мире химии. Периодический закон и ПСХЭ Закон Авогадро. Молярный объём газов
Закон Авогадро. Молярный объём газов Защита от коррозии каменных и бетонных строительных материалов и конструкций
Защита от коррозии каменных и бетонных строительных материалов и конструкций Физико-химические свойства алкенов
Физико-химические свойства алкенов Химическая промышленность. Минеральные удобрения
Химическая промышленность. Минеральные удобрения