Содержание
- 2. Введение Самопроизвольный процесс: dG Свободная энергия системы уменьшается. Идет до состояния равновесия. Равновесие - минимум свободной
- 3. *Химическое равновесие. Термодинамические условия химического равновесия. Константа химического равновесия и способы ее выражения. Хим. равновесие: одновременно
- 4. !!!! Т/д условие равновесия ∆G = 0 По ур. Гиббса-Дюгема Химический потенциал компонента (газ) в состоянии
- 5. Для всех участников реакции при равновесии
- 6. термодинамическая константа равновесия, выраженная через давление. изменение стандартного изобарно-изотермического потенциала. Стандартные хим. потенциалы Равновесные парциальные давления
- 7. ΔGr0298 =∑vΔGf0298 прод -∑vΔGf0298 исх. ΔGr0 - функция состояния При 298 К можно вычислить из таблиц.
- 8. способ вычисления т/д константы равновесия (газы) аналогично для реакций в растворах константа выражена через С
- 9. Пример Н2(г) + Сl2(г) ⮀ 2 HCl (г) при 298 К ∆G0r = – 190,6 кДж/моль.
- 10. Используя КP (или КС) можно рассчитать сколько вещества вступит в реакцию (образуется) к моменту равновесия Степень
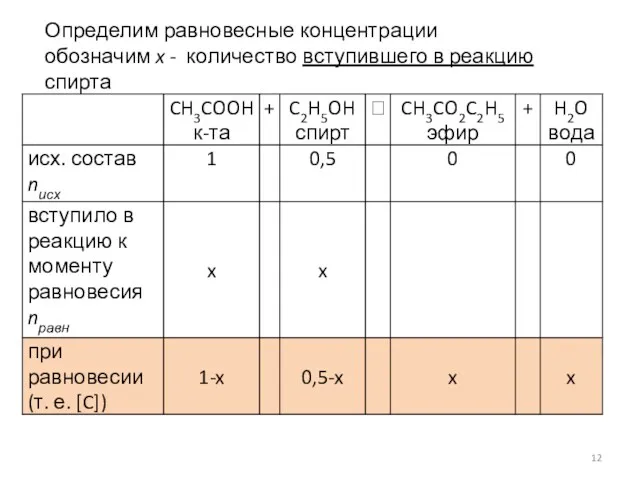
- 11. Пример Определим теор. выход и глубину протекания реакции в растворе, если к 1 моль уксусной кислоты
- 12. Определим равновесные концентрации обозначим x - количество вступившего в реакцию спирта
- 13. (0,5 – x – 0,5x + x2) 3,05 = x2 2,05x 2– 4,575x + 1,525 =
- 14. Константа равновесия гомогенной реакции если все участники реакции – газы 3H2(г) + N2 (г) 2 NH3(г)
- 15. FeO(тв) + CO(г) ⮀ Fe(тв) + CO2(г) NH4Cl(тв) ⮀ NH3(г) + HCl(г) Константа равновесия гетерогенной реакции
- 16. *Способы выражения константы химического равновесия через молярные концентрации С [моль/л] через давление через мольные доли X
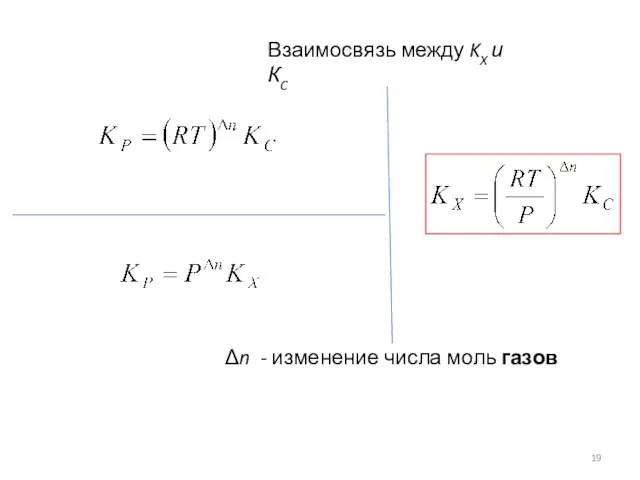
- 17. Взаимосвязь между KP и KC связь P и С (для каждого газа) в нашем случае –
- 18. Взаимосвязь между KP и КХ Мольная доля компонента Хi – отношение числа моль этого компонента к
- 19. Взаимосвязь между KX и КC Δn - изменение числа моль газов
- 20. Примеры 3H2(г) + N2 (г) ⮀ 2NH3(г) Δn = - 2 NH4Cl(тв) ⮀ NH3(г) + HCl(г)
- 21. *Уравнение изотермы химической реакции Прогнозирование направления протекания химической реакции по величине ΔGr . Если система не
- 22. Уравнение изотермы реакции позволяет вычислять ΔGr на любом этапе реакции не только в стандартных условиях, но
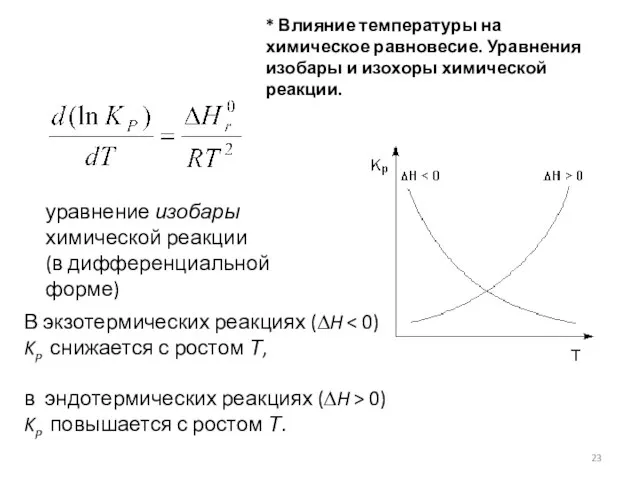
- 23. * Влияние температуры на химическое равновесие. Уравнения изобары и изохоры химической реакции. уравнение изобары химической реакции
- 24. При Т1 - константа KP1 , при Т2 - константа KP2 Уравнение изобары в интегральной форме
- 25. Уравнение изохоры химической реакции
- 26. Способ вычисления КP при другой T Н2 + Сl2 ⮀ 2HCl КP = 2,67∙ 1033 при
- 27. *Принцип Ле-Шателье – Брауна, прогнозирование смещения химического равновесия Принцип Ле Шателье – Брауна: Если на систему,
- 28. при равновесии ∆Gr = 0 1) В систему добавлено исходное вещество (А) ∆Gr равновесие смещается вправо
- 29. 3) Изменено общее давление (для реакций с участием газов) смещения равновесия определятся Δn газов. Если Δn
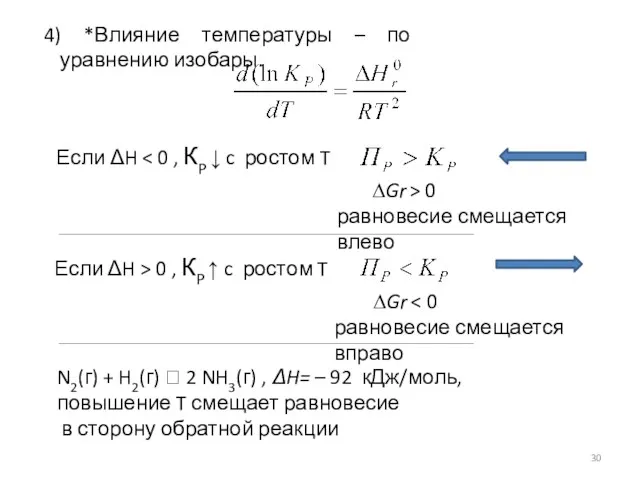
- 30. 4) *Влияние температуры – по уравнению изобары. Если ΔH Если ΔH > 0 , КP ↑
- 32. Скачать презентацию













![*Способы выражения константы химического равновесия через молярные концентрации С [моль/л]](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/419159/slide-15.jpg)











 Виды присадок к моторным топливам (керосин)
Виды присадок к моторным топливам (керосин) Химическая связь. Валентность элементов в ковалентных соединениях. Степень окисления элементов
Химическая связь. Валентность элементов в ковалентных соединениях. Степень окисления элементов Алкины. Самостоятельная работа
Алкины. Самостоятельная работа Положение металлов в Периодической системе Д.И. Менделеева. Особенности строения атомов, свойства
Положение металлов в Периодической системе Д.И. Менделеева. Особенности строения атомов, свойства Формирование ключевых компетенций на уроках химии
Формирование ключевых компетенций на уроках химии Угольная кислота и ее соли. 9 класс
Угольная кислота и ее соли. 9 класс Хроматографические методы анализа
Хроматографические методы анализа Нанохимия
Нанохимия Химические аспекты выбора полимеров-предшественников для получения углеродных волокон
Химические аспекты выбора полимеров-предшественников для получения углеродных волокон Природные источники углеводородов и их переработка
Природные источники углеводородов и их переработка Группа галогенов в периодической системе
Группа галогенов в периодической системе Химические свойства кислот
Химические свойства кислот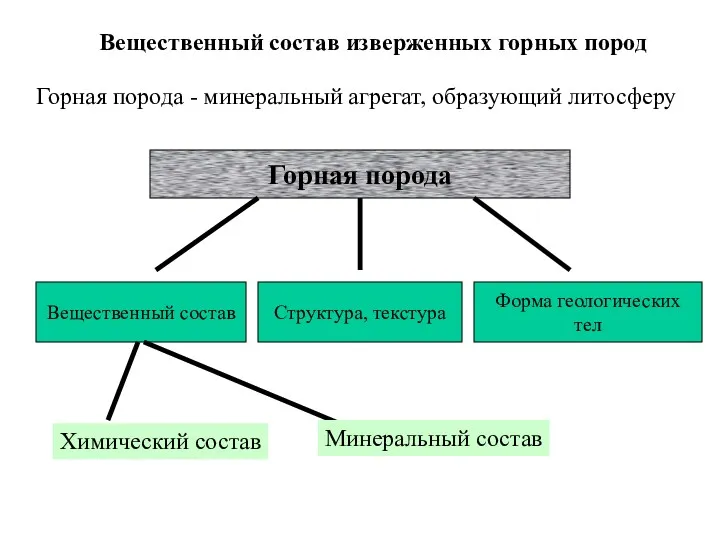 Вещественный состав изверженных горных пород
Вещественный состав изверженных горных пород Химиялық тепе-теңдік және оның ығысуына әсер етуші жағдайлар. Ле Шателье-Браун принциптері
Химиялық тепе-теңдік және оның ығысуына әсер етуші жағдайлар. Ле Шателье-Браун принциптері Химические свойства металлов
Химические свойства металлов Особенности сжигания твердого, жидкого и газообразного топлива
Особенности сжигания твердого, жидкого и газообразного топлива Фотоэлектрические и информационные свойства фоточувствительных карбазолилсодержащих олигомерных пленочных композитов
Фотоэлектрические и информационные свойства фоточувствительных карбазолилсодержащих олигомерных пленочных композитов Периодический закон и строение атома
Периодический закон и строение атома Периодическая система химических элементов Д.И. Менделеева
Периодическая система химических элементов Д.И. Менделеева Метаморфогенные месторождения
Метаморфогенные месторождения Кислород. Открытие кислорода
Кислород. Открытие кислорода Розв’язування задач за рівняннями реакцій з використанням розчинів із певною масовою часткою розчиненої речовини. Урок 13-14
Розв’язування задач за рівняннями реакцій з використанням розчинів із певною масовою часткою розчиненої речовини. Урок 13-14 Склад і основні фізико-хімічні властивості молочного білку
Склад і основні фізико-хімічні властивості молочного білку Електролітична дисоціація. Електроліти та неелектроліти. Урок хімії в 9 класі
Електролітична дисоціація. Електроліти та неелектроліти. Урок хімії в 9 класі Органическая химия. Этапы развития органической химии
Органическая химия. Этапы развития органической химии Кристалдардың ішкі құрылымы
Кристалдардың ішкі құрылымы Химияның негізгі стехиометриялық заңдары
Химияның негізгі стехиометриялық заңдары Первоначальные сведения о строении вещества
Первоначальные сведения о строении вещества