Содержание
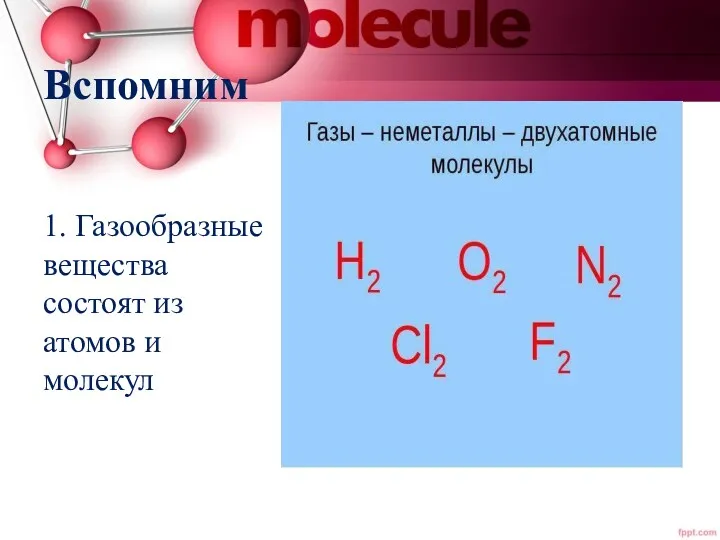
- 2. Вспомним 1. Газообразные вещества состоят из атомов и молекул
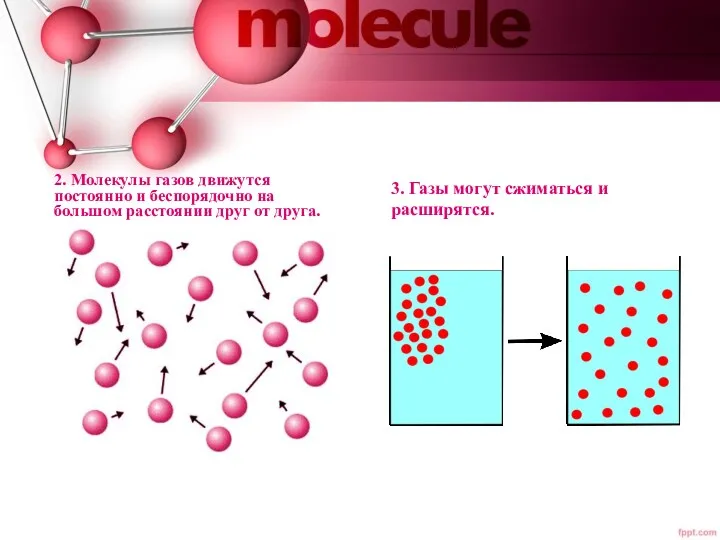
- 3. 2. Молекулы газов движутся постоянно и беспорядочно на большом расстоянии друг от друга. 3. Газы могут
- 4. 4. В газообразном состоянии вещества не имеют форму. Они приобретают форму сосуда, в котором находятся. 1
- 5. Газы подчиняются определённым законам Исходя из данных полученных в результате экспериментов и на основе законов Бойля
- 6. На основе этих законов и своих наблюдений Амедео Авогадро в 1811 г. высказал гипотезу, которая впоследствии
- 7. Следствие закона Авогадро Определенное число молекул будет всегда занимать строго определенный объём при одинаковых давлении и
- 9. Скачать презентацию




 Неметаллы. Обобщающий урок. 9 класс
Неметаллы. Обобщающий урок. 9 класс Технологическая установка Л 24-6
Технологическая установка Л 24-6 Гидрокарбонат натрия NaHCO₃
Гидрокарбонат натрия NaHCO₃ Простые вещества - металлы и неметаллы
Простые вещества - металлы и неметаллы Строение алкинов
Строение алкинов Природные каменные материалы. (Лекция 3)
Природные каменные материалы. (Лекция 3) Некоторые d-элементы
Некоторые d-элементы Поверхностные явления
Поверхностные явления Металдар. металдардың периодтық жүйедегі орны. Металдардың құрылысы
Металдар. металдардың периодтық жүйедегі орны. Металдардың құрылысы Реактивтермен жұмыс істеу техникасы және тұздар, қышқылдар, ерітінділер
Реактивтермен жұмыс істеу техникасы және тұздар, қышқылдар, ерітінділер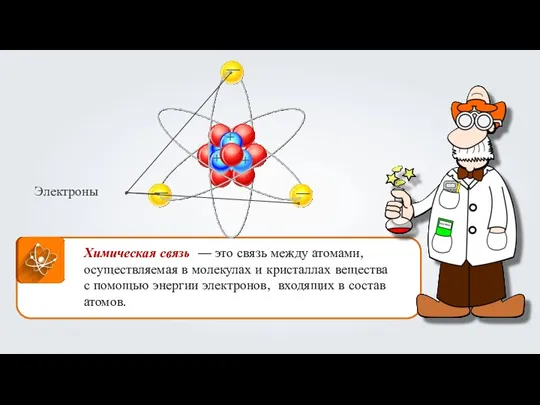 Химическая связь
Химическая связь Валентность химического элемента. Определение валентности по химической формуле
Валентность химического элемента. Определение валентности по химической формуле Классификация химических реакций
Классификация химических реакций Цитрусты жемістерді жерорта теңізінің жеміс шыбынынан, тұқымдық және азық-түліктік картопты картоп күйесіне қарсы бромды
Цитрусты жемістерді жерорта теңізінің жеміс шыбынынан, тұқымдық және азық-түліктік картопты картоп күйесіне қарсы бромды Изменение агрегатного состояния вещества. Двигатели внутреннего сгорания
Изменение агрегатного состояния вещества. Двигатели внутреннего сгорания Уран – периодты жүйедегі атомдық номері 92 болатын химиялық элемент
Уран – периодты жүйедегі атомдық номері 92 болатын химиялық элемент Классы неорганических веществ
Классы неорганических веществ Шкала рН. Лекция 03-1
Шкала рН. Лекция 03-1 Исследование модифицирования на структуру и жидкотекучесть сплава АК12
Исследование модифицирования на структуру и жидкотекучесть сплава АК12 Алкены. Ненасыщенные углеводороды, непредельные углеводороды, этиленовые углеводороды. Олефины (10 класс)
Алкены. Ненасыщенные углеводороды, непредельные углеводороды, этиленовые углеводороды. Олефины (10 класс) Химические свойства полимеров
Химические свойства полимеров Химия и повседневная жизнь человека
Химия и повседневная жизнь человека Обмен липидов
Обмен липидов Природные источники углеводородов
Природные источники углеводородов Тренинг. Практическая химия (8-9 классы)
Тренинг. Практическая химия (8-9 классы) Типы химических реакций
Типы химических реакций Галогены. Нахождение в природе
Галогены. Нахождение в природе 20230419_alkiny_uglub
20230419_alkiny_uglub