Содержание
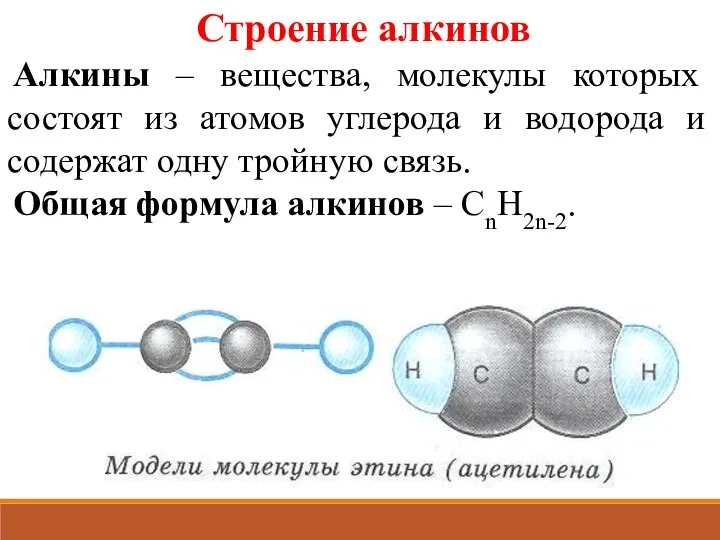
- 2. Строение алкинов Алкины – вещества, молекулы которых состоят из атомов углерода и водорода и содержат одну
- 3. Алкины – непредельные углеводороды, в молекулах которых имеется одна тройная связь. CnH2n –2 n = 2
- 4. Изомерия алкинов C5H8 СН ≡С−СН2−СН2−СН3 СН3− С≡С−СН2−СН3 СН ≡С−СН−СН3 ⏐ СН3 пентин-1 пентин-2 3- метилбутин-1 Структурная
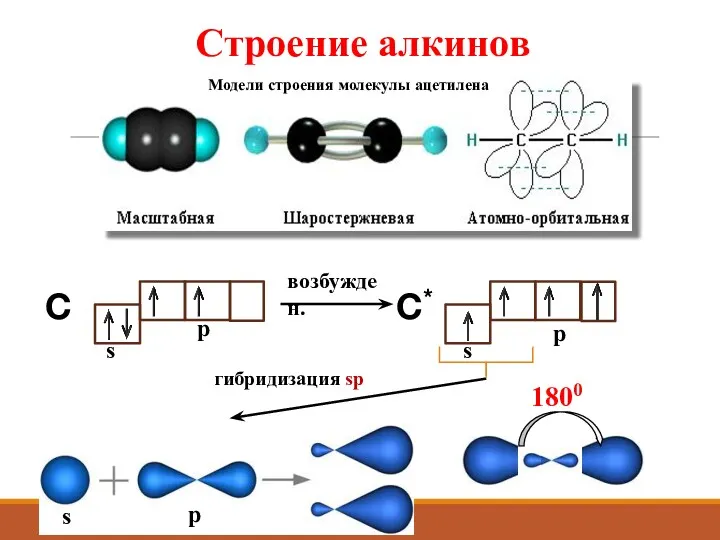
- 5. Строение алкинов H-C ≡ C-H Вид связи Н-С – ковалентная полярная Вид связи С ≡ С
- 6. Строение алкинов возбужден. C C* s p гибридизация sp 1800
- 7. Строение алкинов Вид гибридизации – sp Валентный угол – 1800 Длина связи С ≡ С 0,12
- 8. При обычных условиях: от С2Н2 до С4Н6 – газы с С5Н8 – жидкости с С16Н30 –
- 9. Физические свойства Температуры кипения и плавления алкинов закономерно повышаются при увеличении молекулярной массы соединений.
- 10. Получение алкинов 1.Термический крекинг метана: 2.Карбидный способ: 3.Способ дегидрогалогенирования: H3C–CН – СH2 Cl Cl H-C ≡
- 11. «Закончи фразу»: Алкины – это непредельные углеводороды… Общая формула алкинов… Изомерия алкинов начинается с.. Молекула ацетилена
- 13. 1) СH CH+2H2 CH3 – CH3 2) СH CH + 2Br2 CHBr2– CHBr2 O 3) СH
- 14. Реакция полимеризации 1. Димеризация под действием водного раствора CuCl и NH4Cl: НC≡CH + НC≡CH ⎯→ Н2C=CH−C≡CH
- 15. Реакции замещения При взаимодействии ацетилена (или R−C≡C−H) с аммиачными растворами оксида серебра выпадают осадки нерастворимых ацетиленидов:
- 17. Горение ацетилена При сгорании (полном окислении) ацетилена выделяется большое количества тепла: HC≡CH + 2О2 ⎯→ 2СО2
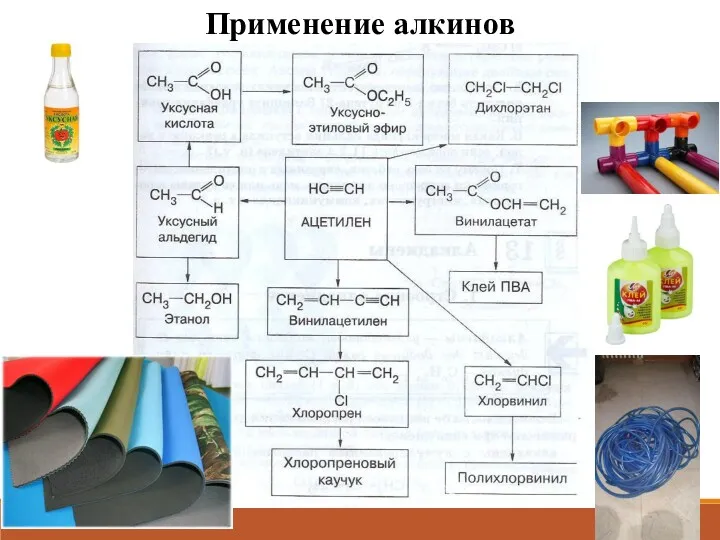
- 18. Применение алкинов
- 19. Контрольные вопросы 1.Вставьте в текст соответствующие слова и символы из скобок. Алкинами называются…(ациклические, циклические) углеводороды, содержащие
- 20. 2. Укажите формулу алкина: а) C3H4, б) C4H8, в) C5H12, г) C6H6 . 3. Как называется
- 21. 5. Для пентина-2 выберите формулы: 1) гомологов; 2) изомеров. а) CH3 – C C – CH3
- 23. Скачать презентацию

















 Химические свойства солей
Химические свойства солей Кислородные соединения серы
Кислородные соединения серы Классификация химических реакций по тепловому эффекту
Классификация химических реакций по тепловому эффекту Химическая технология ситаллов и композитов
Химическая технология ситаллов и композитов Общие сведения об электрорадиоматериалах
Общие сведения об электрорадиоматериалах Химические элементы в организме человека
Химические элементы в организме человека Химические формулы
Химические формулы Подготовка к ГИА. А9. Химические свойства простых веществ: металлов и неметаллов
Подготовка к ГИА. А9. Химические свойства простых веществ: металлов и неметаллов Предмет органической химии
Предмет органической химии Типы химических реакций
Типы химических реакций Аминокислоты. Пептиды. Белки
Аминокислоты. Пептиды. Белки Реакции ионного обмена между растворами электролитов
Реакции ионного обмена между растворами электролитов Положение тугоплавких металлов в Периодической системе элементов
Положение тугоплавких металлов в Периодической системе элементов Основні технологічні процеси очистки води. Знезараження води. Знезараження води хлором
Основні технологічні процеси очистки води. Знезараження води. Знезараження води хлором Спектральные методы: инфракрасная спектроскопия. Люминесцентный анализ
Спектральные методы: инфракрасная спектроскопия. Люминесцентный анализ Физические и химические явления
Физические и химические явления Строение атома. Периодический закон и периодическая система элементов
Строение атома. Периодический закон и периодическая система элементов Аммиак. Строение молекулы аммиака, его физические и химические свойства
Аммиак. Строение молекулы аммиака, его физические и химические свойства Углекислый газ
Углекислый газ Коллигативные свойства растворов неэлектролитов
Коллигативные свойства растворов неэлектролитов Биоорганическая химия
Биоорганическая химия Валентность и степень окисления. Химическая связь
Валентность и степень окисления. Химическая связь Железо, его характеристики, свойства и соединения
Железо, его характеристики, свойства и соединения Радиохимия
Радиохимия Кислород и его применение
Кислород и его применение Строение атома. Химическая связь
Строение атома. Химическая связь Основные синтетические полимеры
Основные синтетические полимеры Строение атома
Строение атома