Содержание
- 2. Основные функции воды в организме Обеспечение процессов всасывания и механического передвижения питательных веществ Поддержание оптимального осмотического
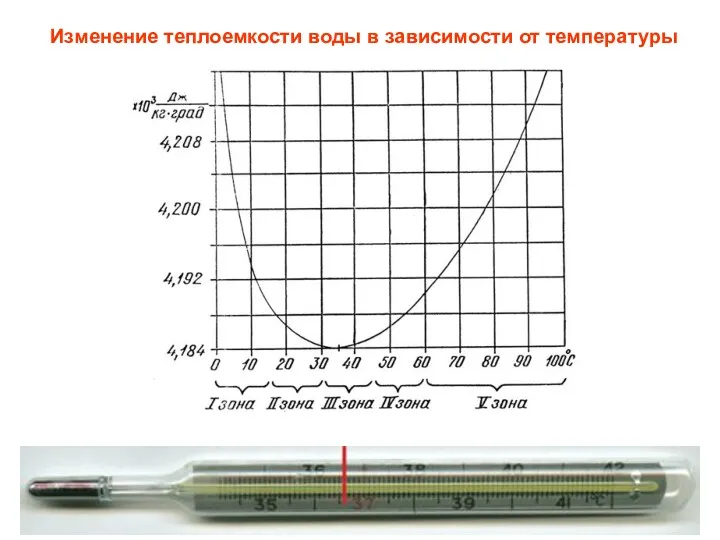
- 3. Изменение теплоемкости воды в зависимости от температуры
- 4. Значение растворов в жизнедеятельности организмов. Важнейшие биологические жидкости - кровь, лимфа моча, слюна, пот являются растворами
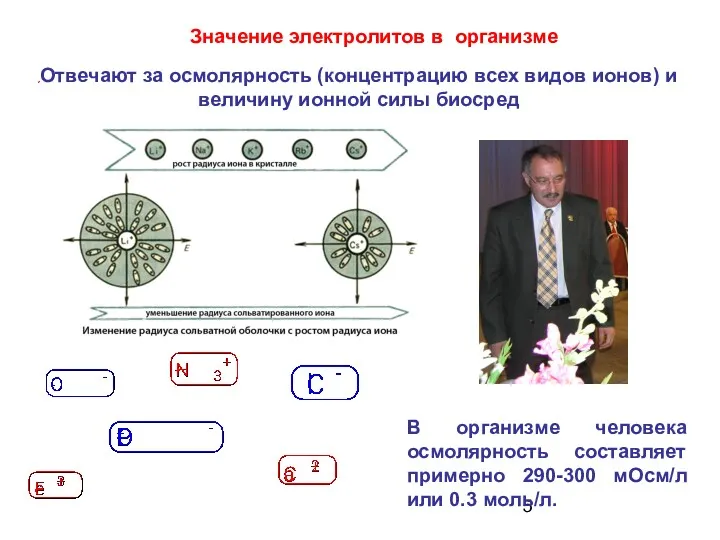
- 5. Отвечают за осмолярность (концентрацию всех видов ионов) и величину ионной силы биосред Значение электролитов в организме
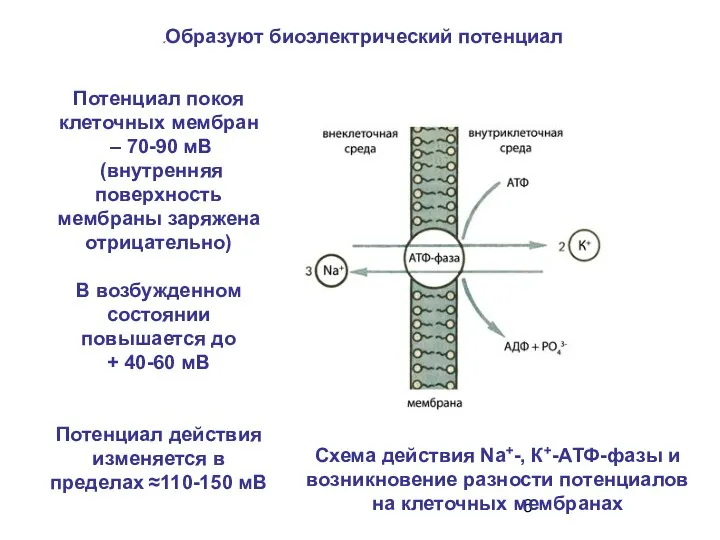
- 6. Схема действия Na+-, К+-АТФ-фазы и возникновение разности потенциалов на клеточных мембранах Потенциал покоя клеточных мембран –
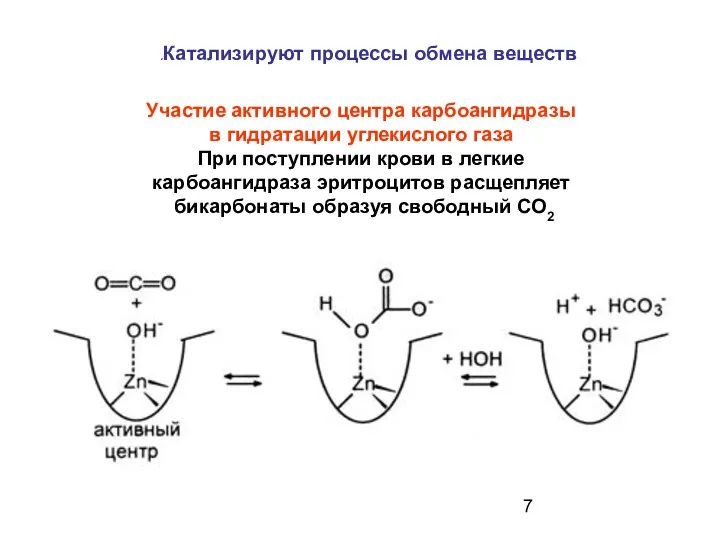
- 7. Участие активного центра карбоангидразы в гидратации углекислого газа При поступлении крови в легкие карбоангидраза эритроцитов расщепляет
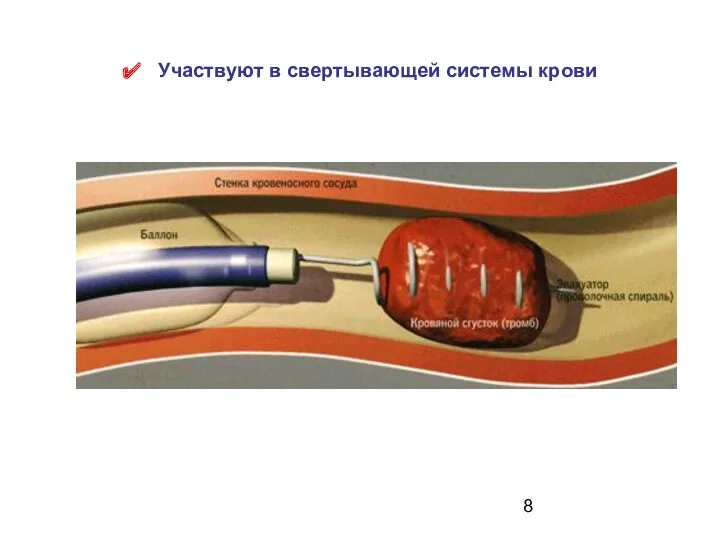
- 8. Участвуют в свертывающей системы крови
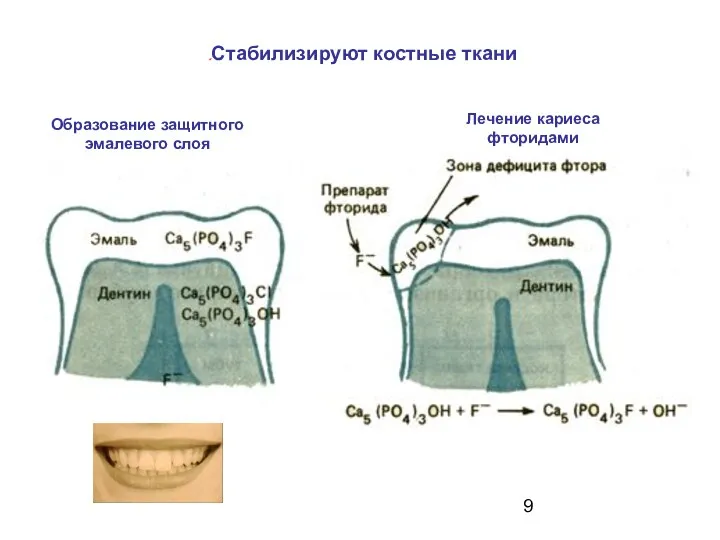
- 9. Образование защитного эмалевого слоя Лечение кариеса фторидами Стабилизируют костные ткани
- 10. Какие б чувства не таились Тогда во мне - теперь их нет: Они прошли иль изменились...
- 11. КИСЛОТНО-ОСНОВНОЕ РАВНОВЕСИЕ Имеющую огромное значение для химии чистую воду... можно рассматривать как слабую кислоту или слабое
- 12. При 25 °С Кд =1.8·10 -16 Концентрацию молекул воды как в чистой воде, так и в
- 13. В соответствии с принципом Ле Шателье при добавлении кислот или оснований равновесие H2O ↔ H+ +
- 14. Диссоциация воды - эндотермический процесс, следовательно, Kw растет с повышением температуры: Для наглядности удобно использовать величину
- 15. Для удобства в расчетах пользуются величинами водородного и гидроксильного показателей - рH и рОН, pH -
- 17. Для чистой воды рН=7 Дождевая вода за счет растворенного СО2 имеет рН ~ 5.5 – 6.0
- 18. Памятник Джорджу Вашингтону в Нью-Йорке в момент открытия и через 60 лет Мрамор СаСО3 под действием
- 19. Бронзовый памятник во влажном воздухе медленно покрывается налетом основного карбоната меди (СuOH)2CO3
- 20. Александр Федорович Тур (1894–1974) 1930-1934 -заведующий кафедрой физиологии, гигиены и диететики ребенка 1934-1939 - заведующий кафедрой
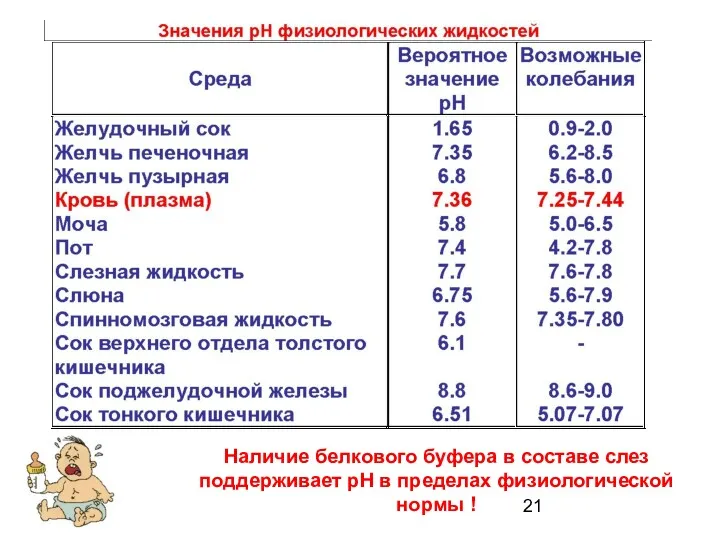
- 21. Наличие белкового буфера в составе слез поддерживает рН в пределах физиологической нормы !
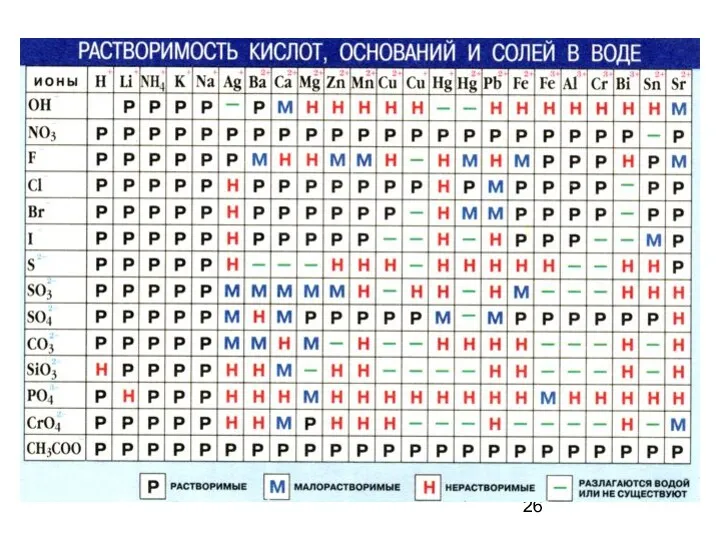
- 22. Электролиты – вещества, растворы и расплавы которых проводят электрический ток вследствие диссоциации на ионы. Расчет рН
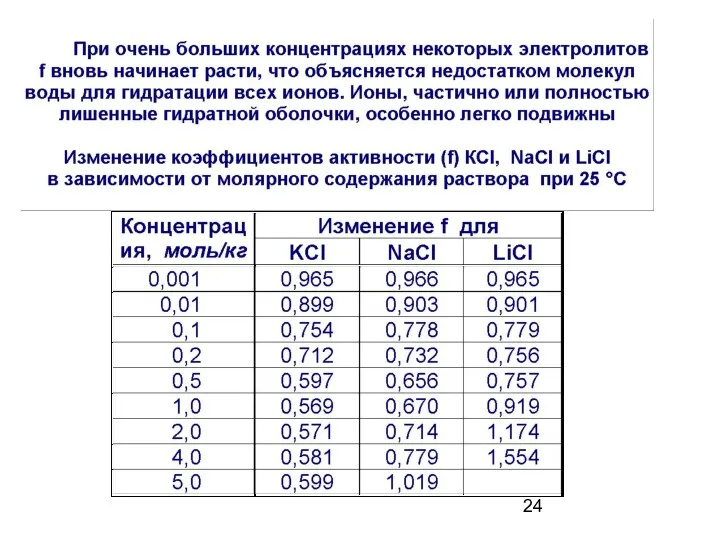
- 23. Сильные электролиты диссоциируют полностью, необратимо, в одну ступень. a – активность иона f – коэффициент активности,
- 25. К сильным электролитам относятся: 1. Кислоты - НСI , НВг , HI , H2SО4 , H2S2O7
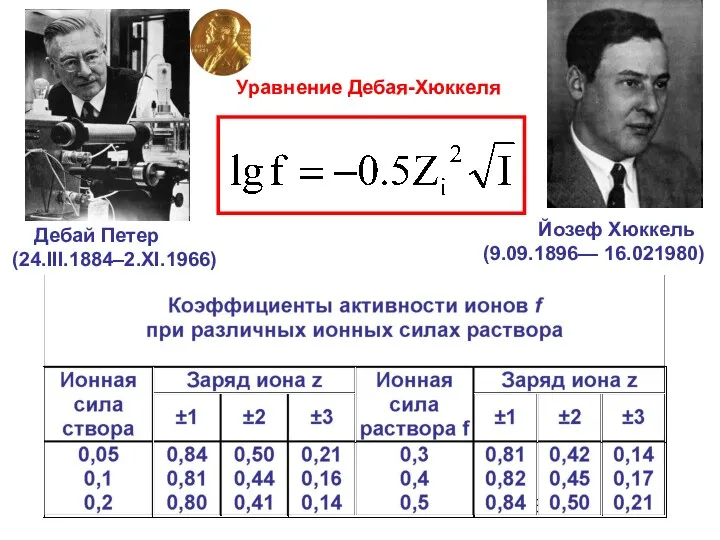
- 27. Ионная сила растворов Ионная сила растворов - величина, измеряемая полусуммой произведений концентраций всех находящихся в растворе
- 28. Уравнение Дебая-Хюккеля Дебай Петер (24.III.1884–2.XI.1966) Йозеф Хюккель (9.09.1896— 16.021980)
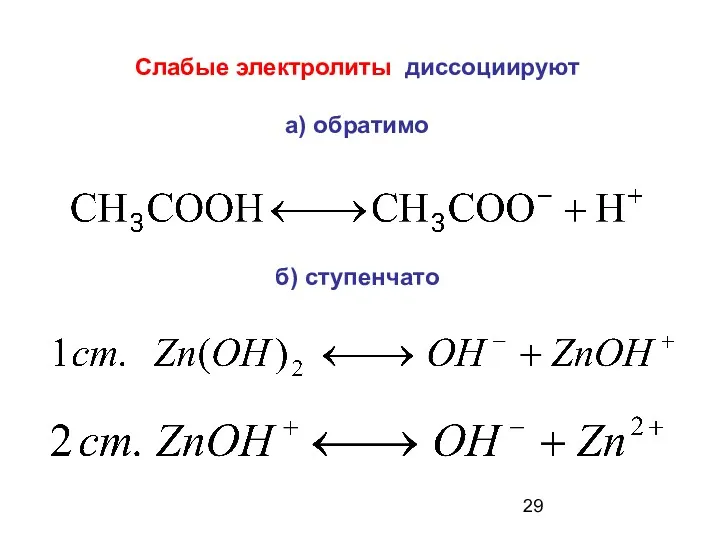
- 29. Слабые электролиты диссоциируют а) обратимо б) ступенчато
- 30. Степень диссоциации (ионизации) - отношение числа молекул, распавшихся на ионы, к общему числу молекул в растворе.
- 31. Закон разведения Оствальда Нобелевская премия (1909г) « в знак признания работ по катализу, а также за
- 32. При α Вывод закона разведения Оствальда
- 33. 2. Степень диссоциации кислоты HX равна 0,25. Какое суммарное число ионов H+ и X- приходится в
- 34. Расчет рН в растворах сильных электролитах Рассчитать рН, рОН, [OH-] для 0,001 м НNO3 рН =
- 35. Задача 1. рН яблочного сока равен 4,57. Найти [Н+] и [OH-] (моль/л). рОН = 14 -
- 37. Расчет [ Н+] и рН для растворов слабых электролитов Кислоты Смесь кислот
- 38. Для смеси оснований Основания
- 39. Задача 2. Найти рН, [Н+] и [OH-] 0,3 м раствора муравьиной кислоты (Кд=1.8∙10-4) рН = –
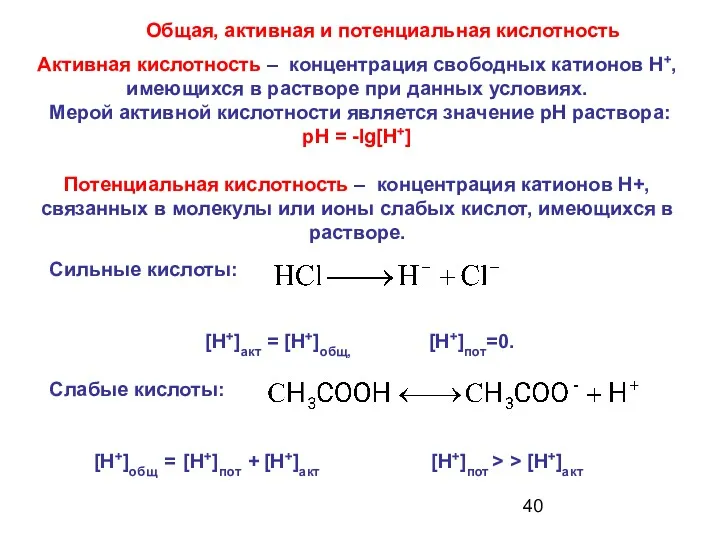
- 40. Общая, активная и потенциальная кислотность Активная кислотность – концентрация свободных катионов Н+, имеющихся в растворе при
- 43. Скачать презентацию





















![Расчет рН в растворах сильных электролитах Рассчитать рН, рОН, [OH-]](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/274713/slide-33.jpg)
![Задача 1. рН яблочного сока равен 4,57. Найти [Н+] и](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/274713/slide-34.jpg)

![Расчет [ Н+] и рН для растворов слабых электролитов Кислоты Смесь кислот](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/274713/slide-36.jpg)

![Задача 2. Найти рН, [Н+] и [OH-] 0,3 м раствора](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/274713/slide-38.jpg)

 Аминокислоты 2
Аминокислоты 2 Магний. Нахождение в природе
Магний. Нахождение в природе Цветные металлы и сплавы
Цветные металлы и сплавы Концентрации растворов
Концентрации растворов Небезпечні хімічні речовини
Небезпечні хімічні речовини Медь и её соединения
Медь и её соединения Вода на Земле. Строение молекулы воды
Вода на Земле. Строение молекулы воды Периодическая система химических элементов Д.И. Менделеева. Знаки химических элементов
Периодическая система химических элементов Д.И. Менделеева. Знаки химических элементов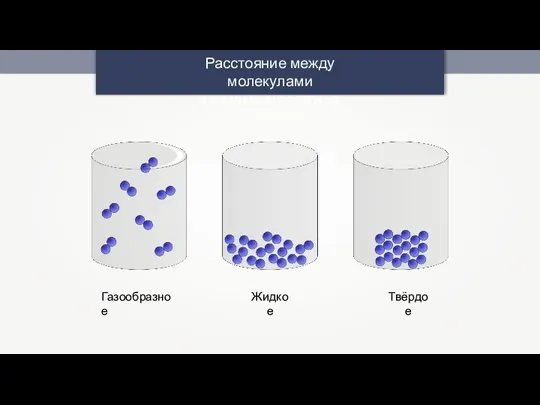 Расстояние между молекулами в разных агрегатных состояниях
Расстояние между молекулами в разных агрегатных состояниях Сущность процесса электролитической диссоциации
Сущность процесса электролитической диссоциации Азотовмісні сполуки
Азотовмісні сполуки Кристаллография, кристаллохимия, минералогия
Кристаллография, кристаллохимия, минералогия Знаки химических элементов. Химические формулы. Химический диктант
Знаки химических элементов. Химические формулы. Химический диктант Етери та естери. Хімічні властивості
Етери та естери. Хімічні властивості Физико-химические методы исследования биологически активных веществ
Физико-химические методы исследования биологически активных веществ Химическое равновесие в гомогенных системах. Ионное произведение воды. 12 класс
Химическое равновесие в гомогенных системах. Ионное произведение воды. 12 класс Изомерия и ее виды
Изомерия и ее виды Берилій
Берилій Новые интеллектуальные материалы на основе полимеров
Новые интеллектуальные материалы на основе полимеров Аммиак. Строение молекулы аммиака, его физические и химические свойства
Аммиак. Строение молекулы аммиака, его физические и химические свойства Вуглеводні. Лекція 11
Вуглеводні. Лекція 11 Алмазы. Бриллианты
Алмазы. Бриллианты Растворы. Общие свойства растворов
Растворы. Общие свойства растворов Химиялық элементтердің тірі және өлі табиғатта таралуы
Химиялық элементтердің тірі және өлі табиғатта таралуы Кислотно-основные (протолитические) равновесия
Кислотно-основные (протолитические) равновесия Методика изучения и описание вулканогенных обломочных пород
Методика изучения и описание вулканогенных обломочных пород Зеленая химия и проблемы устойчивого развития
Зеленая химия и проблемы устойчивого развития Кислород. Оксиды. Валентность
Кислород. Оксиды. Валентность