Содержание
- 2. Алкилирование аренов по Фриделю-Крафтсу Часто встречается в промышленности, но используется только для алкилирования активированных аренов; фенолы
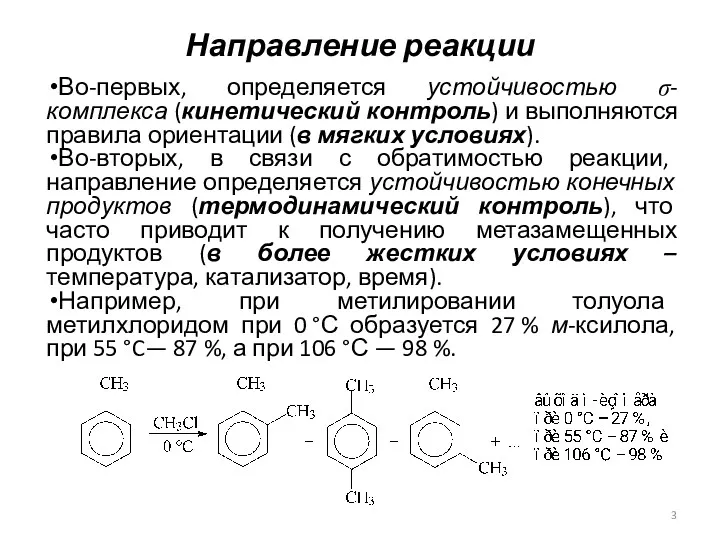
- 3. Направление реакции Во-первых, определяется устойчивостью σ-комплекса (кинетический контроль) и выполняются правила ориентации (в мягких условиях). Во-вторых,
- 4. Катализаторы процессов алкилирования Протонные кислоты – при алкилировании спиртами и алкенами. Активность падает в ряду HF
- 5. Особенности катализа Активность катализатора зависит от строения субстрата, природы алкилирующего агента и условий реакции. Так, BF3
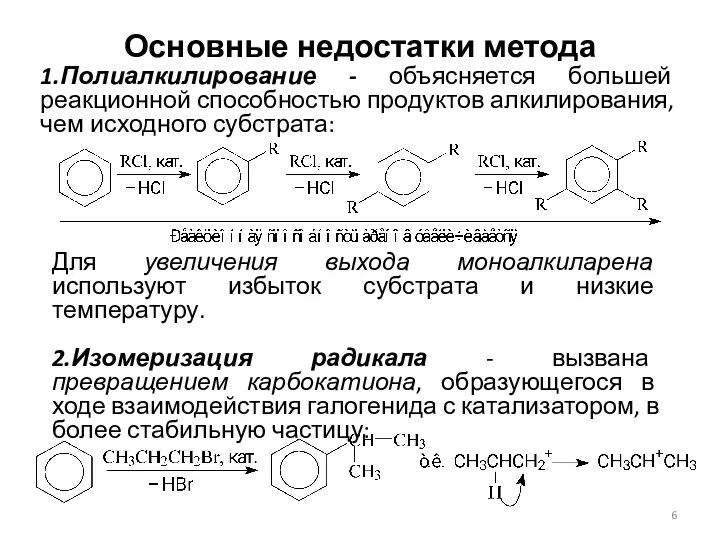
- 6. Основные недостатки метода 1.Полиалкилирование - объясняется большей реакционной способностью продуктов алкилирования, чем исходного субстрата: Для увеличения
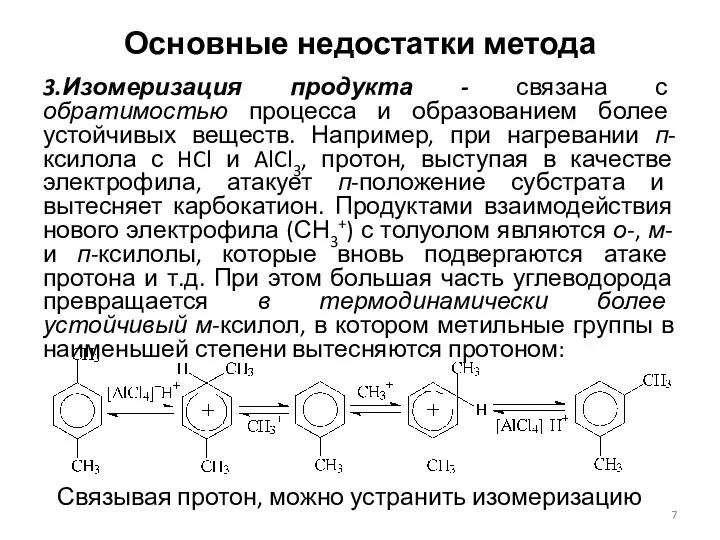
- 7. Основные недостатки метода 3.Изомеризация продукта - связана с обратимостью процесса и образованием более устойчивых веществ. Например,
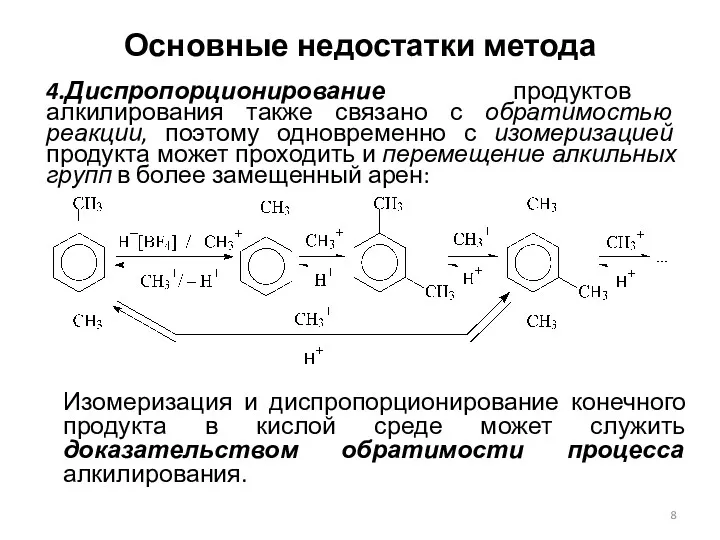
- 8. Основные недостатки метода 4.Диспропорционирование продуктов алкилирования также связано с обратимостью реакции, поэтому одновременно с изомеризацией продукта
- 9. Алкилирование аренов алкилгалогенидами Проводится в безводном инертном растворителе (нитробензоле) или в избытке субстрата в присутствии кислот
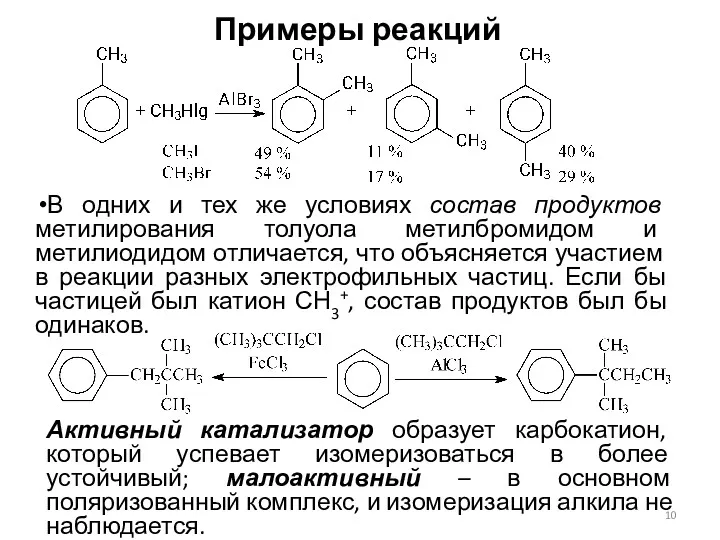
- 10. Примеры реакций В одних и тех же условиях состав продуктов метилирования толуола метилбромидом и метилиодидом отличается,
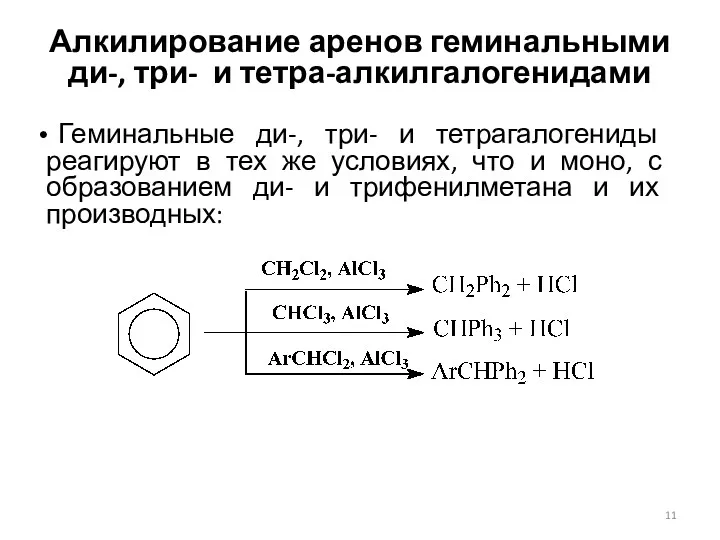
- 11. Алкилирование аренов геминальными ди-, три- и тетра-алкилгалогенидами Геминальные ди-, три- и тетрагалогениды реагируют в тех же
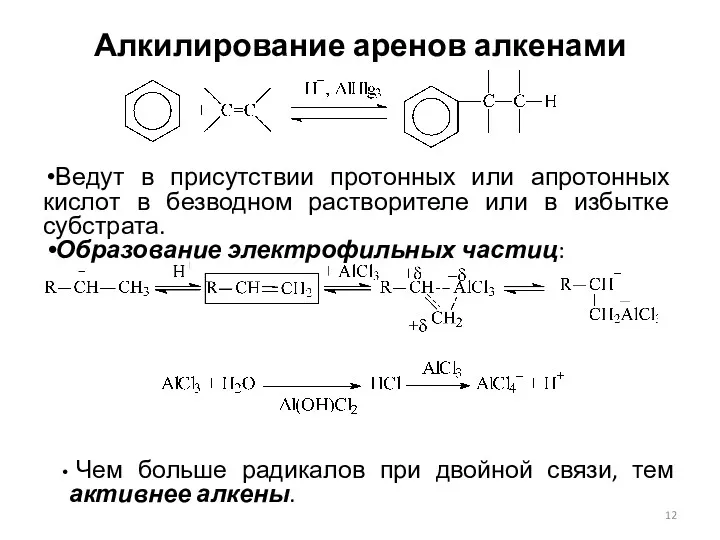
- 12. Алкилирование аренов алкенами Ведут в присутствии протонных или апротонных кислот в безводном растворителе или в избытке
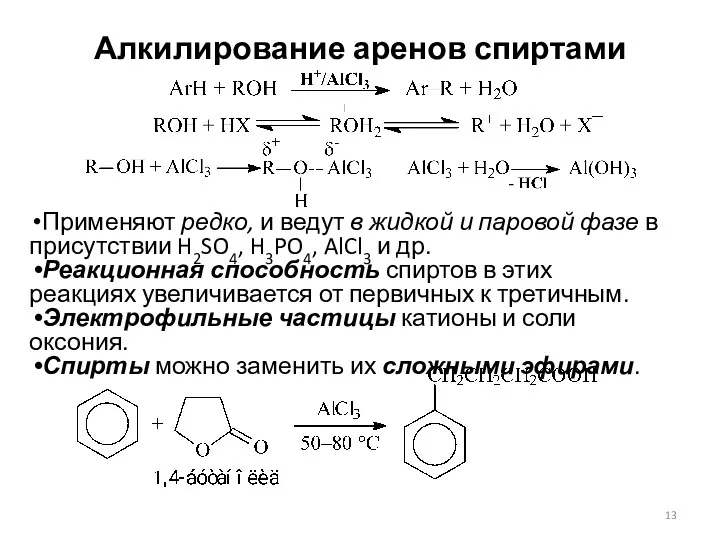
- 13. Алкилирование аренов спиртами Применяют редко, и ведут в жидкой и паровой фазе в присутствии H2SO4, H3PO4,
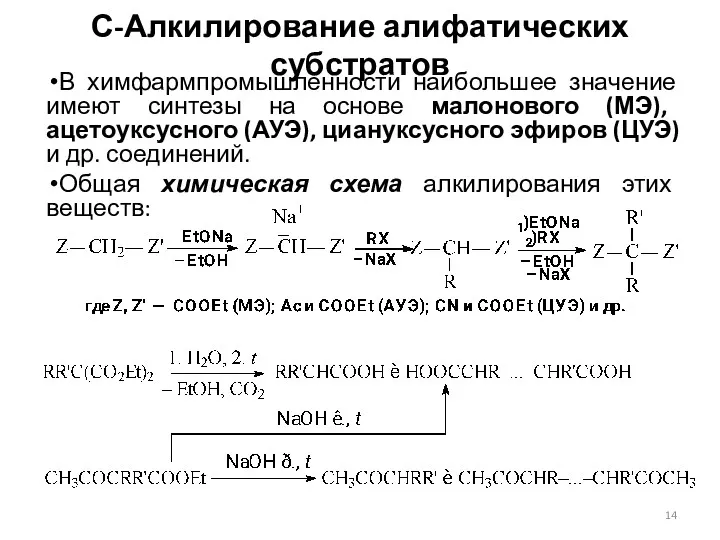
- 14. С-Алкилирование алифатических субстратов В химфармпромышленности наибольшее значение имеют синтезы на основе малонового (МЭ), ацетоуксусного (АУЭ), циануксусного
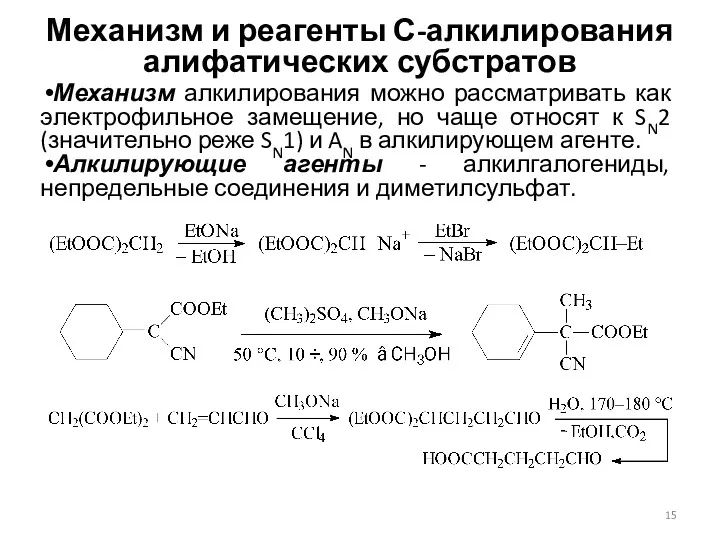
- 15. Механизм и реагенты С-алкилирования алифатических субстратов Механизм алкилирования можно рассматривать как электрофильное замещение, но чаще относят
- 16. N-Алкилирование (арилирование) галогенидами (механизмы SN2, SNAr и др.) Выделяется галогеноводород, что затрудняет реакцию, поэтому в реакционную
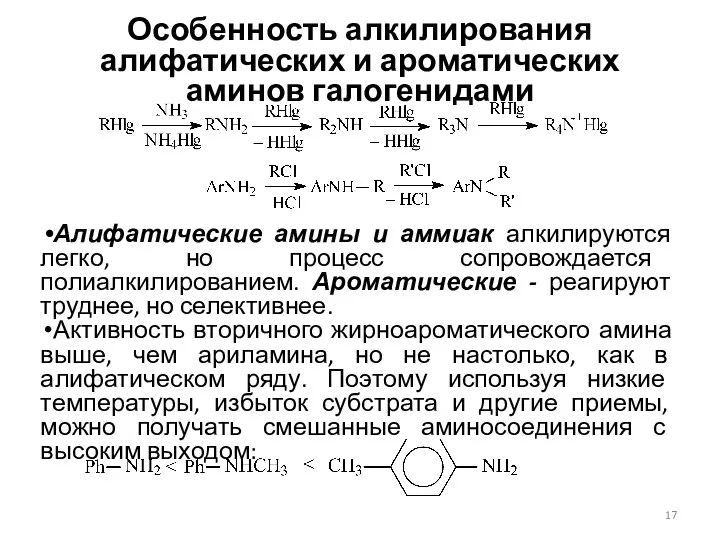
- 17. Особенность алкилирования алифатических и ароматических аминов галогенидами Алифатические амины и аммиак алкилируются легко, но процесс сопровождается
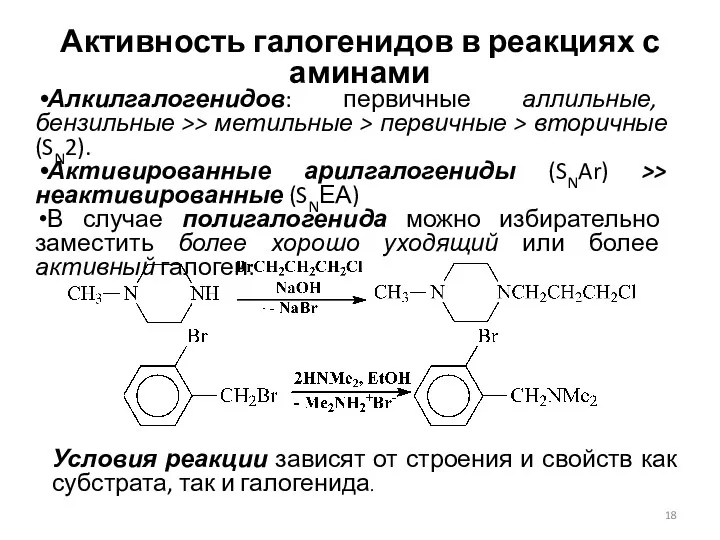
- 18. Активность галогенидов в реакциях с аминами Алкилгалогенидов: первичные аллильные, бензильные >> метильные > первичные > вторичные
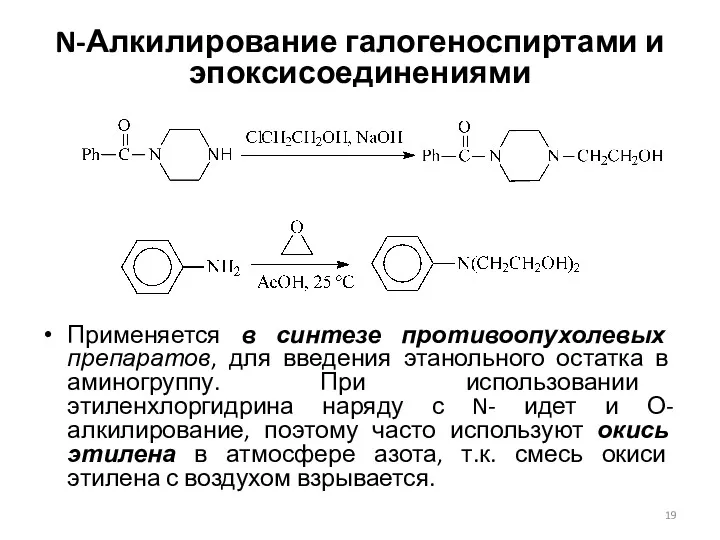
- 19. N-Алкилирование галогеноспиртами и эпоксисоединениями Применяется в синтезе противоопухолевых препаратов, для введения этанольного остатка в аминогруппу. При
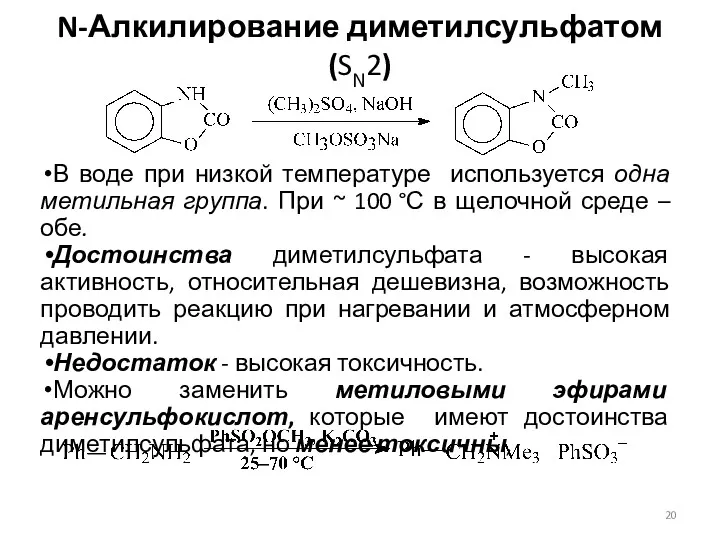
- 20. N-Алкилирование диметилсульфатом (SN2) В воде при низкой температуре используется одна метильная группа. При ~ 100 °С
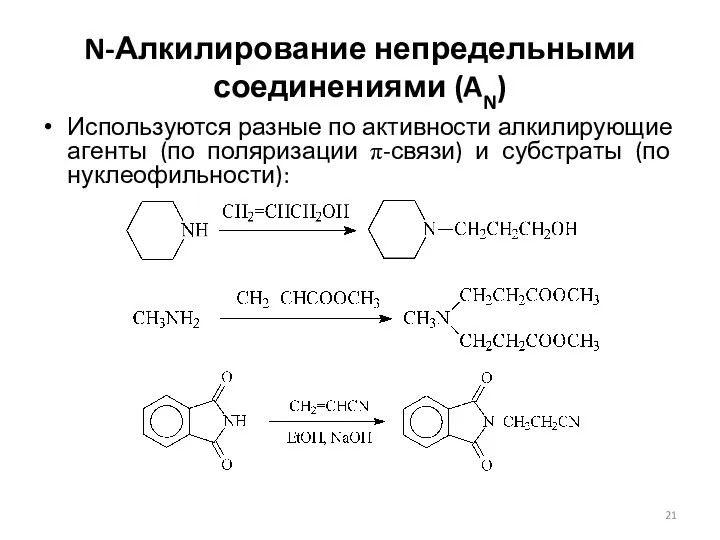
- 21. N-Алкилирование непредельными соединениями (AN) Используются разные по активности алкилирующие агенты (по поляризации π-связи) и субстраты (по
- 22. N-Алкилирование спиртами и эфирами Обычно алкилируют ароматические амины по SN1- и SN2 механизму избытком спирта: В
- 23. Синтез аминов по Эшвайлеру-Кларку Достоинства: выход до 100 %, можно метилировать многие амины при температурах около
- 24. О-Алкилирование (арилирование) Алкил(арил)галогениды широко применяются для О-алкилирования (арилирования). При этом используется реакция Вильямсона или реакция гидроксисоединений
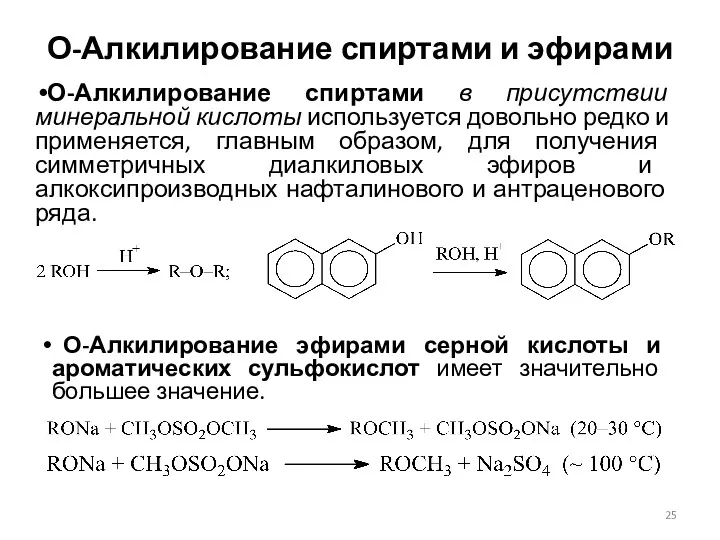
- 25. О-Алкилирование спиртами и эфирами О-Алкилирование спиртами в присутствии минеральной кислоты используется довольно редко и применяется, главным
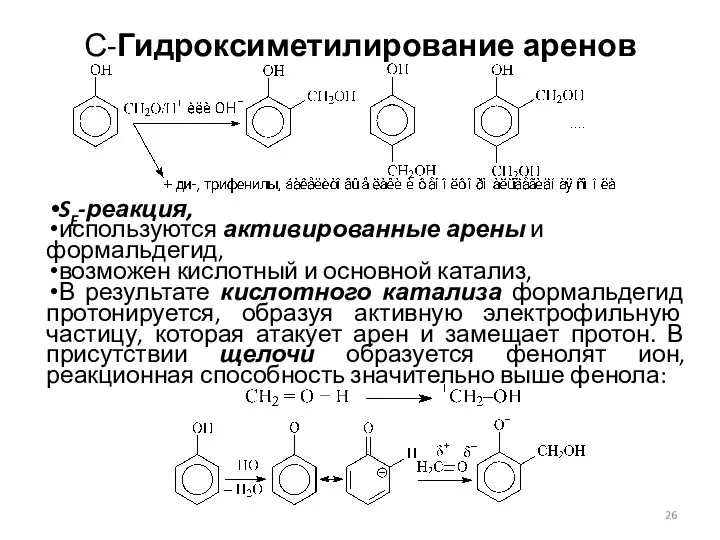
- 26. С-Гидроксиметилирование аренов SE-реакция, используются активированные арены и формальдегид, возможен кислотный и основной катализ, В результате кислотного
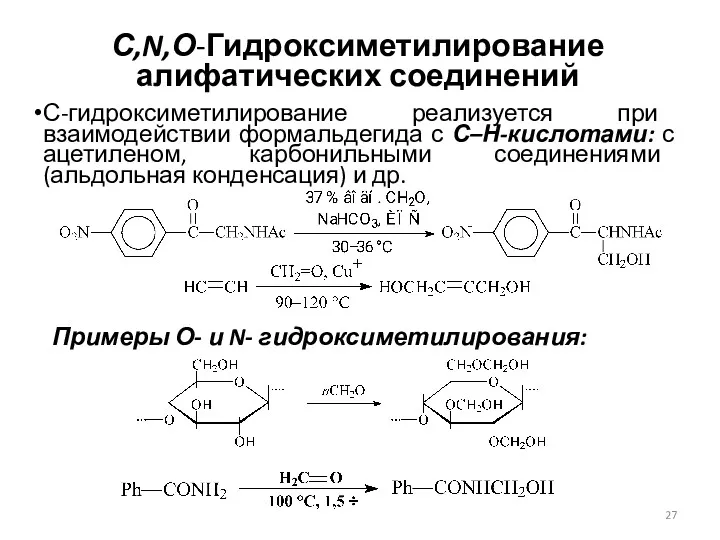
- 27. С,N,О-Гидроксиметилирование алифатических соединений С-гидроксиметилирование реализуется при взаимодействии формальдегида с С–Н-кислотами: с ацетиленом, карбонильными соединениями (альдольная конденсация)
- 28. Реакция галогенметилирования Для получения бензилгалогенидов из аренов. Реагенты: формальдегид, галогеноводород и катализатор. При пропускании хлористого водорода
- 30. Скачать презентацию









 Приёмы обращения с лабораторным оборудованием
Приёмы обращения с лабораторным оборудованием Химия биогенных элементов p -блока
Химия биогенных элементов p -блока Периодический закон и периодическая система химических элементов
Периодический закон и периодическая система химических элементов Основные классы неорганических веществ. Соединения химических элементов
Основные классы неорганических веществ. Соединения химических элементов Выделение транс-анетола из эфирных масел
Выделение транс-анетола из эфирных масел Изучение свойств горных пород, минералов и полезных ископаемых
Изучение свойств горных пород, минералов и полезных ископаемых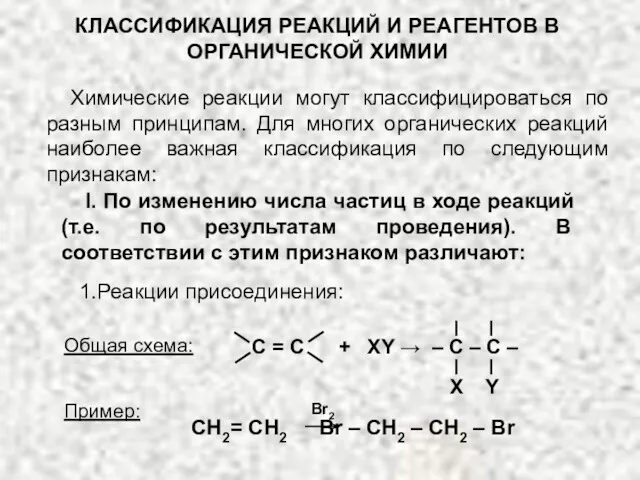 Классификация реакций и реагентов органической химии
Классификация реакций и реагентов органической химии Химическая промышленность
Химическая промышленность Азотсодержащие гетероциклические соединения
Азотсодержащие гетероциклические соединения Химические свойства металлов
Химические свойства металлов Хімічний склад і використання мінералів
Хімічний склад і використання мінералів Химиялық тепе-теңдік және оның ығысуына әсер етуші жағдайлар. Ле Шателье-Браун принциптері
Химиялық тепе-теңдік және оның ығысуына әсер етуші жағдайлар. Ле Шателье-Браун принциптері Окислительно-восстановительные реакции. Лекция 8
Окислительно-восстановительные реакции. Лекция 8 Получение порошков автоклавным осаждением
Получение порошков автоклавным осаждением Обратимость химических реакций. Химическое равновесие и способы его смещения
Обратимость химических реакций. Химическое равновесие и способы его смещения Строение атома
Строение атома Электролиз. Электролизеры
Электролиз. Электролизеры Применение уксусной кислоты
Применение уксусной кислоты Фосфор. Гипофосфатемия и гиперфосфатемия
Фосфор. Гипофосфатемия и гиперфосфатемия Кислородсодержащие органические соединения
Кислородсодержащие органические соединения Розрахунки за хімічними рівняннями
Розрахунки за хімічними рівняннями Установка по переработке углеводородов
Установка по переработке углеводородов Комплексные соединения
Комплексные соединения Физико-химические методы анализа. Лекция 3
Физико-химические методы анализа. Лекция 3 Сера. Аллотропные модификации
Сера. Аллотропные модификации Гидролиз органических и неорганических соединений
Гидролиз органических и неорганических соединений Качественное определение химических элементов в почве
Качественное определение химических элементов в почве Аммиак
Аммиак