Содержание
- 3. История Атом – неделимый (Демокрит, 5 в. до н.э.) XIX в. – открыт электрон (Томпсон, 1897),
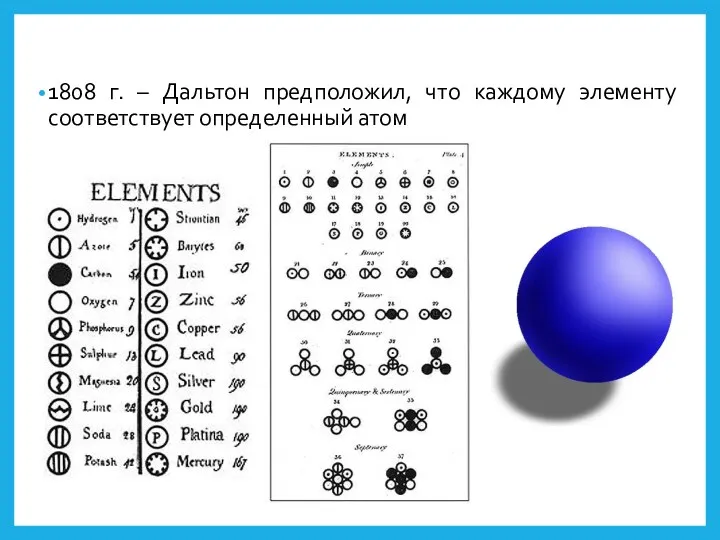
- 4. 1808 г. – Дальтон предположил, что каждому элементу соответствует определенный атом
- 5. Опыты Кюри конец XIX в. – в определенных условиях атомы одних Э. м. превращаться в др.
- 6. Пудинг с изюмом (Томпсон) (1897)
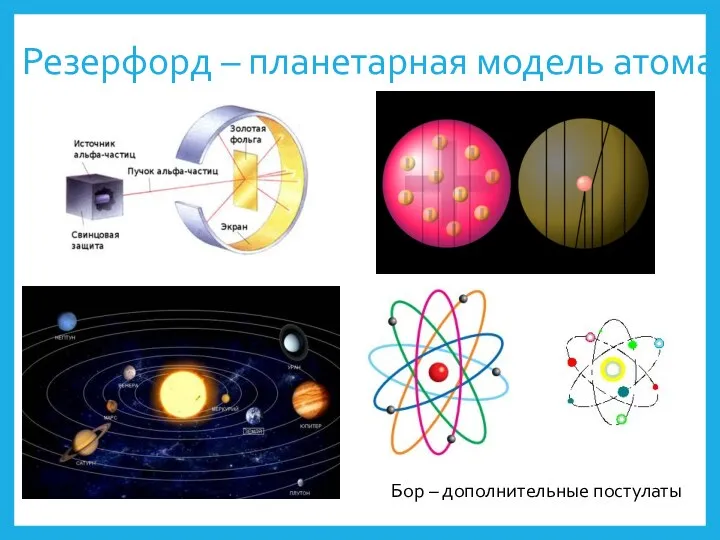
- 7. Бор – дополнительные постулаты Резерфорд – планетарная модель атома
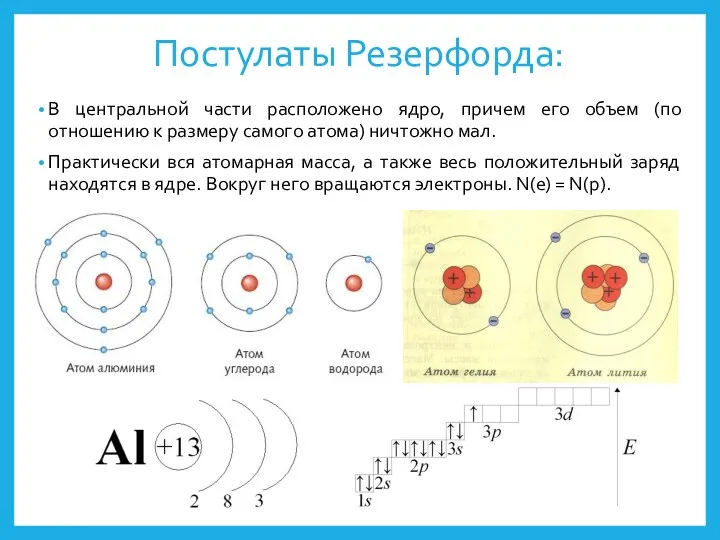
- 8. Постулаты Резерфорда: В центральной части расположено ядро, причем его объем (по отношению к размеру самого атома)
- 9. Постулаты Бора: Любая атомная система может находиться только в особых атомных состояниях, причем для каждого из
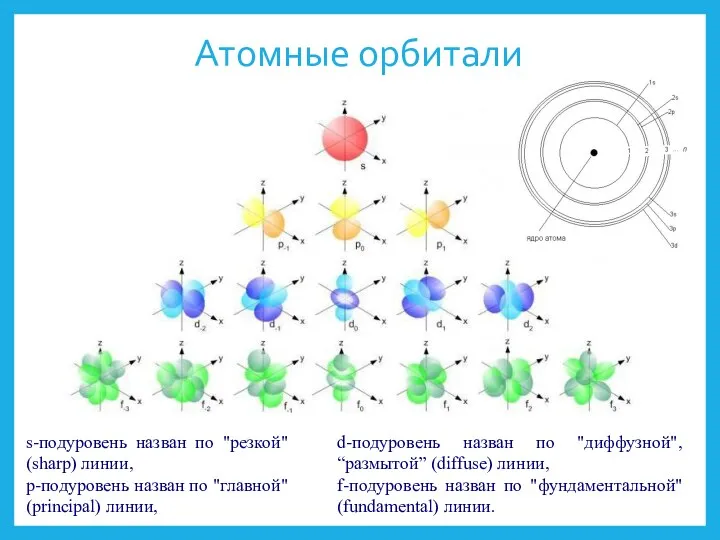
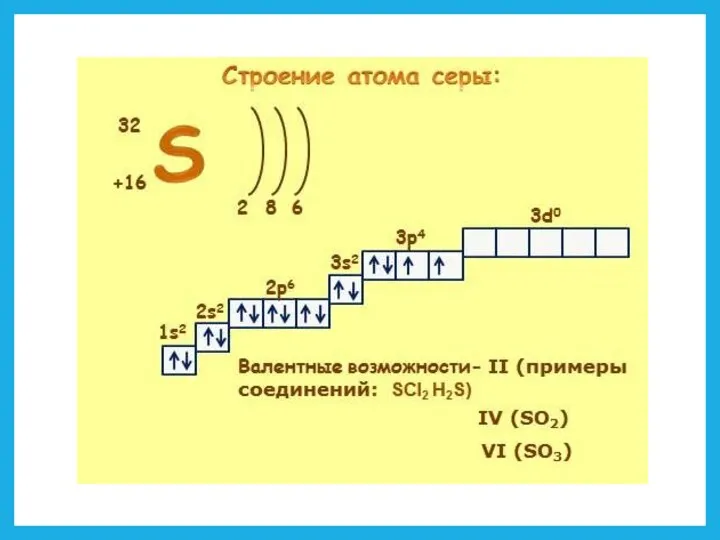
- 10. Атомные орбитали s-подуровень назван по "резкой" (sharp) линии, p-подуровень назван по "главной" (principal) линии, d-подуровень назван
- 11. Основоположники квантовой механики: французский физик Л. де Бройль, немец В. Гейзенберг, австриец Э. Шредингер, англичанин П.
- 12. Электроны это частицы с отрицательным зарядом -1 (в условных единицах) и относительной массой, равной 1/1837 массы
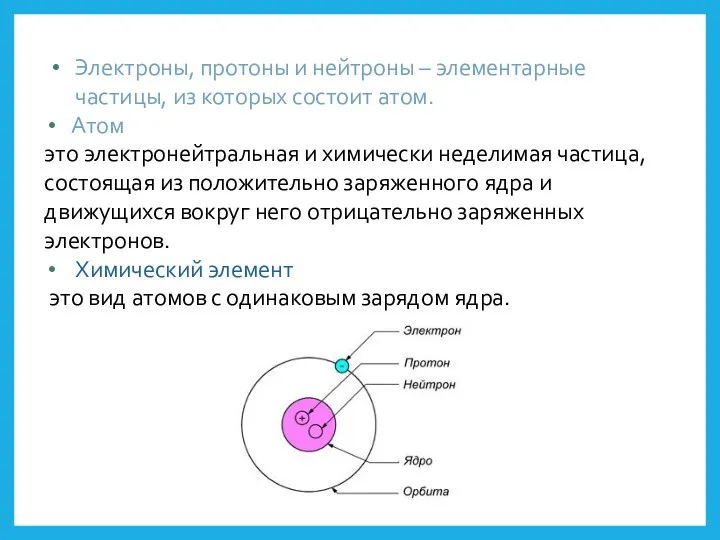
- 13. Электроны, протоны и нейтроны – элементарные частицы, из которых состоит атом. Атом это электронейтральная и химически
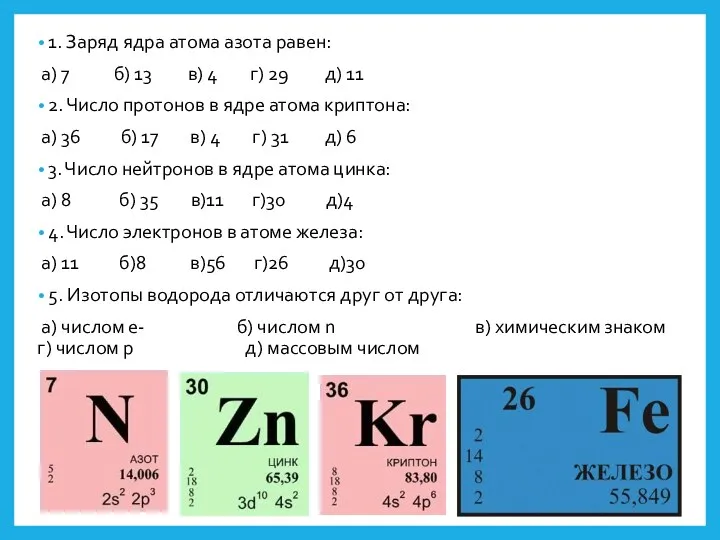
- 14. 1. Заряд ядра атома азота равен: а) 7 б) 13 в) 4 г) 29 д) 11
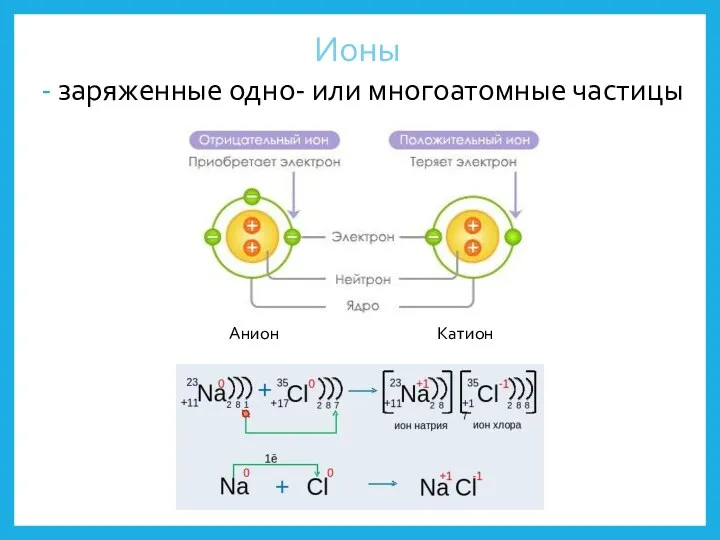
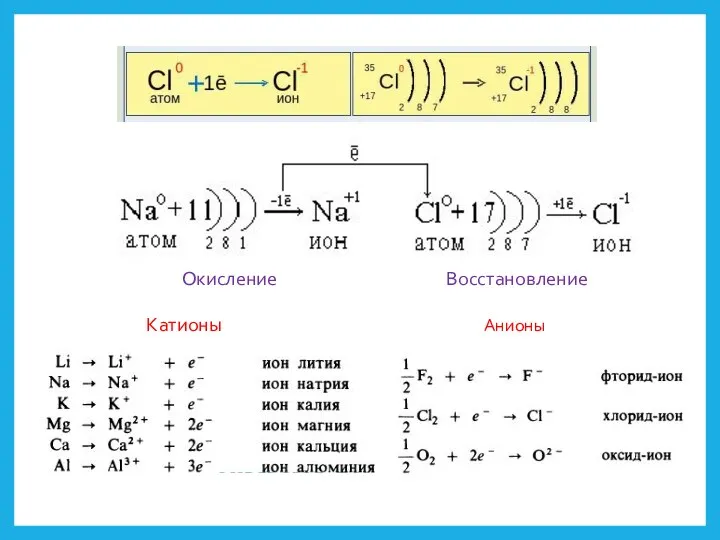
- 16. - заряженные одно- или многоатомные частицы Анион Катион Ионы
- 17. Катионы Окисление Восстановление Анионы
- 19. Скачать презентацию







 Алкены. Непредельные углеводороды
Алкены. Непредельные углеводороды Массовая доля вещества в растворе
Массовая доля вещества в растворе Металлы подгруппы железа Fe, Co, Ni
Металлы подгруппы железа Fe, Co, Ni АЛКАНЫ 9 класс
АЛКАНЫ 9 класс Поддержание заданного качества свинцового теплоносителя для энергетических ядерных реакторов
Поддержание заданного качества свинцового теплоносителя для энергетических ядерных реакторов Гониометрическое исследование кристаллов
Гониометрическое исследование кристаллов Закон сохранения массы веществ. Химические уравнения
Закон сохранения массы веществ. Химические уравнения Растворы. Смеси веществ
Растворы. Смеси веществ Полистирол өндірісі
Полистирол өндірісі Степень загрязнения почвы по химическому составу снежного покрова на разном удалении от источника загрязнения
Степень загрязнения почвы по химическому составу снежного покрова на разном удалении от источника загрязнения Электролиз. Коррозия и защита металлов
Электролиз. Коррозия и защита металлов Коррозия металлов. Методы защиты металлов от коррозии
Коррозия металлов. Методы защиты металлов от коррозии Химия в повседневной жизни
Химия в повседневной жизни Химические формулы
Химические формулы Драгоценные камни
Драгоценные камни Рекомендации по оформлению развёрнутых ответов на задания ЕГЭ
Рекомендации по оформлению развёрнутых ответов на задания ЕГЭ Нано-порошки. Способы получения нано-порошков
Нано-порошки. Способы получения нано-порошков Полимеры и пластические массы
Полимеры и пластические массы Anionic Polymerization
Anionic Polymerization Физико-химические свойства аммиака. Производство аммиака
Физико-химические свойства аммиака. Производство аммиака Обмен липидов
Обмен липидов Кислотно-основные свойства органических соединений. (Лекция 3)
Кислотно-основные свойства органических соединений. (Лекция 3) Массовая доля элемента в сложном веществе
Массовая доля элемента в сложном веществе Типы химических реакций
Типы химических реакций Кислоты. Растворы всех кислот
Кислоты. Растворы всех кислот Периодический закон Д.И. Менделеева. Строение атома. Химическая связь
Периодический закон Д.И. Менделеева. Строение атома. Химическая связь Алюминий
Алюминий Применение спиртов
Применение спиртов