Содержание
- 2. Необратимые химические реакции — это реакции, которые протекают только в одном направлении («слева направо»), в результате
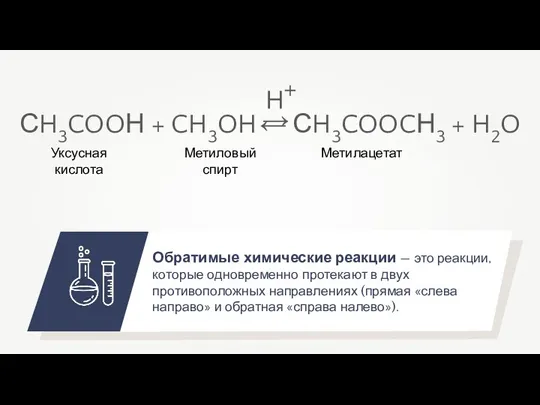
- 3. Обратимые химические реакции — это реакции, которые одновременно протекают в двух противоположных направлениях (прямая «слева направо»
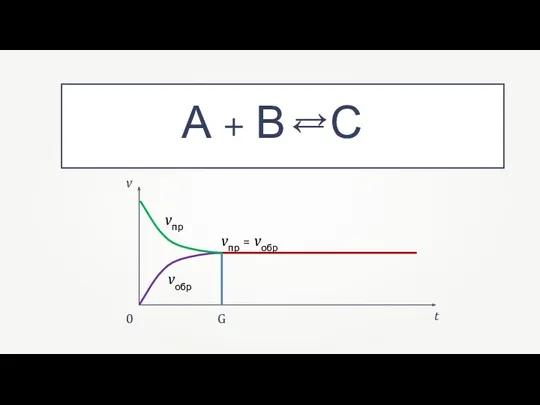
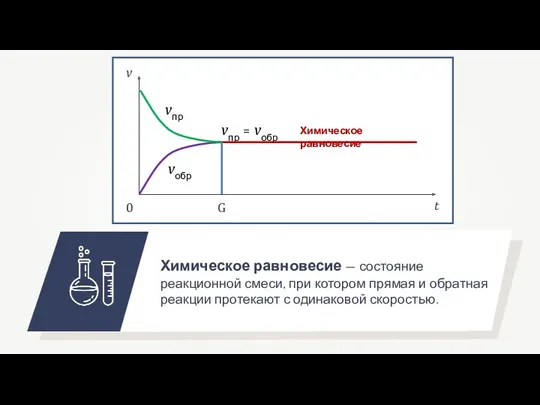
- 4. v t vпр vобр vпр = vобр 0 G
- 5. Химическое равновесие — состояние реакционной смеси, при котором прямая и обратная реакции протекают с одинаковой скоростью.
- 6. Анри Ле Шателье 1850–1936 гг. Закон смещения химического равновесия в зависимости от внешних факторов в 1885
- 7. Принцип Ле Шателье Если изменить одно из условий (температуру, давление или концентрацию одного из веществ), при
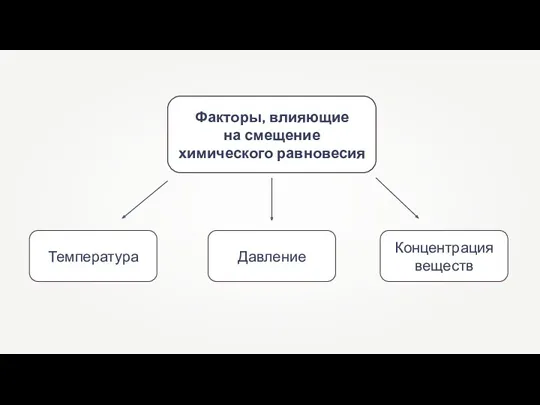
- 8. Факторы, влияющие на смещение химического равновесия
- 9. При повышении температуры система противодействует, т.е. охлаждает себя, что происходит за счёт смещения равновесия в сторону
- 10. При понижении температуры система отвечает нагреванием, т.е. смещением равновесия в сторону экзотермической реакции соединения NO и
- 11. Чтобы увеличить скорость прямой реакции, нужно понизить давление в сосуде. Чтобы сместить равновесие в сторону обратной
- 12. При увеличении концентрации NO2 скорость прямой реакции увеличится. Если увеличить концентрацию NO или O2, или их
- 14. Скачать презентацию







 Вода как среда и участник протекания биохимических процессов в организме
Вода как среда и участник протекания биохимических процессов в организме Сущность процесса электролитической диссоциации
Сущность процесса электролитической диссоциации Основания. 8 класс
Основания. 8 класс Неон. Получение
Неон. Получение Получение и химические свойства оснований
Получение и химические свойства оснований Сложные эфиры. Жиры. Мыла
Сложные эфиры. Жиры. Мыла Кристалічний і аморфний стани твердих речовин
Кристалічний і аморфний стани твердих речовин Chimia coordinativă
Chimia coordinativă Атоми, молекули, йони, хімічні елементи, їхні назви й символи. Урок 10
Атоми, молекули, йони, хімічні елементи, їхні назви й символи. Урок 10 Неметаллы. Общая характеристика неметаллов
Неметаллы. Общая характеристика неметаллов Соединения серы
Соединения серы Кислород. Строение молекулы кислорода. Получение кислорода. Взаимодействие с кислородом простых и сложных веществ
Кислород. Строение молекулы кислорода. Получение кислорода. Взаимодействие с кислородом простых и сложных веществ Electron configuration and periodicity
Electron configuration and periodicity Карбоновые кислоты
Карбоновые кислоты Этанол. Одноатомный спирт
Этанол. Одноатомный спирт Коллоидная химия
Коллоидная химия Р-элементы IV Группы Периодической Системы
Р-элементы IV Группы Периодической Системы Рідкі кристали та їх властивості
Рідкі кристали та їх властивості Составление химических формул бинарных соединений по степени окисления атомов
Составление химических формул бинарных соединений по степени окисления атомов Гидроочистка дизельного топлива
Гидроочистка дизельного топлива Introduction to Biochemistry
Introduction to Biochemistry Су - тіршілік көзі
Су - тіршілік көзі Заходи з ліквідації наслідків хімічної небезпечної надзвичайної ситуації. Особливості ведення хімічної розвідки та контролю
Заходи з ліквідації наслідків хімічної небезпечної надзвичайної ситуації. Особливості ведення хімічної розвідки та контролю Особенности строения, реакционной способности и методы синтеза карбоновых кислот и функциональных производных
Особенности строения, реакционной способности и методы синтеза карбоновых кислот и функциональных производных Карбонаты
Карбонаты Карбонилсодержащие соединения. Строение и химические свойства карбоновых кислот. Липиды. Фосфолипиды
Карбонилсодержащие соединения. Строение и химические свойства карбоновых кислот. Липиды. Фосфолипиды Химическая связь. Лекция 2-3
Химическая связь. Лекция 2-3 Алкины - непредельные углеводороды с общей формулой CnH2n+2
Алкины - непредельные углеводороды с общей формулой CnH2n+2