Содержание
- 2. Контрольные вопросы Учение о растворах. Роль воды и растворов в жизнедеятельности 2. Физико-химическое свойства воды 3.
- 3. Пример : Вода – это растворитель, если растворить твердое вещество (глюкозу) или газ (СО2 ). А
- 4. Концентрационный гомеостаз
- 5. Содержание и распределение воды в организме человека ~ 60 % от общей массы тела человека составляет
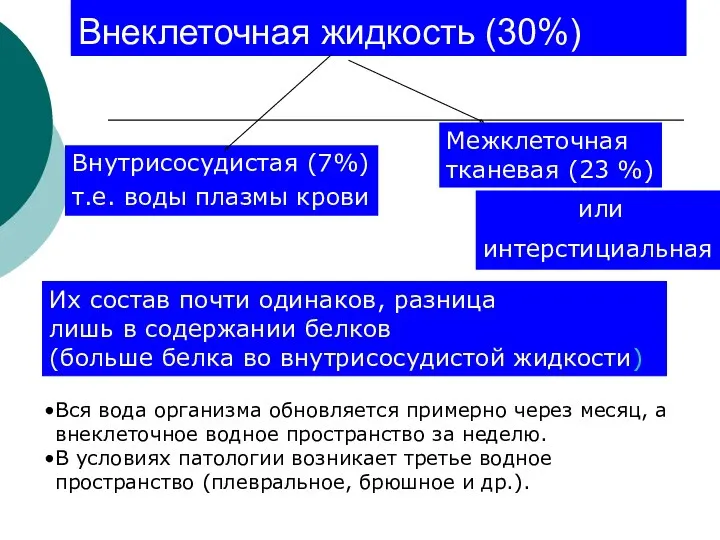
- 7. Внеклеточная жидкость (30%) Межклеточная тканевая (23 %) Внутрисосудистая (7%) т.е. воды плазмы крови или интерстициальная Их
- 8. Факторы регуляции: осмотическое, онкотическое, гидростатическое давления, проницаемость и транспорт через гистогематические барьеры, нейроэндокринная регуляция деятельности органов
- 9. В биохимических процессах вода выступает как : 1. Растворитель 2. Реагент 3. Продукт реакции 1.Вода- универсальный
- 10. 2. Вода – реагент в биохимических реакциях: кислотно-основных (автопротолиз воды) Н2О + Н2О ↔ Н3О+ +
- 11. 3. Вода- продукт биохимических реакций 57 ккал/моль 2Н2+О2? 2Н2О + Q Вывод: Н2О – универсальный растворитель,
- 12. «Вода! У тебя нет ни вкуса, ни цвета, ни запаха, тебя не опишешь, тобой наслаждаешься, не
- 13. Коллигативные свойства разбавленных растворов неэлектролитов и электролитов Свойства разбавленных растворов, зависящие только от концентрации частиц в
- 14. Осмос, осмотическое давление (πосм. Закон Вант-Гоффа Осмос – процесс односторонней диффузии растворителя сквозь полупроницаемую перегородку от
- 15. Осмотическое давление крови человека довольно постоянно и при температуре 310 К (37оС) составляет 740-780 кПа (7,4-7,8
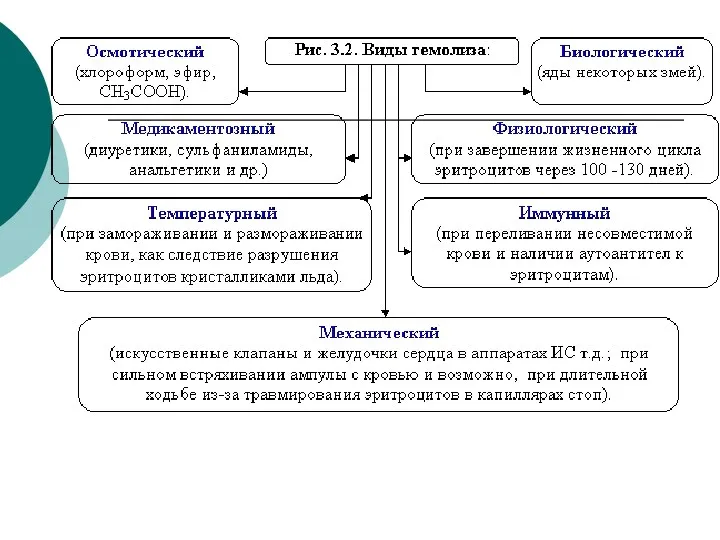
- 16. Наблюдение явлений плазмолиза и гемолиза эритроцитов (см. рисунки 3.1 и 3.2)
- 17. Плазмолиз– это сжатие и сморщивание оболочки клетки, так как в результате экзоосмоса вода диффундирует из клетки
- 18. Гемолиз – это разрыв оболочки эритроцитов и выход гемоглобина в плазму, т.к. в результате эндосмоса вода
- 19. Например, если внутривенно ввести раствор, гипотонический по отношению к крови, то наблюдается "осмотический шок" и вследствие
- 21. Онкотическое давление – это часть осмотического давление, создаваемое за счет содержания крупномолекулярных соединений (белков плазмы) в
- 22. Онкотическое давление влияет на образование тканевой жидкости, лимфы, мочи и всасывание воды в кишечнике. Поэтому кровезамещающие
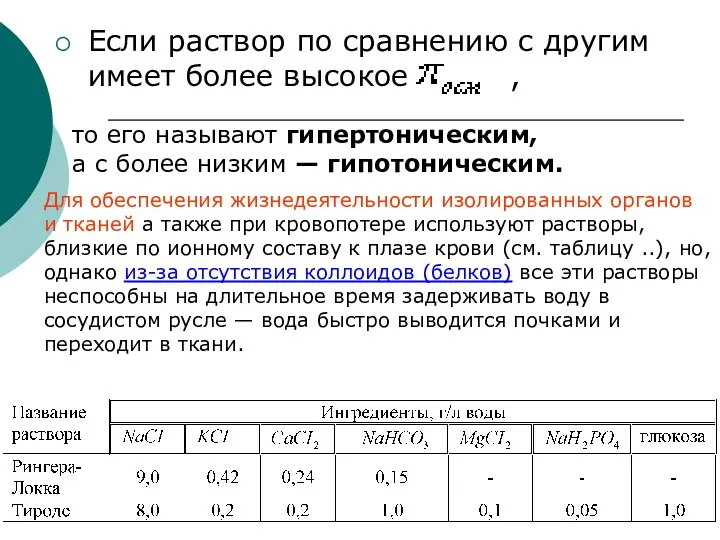
- 23. Гипо–, гипер– и изотонические растворы Если два раствора различных веществ обладают одинаковым (осмотическим давлением) при одинаковой
- 24. Если раствор по сравнению с другим имеет более высокое , то его называют гипертоническим, а с
- 25. Расчетные формулы. Вант Гофф предложил эмпирическое уравнение для расчета осмотического давления разбавленных растворов Где: См –
- 26. Осмотическое давление идеального раствора равно тому давлению, которое оказывало бы растворенное вещество, если бы при данной
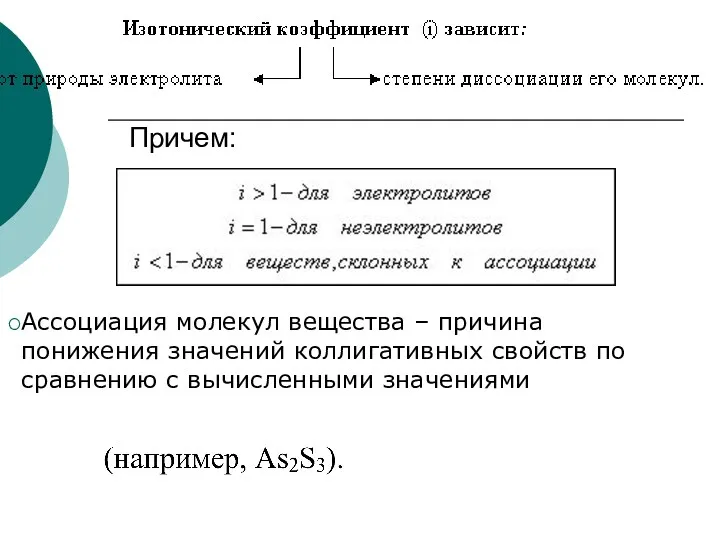
- 27. Поправочный (изотонический) коэффициент (i) Изотонический коэффициент показывает, во сколько раз возрастает концентрация ионов за счет диссоциации
- 28. Причем: Ассоциация молекул вещества – причина понижения значений коллигативных свойств по сравнению с вычисленными значениями
- 29. Значение его увеличивается по мере разбавления электролита, приближаясь к определенному пределу для каждого отдельного электролита. В
- 30. При вычислении степени диссоциации сильных электролитов говорят не об истинной, а о «кажущейся» степени диссоциации вещества
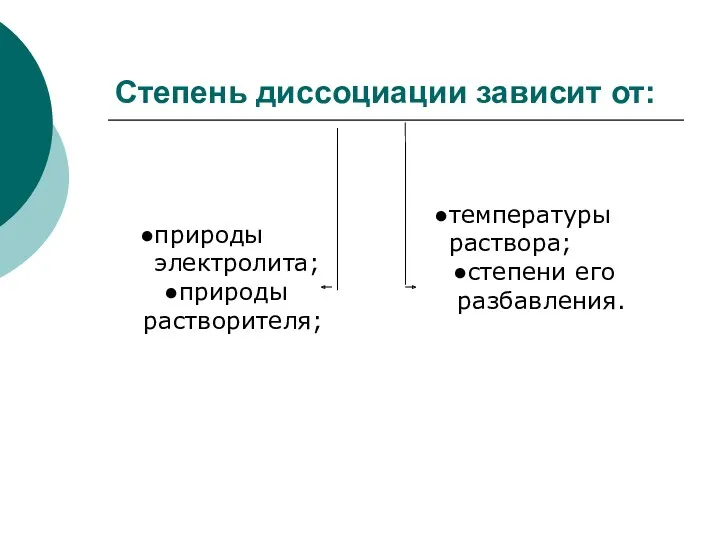
- 31. Степень диссоциации зависит от:
- 32. Осмолярная и осмоляльная концентрация Осмолярная концентрация раствора характеризует содержание подвижных частиц в миллиосмолях в 1 л
- 33. внутри и вне клетки одинаково, т.е. осмоляльность внутриклеточной жидкости равна осмоляльности плазмы крови. крови человека соответствует
- 34. Давление пара разбавленных растворов. Закон Рауля 2.1.Давление насыщенного пара растворителя Давление пара над раствором нелетучего вещества
- 35. Па.
- 36. - молярная доля растворенного вещества (Х), которая определяется по формуле:
- 37. Температура кипения и замерзания растворителя и раствора (II закон Рауля) Изучая кипение и замерзание растворов, Рауль
- 39. Постоянные константы и не зависят от природы растворенного вещества, а характеризуют лишь растворитель.
- 40. На измерениях температур кипения и замерзания основаны эбуллиоскопический и криоскопический методы определения молекулярных масс веществ:
- 41. Второй закон Рауля иногда называют следствием первого Ряд ученых подразделяют все закономерности, установленные Раулем на три
- 43. Скачать презентацию



































 Наноалмазы детонационного синтеза
Наноалмазы детонационного синтеза Сложные эфиры. Жиры
Сложные эфиры. Жиры Существенные изменения в измерителях ЕГЭ по химии
Существенные изменения в измерителях ЕГЭ по химии Чистые вещества и смеси
Чистые вещества и смеси Минералы и их свойства
Минералы и их свойства Химическая кинетика
Химическая кинетика Отчет о прохождении производственно-технологической практики
Отчет о прохождении производственно-технологической практики Оксиды. Химические свойства
Оксиды. Химические свойства Гидролиз неорганических веществ (теоретический материал для подготовки к ЕГЭ)
Гидролиз неорганических веществ (теоретический материал для подготовки к ЕГЭ) Алкины - непредельные углеводороды с общей формулой CnH2n+2
Алкины - непредельные углеводороды с общей формулой CnH2n+2 Основные сведения о строении атома
Основные сведения о строении атома Электронное строение атома
Электронное строение атома Геохимические барьеры
Геохимические барьеры Щелочные металлы. 9 класс
Щелочные металлы. 9 класс Алюминий и его соединения
Алюминий и его соединения Электролиз. Электролиз раствора и электролиз расплава электролита
Электролиз. Электролиз раствора и электролиз расплава электролита Значення хімії у житті людини
Значення хімії у житті людини Сталь, железо и чугун
Сталь, железо и чугун Синтетический каучук и его применение
Синтетический каучук и его применение Высокомолекулярные соединения. Общие понятия
Высокомолекулярные соединения. Общие понятия Многоатомные спирты
Многоатомные спирты III А – топтың элементтері
III А – топтың элементтері Химический анализ веществ
Химический анализ веществ Карбоновые кислоты и их функциональные производные. Хроматографические методы исследования
Карбоновые кислоты и их функциональные производные. Хроматографические методы исследования Inert metals
Inert metals Реакции ионного обмена
Реакции ионного обмена Состояние и свойства воды
Состояние и свойства воды Соли. Классификация. Физические и химические свойства. Получение и применение солей
Соли. Классификация. Физические и химические свойства. Получение и применение солей