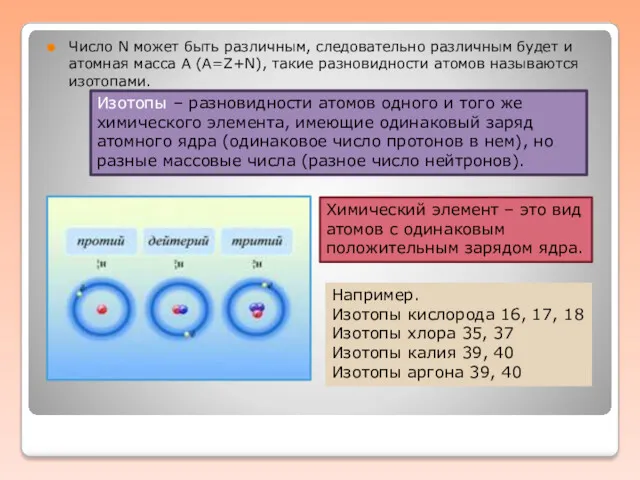
Число N может быть различным, следовательно различным будет и атомная масса
А (А=Z+N), такие разновидности атомов называются изотопами.
Изотопы – разновидности атомов одного и того же химического элемента, имеющие одинаковый заряд атомного ядра (одинаковое число протонов в нем), но разные массовые числа (разное число нейтронов).
Химический элемент – это вид атомов с одинаковым положительным зарядом ядра.
Например.
Изотопы кислорода 16, 17, 18
Изотопы хлора 35, 37
Изотопы калия 39, 40
Изотопы аргона 39, 40

 Оксид серы (IV). Сернистая кислота
Оксид серы (IV). Сернистая кислота Подготовка к ГИА. В2. Первоначальные сведения об органических веществах. Биологически важные вещества: белки, жиры, углеводы
Подготовка к ГИА. В2. Первоначальные сведения об органических веществах. Биологически важные вещества: белки, жиры, углеводы Строение атома. 10 ен
Строение атома. 10 ен Химия и повседневная жизнь человека
Химия и повседневная жизнь человека Ароматические кислоты и их соли
Ароматические кислоты и их соли Амины и их свойства
Амины и их свойства Кислородсодержащие соединения серы
Кислородсодержащие соединения серы Арены. Бензол. Урок химии. 10 класс
Арены. Бензол. Урок химии. 10 класс Газы, применяемые при сварке
Газы, применяемые при сварке Методы разделения и очистки биомолекул. Ультрацентрифугирование (седиментация)
Методы разделения и очистки биомолекул. Ультрацентрифугирование (седиментация) Алкадиены (диены, диеновые углеводороды)
Алкадиены (диены, диеновые углеводороды) Алюминий. Сплавы алюминия
Алюминий. Сплавы алюминия Полисахариды. Крахмал и целлюлоза
Полисахариды. Крахмал и целлюлоза Коррозия металлов
Коррозия металлов История мыловарения
История мыловарения Твердые вещества
Твердые вещества Влияние циклогексанола селективную очистку масляных фракций нефти N-метилпирролидоном (N-МП)
Влияние циклогексанола селективную очистку масляных фракций нефти N-метилпирролидоном (N-МП) Мыловарение. Мыло своими руками
Мыловарение. Мыло своими руками Азотная кислота и нитраты
Азотная кислота и нитраты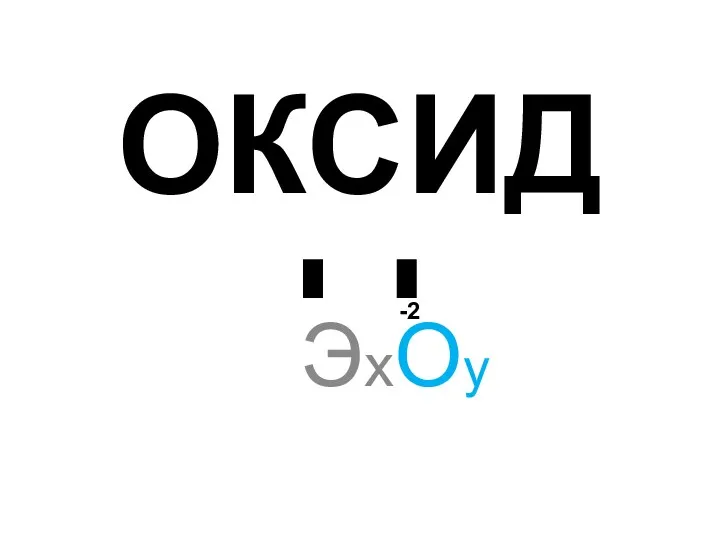 Химические свойства оксидов
Химические свойства оксидов Сулы ерітінділер. Тірі ағза сұйықтықтарындағы тепе-теңдік
Сулы ерітінділер. Тірі ағза сұйықтықтарындағы тепе-теңдік Жиры и масла
Жиры и масла Алкадиены. Строение алкадиенов
Алкадиены. Строение алкадиенов Експлуатаційні матеріали. Пальне для карбюраторних, дизельних двигунів. Змащувальні масла, пластичні мастила військової техніки
Експлуатаційні матеріали. Пальне для карбюраторних, дизельних двигунів. Змащувальні масла, пластичні мастила військової техніки Prezentatsia
Prezentatsia Геохимия стабильных изотопов, Радиоуглеродный метод
Геохимия стабильных изотопов, Радиоуглеродный метод Решение задач в химии (ОГЭ, ЕГЭ, Олимпиады)
Решение задач в химии (ОГЭ, ЕГЭ, Олимпиады) История открытия фосфора
История открытия фосфора