Содержание
- 2. Кто это?
- 3. Сейчас ясно?
- 4. Перед вами два оксида: Р2О5 и СаО. Где какой?
- 5. Как определить характер оксида? + +
- 6. Основные НемеО НемеО Кислоты Основания НО Кроме SiO2 Кислотные H2O 10 1 1 Как определить характер
- 7. кислотные
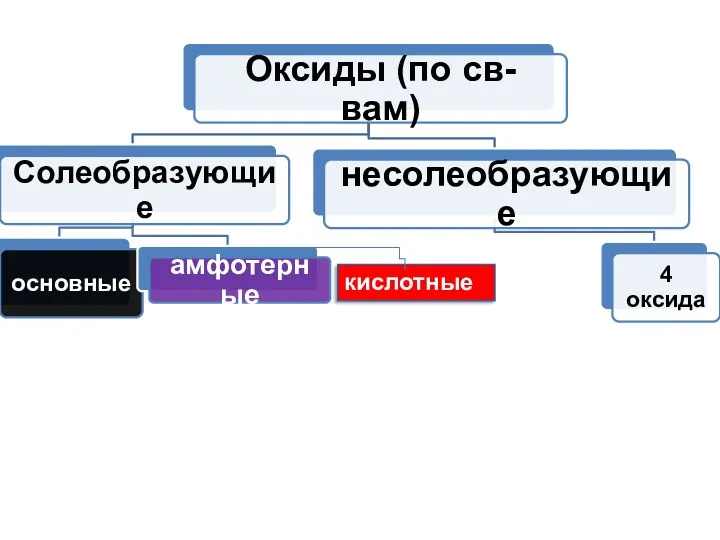
- 8. Классификация оксидов ЭхОу cтр.164-165,168-169
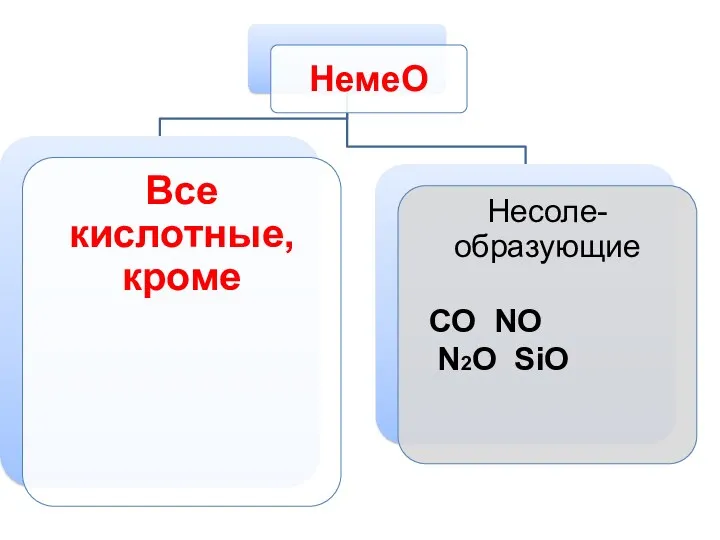
- 9. СО NO N2O SiO
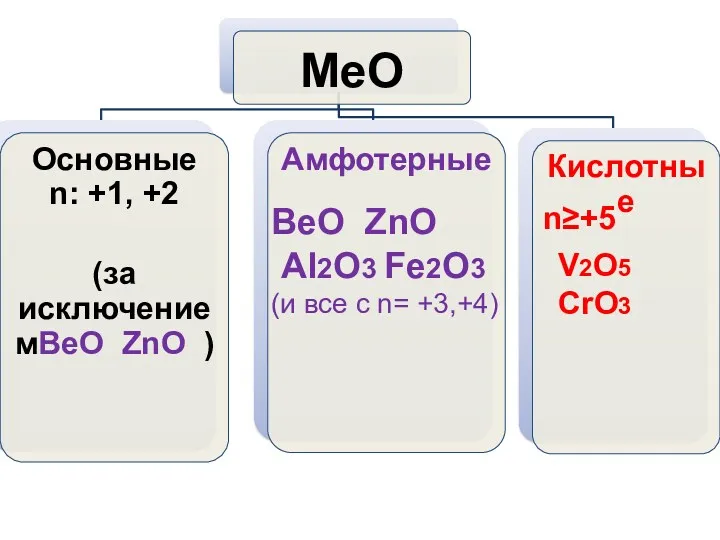
- 10. ВеО ZnO Al2O3 Fe2O3 (и все с n= +3,+4) n≥+5 V2O5 CrO3
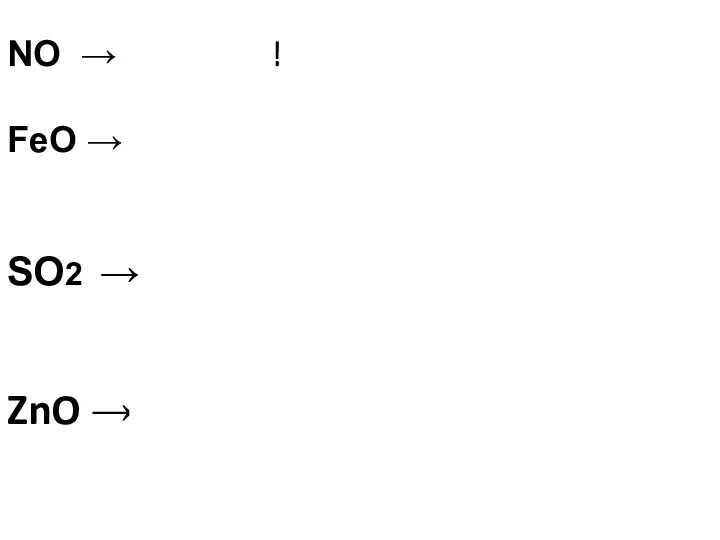
- 11. Определите характер свойств оксидов, составьте соответствующий гидроксид NO несолеобразующий FeO основный SO2 кислотный ZnO амфотерный
- 12. NO → ничего!!! FeO → Fe(OH)2 SO2 → Н2SO3 ZnO → и основание, и кислота Zn(OH)2
- 13. Д\з упр 1,2 стр 172 Проведите классификацию оксидов, составьте формулы соответствующих гидроксидов (посмотреть на стр.170-71) Стр.
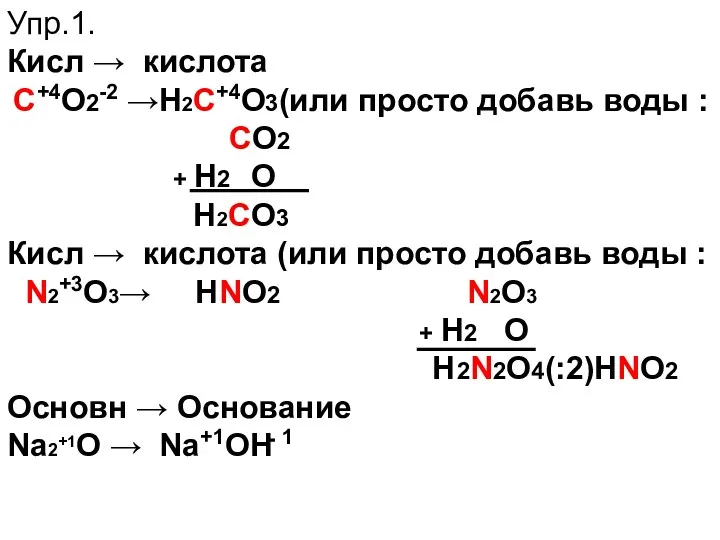
- 14. Упр.1. Кисл → кислота С+4O2-2 →Н2С+4О3(или просто добавь воды : СO2 + Н2 О Н2СО3 Кисл
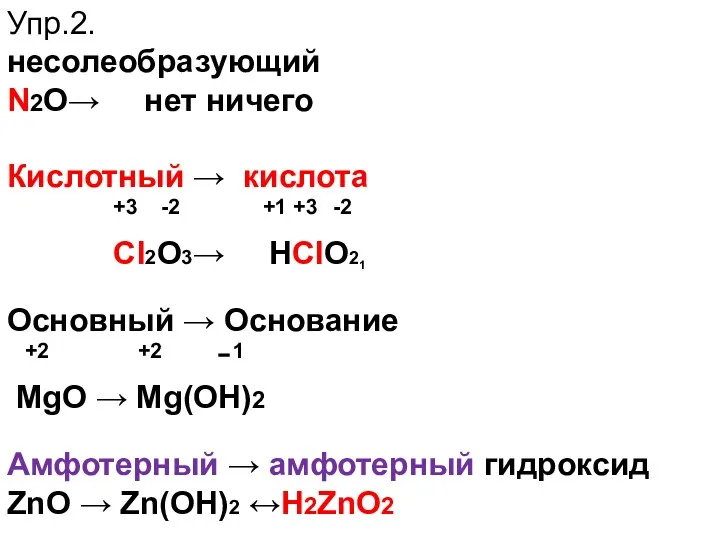
- 15. Упр.2. несолеобразующий N2О→ нет ничего Кислотный → кислота +3 -2 +1 +3 -2 Cl2O3→ НClО2 Основный
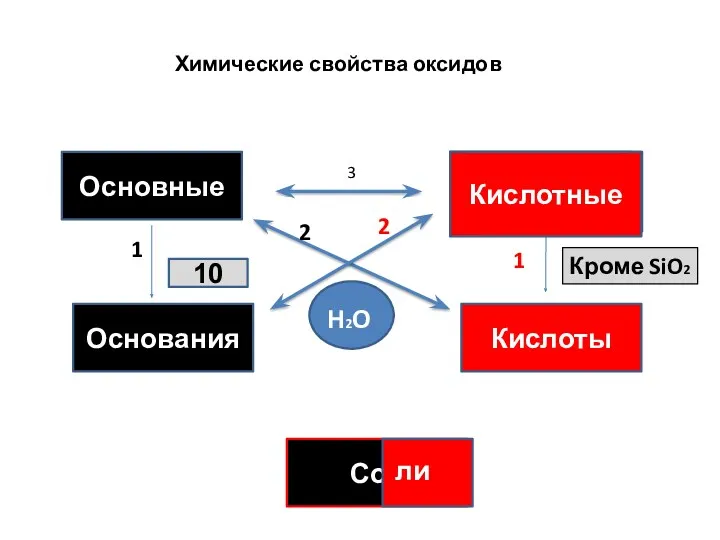
- 16. Химические свойства оксидов
- 18. Химические свойства оксидов Основные НемеО НемеО Кислоты Основания Сои ли НО Кроме SiO2 Кислотные H2O 10
- 20. Правило кота Матроскина Всё основное- на первое место. Всё кислое – на второе
- 21. Химические свойства оксидов Правило кота Матроскина!(всё чёрное пишем на первом месте, всё красное – на втором)
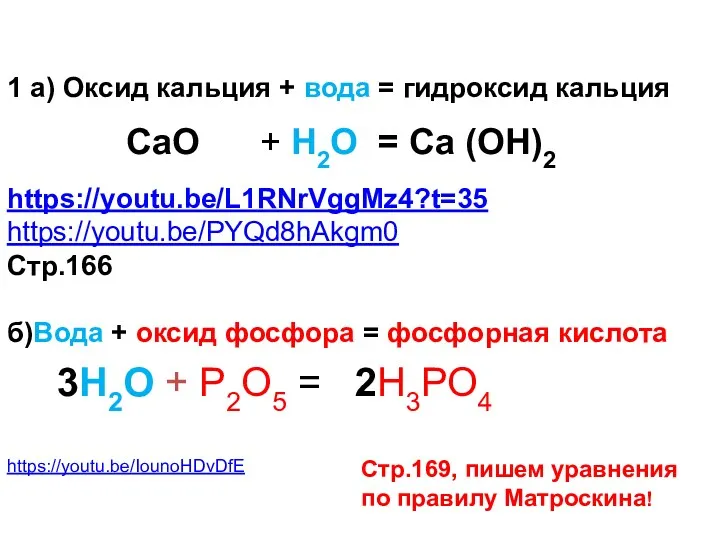
- 22. 1 а) Оксид кальция + вода = гидроксид кальция https://youtu.be/L1RNrVggMz4?t=35 https://youtu.be/PYQd8hAkgm0 Стр.166 б)Вода + оксид фосфора
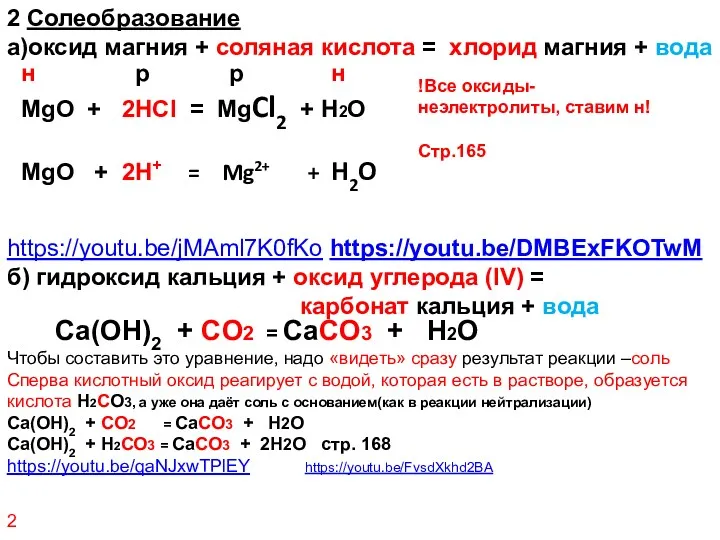
- 23. 2 Солеобразование а)оксид магния + соляная кислота = хлорид магния + вода https://youtu.be/jMAml7K0fKo https://youtu.be/DMBExFKOTwM б) гидроксид
- 24. 3 основный оксид + кислотный оксид = соль Оксид кальция + оксид азота (V) = нитрат
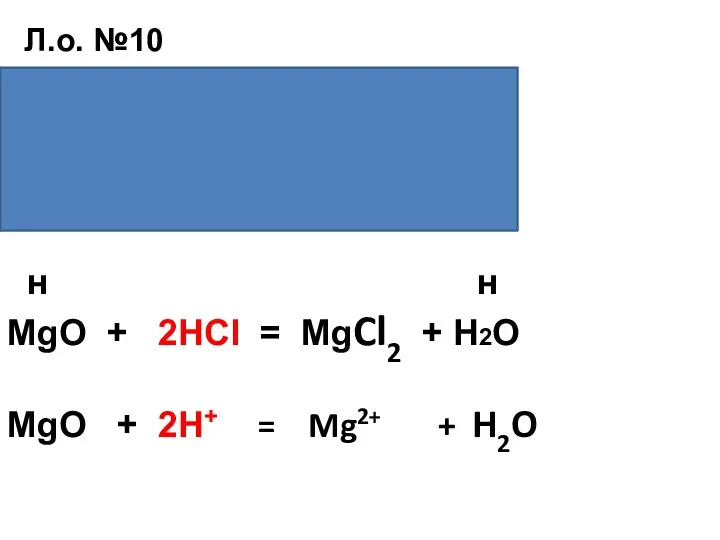
- 25. Д./з 1)Л.о. №10(составить уравнение взаимодействия оксида магния с серной кислотой, молекулярное и сокращённо-ионное).Реакция идёт, как с
- 26. Тестовые задания
- 27. Блок А. (7 вопросов) Выберите цифру верного ответа: А3 К основным оксидам относится: 1)ВеО 2)РbO2 3)NO
- 28. Блок В В1 Установите соответствие между формулой оксида и его химическими свойствами (характером)
- 29. Домашнее задание : Решения
- 30. Л.о. №10 н н MgO + H2SO4 = MgSO4 + H2O MgO + 2H+ = Mg2+
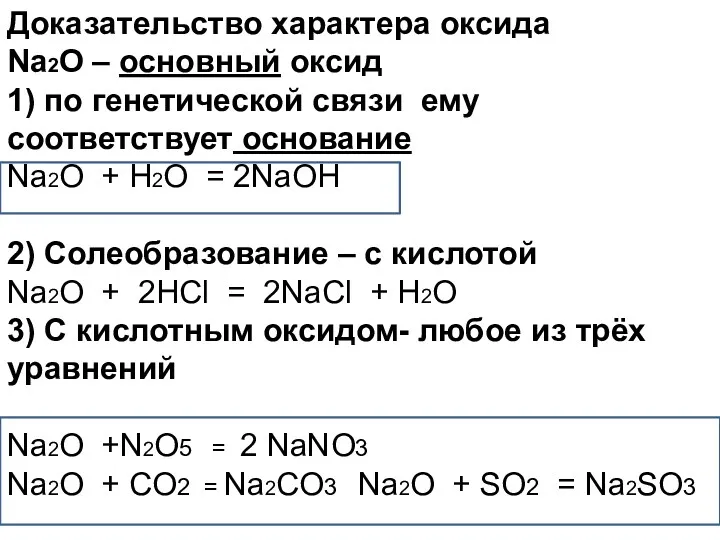
- 31. Доказательство характера оксида Na2O – основный оксид 1) по генетической связи ему соответствует основание Na2O +
- 33. Скачать презентацию



















 Формирование ключевых компетенций на уроках химии
Формирование ключевых компетенций на уроках химии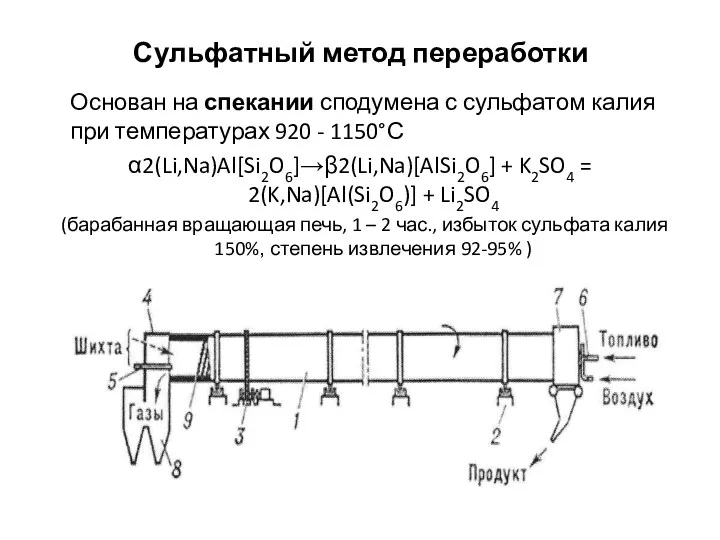 Сульфатный метод переработки
Сульфатный метод переработки Альтернативная бытовая химия
Альтернативная бытовая химия Теория строения органических веществ. Предельные углеводороды. 9 класс
Теория строения органических веществ. Предельные углеводороды. 9 класс Химическая промышленность и химические технологии
Химическая промышленность и химические технологии Кислород
Кислород Гидроксипроизводные углеводородов. Спирты. Фенолы
Гидроксипроизводные углеводородов. Спирты. Фенолы Функциональные производные с кратной связью C=“Э”. Часть 1. Карбонильные соединения и имины
Функциональные производные с кратной связью C=“Э”. Часть 1. Карбонильные соединения и имины Попутные нефтяные газы
Попутные нефтяные газы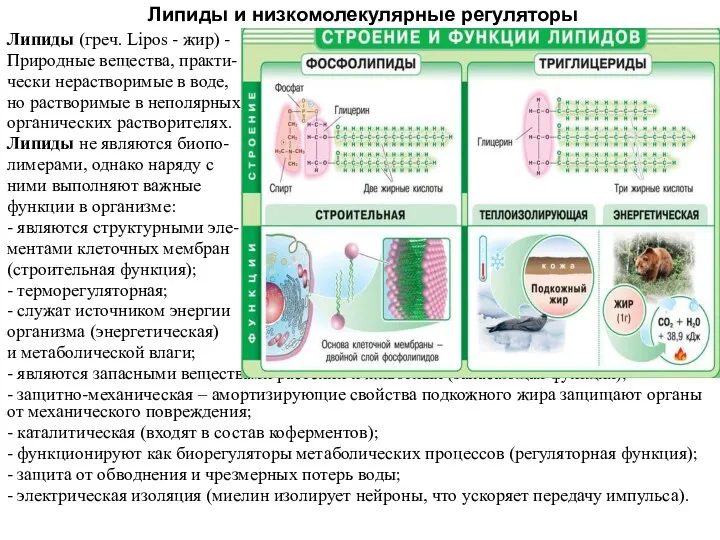 Липиды и низкомолекулярные регуляторы
Липиды и низкомолекулярные регуляторы Серная кислота и её свойства
Серная кислота и её свойства Чистые вещества и смеси. Способы разделения смесей
Чистые вещества и смеси. Способы разделения смесей Химический состав живого. Лекция 2
Химический состав живого. Лекция 2 Аммиак (9 класс)
Аммиак (9 класс) Cromatografia ionică
Cromatografia ionică Карбон қышқылдары, жіктелуі, сипаттамалары, таралуы
Карбон қышқылдары, жіктелуі, сипаттамалары, таралуы Марганец
Марганец Галогены. Фтор, хлор, бром, йод, астат
Галогены. Фтор, хлор, бром, йод, астат Законы химии
Законы химии Химиялық өнеркәсіп шикізаты . Шикізат көздері Химиялық өндірістегі энергия және энергия көздері
Химиялық өнеркәсіп шикізаты . Шикізат көздері Химиялық өндірістегі энергия және энергия көздері Применение закона действующих масс к окислительно-восстановительным равновесиям. (Лекция 6)
Применение закона действующих масс к окислительно-восстановительным равновесиям. (Лекция 6) Химический элемент. Электронное строение атома
Химический элемент. Электронное строение атома Задачи
Задачи МОЛЯРНЫЙ ОБЪЕМ Химия 8 класс
МОЛЯРНЫЙ ОБЪЕМ Химия 8 класс Химические свойства кислот
Химические свойства кислот Железо. Характеристика химического элемента железа по его положению в ПСХЭ и строению атома
Железо. Характеристика химического элемента железа по его положению в ПСХЭ и строению атома Кристалл. Основные законы кристаллографии
Кристалл. Основные законы кристаллографии Бензол. Физические и химические свойства
Бензол. Физические и химические свойства