Содержание
- 2. Гидролиз (от греческого hydro – вода; lysis – разложение) Гидролиз соли – это химическая реакция обменного
- 3. Гидролиз Неорганические вещества: а) Соли б) Карбиды металлов в) Гидриды металлов Органические вещества
- 4. Классификация солей cильные основания слабые основания Соль сильного основания и слабой кислоты Соль слабого основания и
- 5. Алгоритм написания уравнений реакций гидролиза: 1. Определяем тип гидролиза 2. Записываем сокращенное ионное и полное ионное
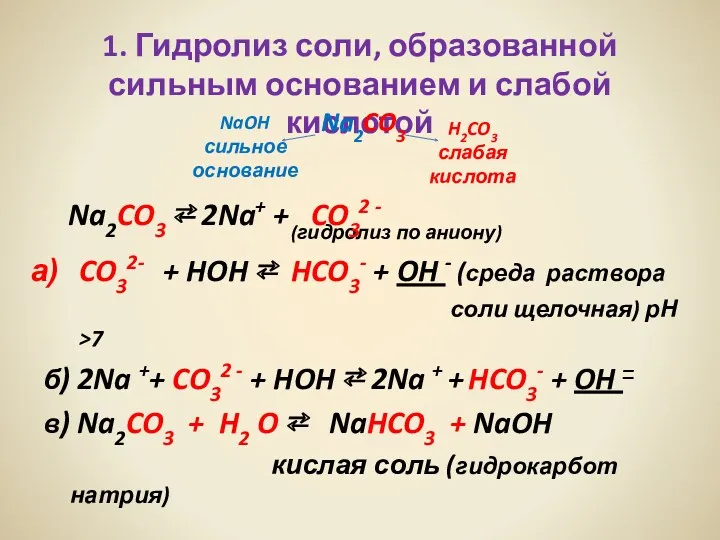
- 6. 1. Гидролиз соли, образованной сильным основанием и слабой кислотой Na2CO3 (гидролиз по аниону) CO32- - +
- 7. Гидролиз по аниону: Ann– + H-OH ⇄ HAn(n-1)– + OH–
- 8. 2. Гидролиз соли, образованной слабым основанием и сильной кислотой ZnSO4 Zn(ОН)2 слабое основание H2SO4 сильная кислота
- 9. Гидролиз по катиону: Men+ + H-OH ⇄ MeOH(n-1)+ + H+
- 10. 3. Гидролиз соли, образованной слабым основанием и слабой кислотой С водой взаимодействует как катион слабого основания,
- 11. 4. Соль, образованная сильным основанием и сильной кислотой В растворе нитрата калия КNO3 К+ – катион
- 12. Факторы, влияющие на степень гидролиза: гидролиз обратимая реакция, на состояние равновесия гидролиза влияют: концентрации участников реакции,
- 13. Гидролиз солей 3. 2. 1. № Реакция среды, pH Тип гидролиза Соли, образованные нейтральная среда (pH
- 14. Гидролиз солей 4. 3. 2. 1. № Реакция среды Тип гидролиза Соли, образованные ? гидролиз по
- 15. Готовимся к ЕГЭ 1. Установите соответствие: Формула соли Тип гидролиза 1. FeCl2 А. по катиону 2.
- 16. Готовимся к ЕГЭ 2. Установите соответствие: Формула соли Среда раствора 1. K2SO4 А. кислотная 2. Li2CO3
- 17. Готовимся к ЕГЭ 3. Установите соответствие: Формула соли Значение pH 1. K2SiO3 А. pH 2. LiNO3
- 18. Готовимся к ЕГЭ 4. Фенолфталеин можно использовать для обнаружения в водном растворе соли: 1) ацетата алюминия
- 19. Готовимся к ЕГЭ НАЗВАНИЕ СОЛИ А) гидрокарбонат калия Б) сульфат аммония В) нитрат натрия Г) ацетат
- 20. Гидролиз неорганических веществ CaC2 + 2H2O Ca(OH)2 + C2H2 Карбид кальция Al4C3 + 12 H2O 3CH4
- 22. Скачать презентацию


















 Химические свойства металлов
Химические свойства металлов Золото. Что о нём мы можем рассказать?
Золото. Что о нём мы можем рассказать? d-элементы
d-элементы Подготовка к ВПР по химии. 11 класс
Подготовка к ВПР по химии. 11 класс Метаболизм кетоновых тел. Метаболизм холестерина
Метаболизм кетоновых тел. Метаболизм холестерина Химический потенциал. Фазовые равновесия
Химический потенциал. Фазовые равновесия Кислотные дожди
Кислотные дожди The Molecules of Life
The Molecules of Life Цинк и его соединения
Цинк и его соединения Фосфор и его соединения
Фосфор и его соединения Химия воды
Химия воды Закономірності протікання хімічних реакцій
Закономірності протікання хімічних реакцій Классификация химических элементов
Классификация химических элементов Способы выражения состава раствора. Задача 7
Способы выражения состава раствора. Задача 7 НЮ 2.1.1. Металлы - общая характеристика
НЮ 2.1.1. Металлы - общая характеристика Гониометрическое исследование кристаллов
Гониометрическое исследование кристаллов Сплавы железа с углеродом: стали и чугуны
Сплавы железа с углеродом: стали и чугуны Багатоатомні насичені спирти. Фізичні та хімічні властивості. Добування і застосування
Багатоатомні насичені спирти. Фізичні та хімічні властивості. Добування і застосування Мінерали та гірські породи
Мінерали та гірські породи Серная кислота
Серная кислота Electrolysis
Electrolysis Вещества
Вещества Карбон қышқылдары, жіктелуі, сипаттамалары, таралуы
Карбон қышқылдары, жіктелуі, сипаттамалары, таралуы Аминокислоты 2
Аминокислоты 2 Метаболизм углеводов
Метаболизм углеводов Спектральные методы: атомная спектроскопия
Спектральные методы: атомная спектроскопия Валентность и степень окисления. Химическая связь
Валентность и степень окисления. Химическая связь Альдегіди. Карбонові кислоти. Одержання. Фізичні та хімічні властивості
Альдегіди. Карбонові кислоти. Одержання. Фізичні та хімічні властивості