Содержание
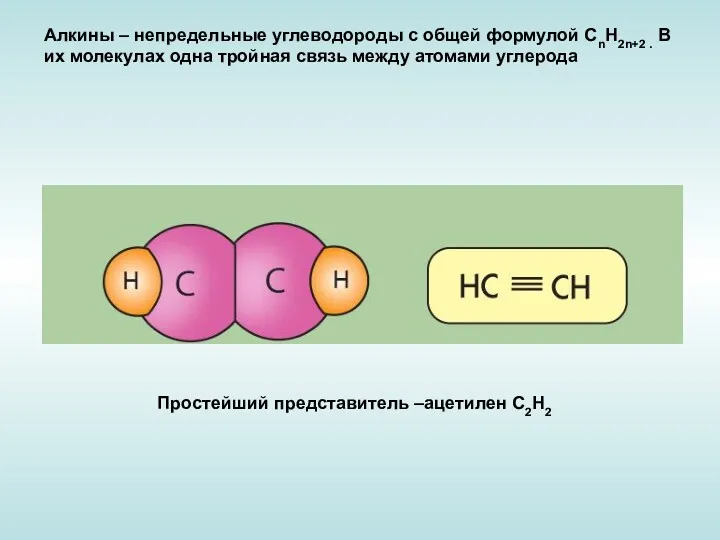
- 2. Алкины – непредельные углеводороды с общей формулой CnH2n+2 . В их молекулах одна тройная связь между
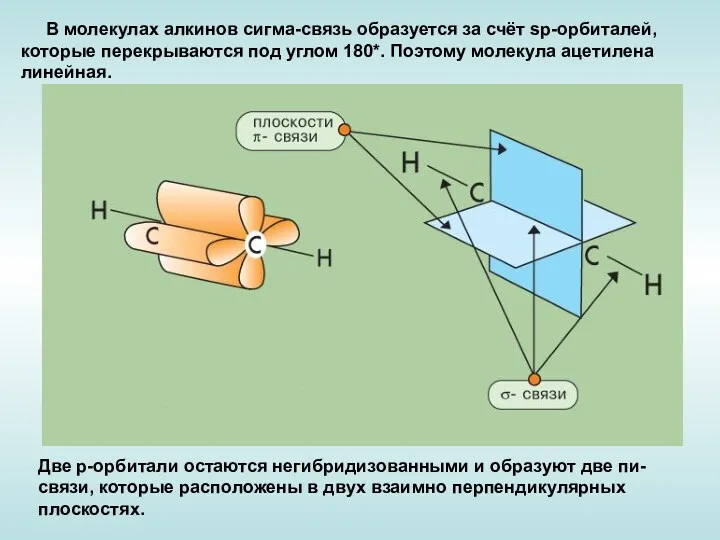
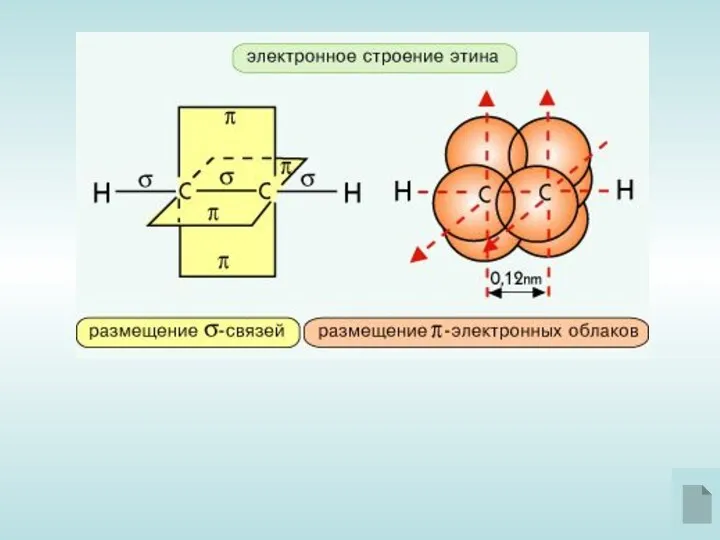
- 3. В молекулах алкинов сигма-связь образуется за счёт sp-орбиталей, которые перекрываются под углом 180*. Поэтому молекула ацетилена
- 5. Номенклатура По систематической номенклатуре названия ацетиленовых углеводородов производят от названий соответствующих алканов (с тем же числом
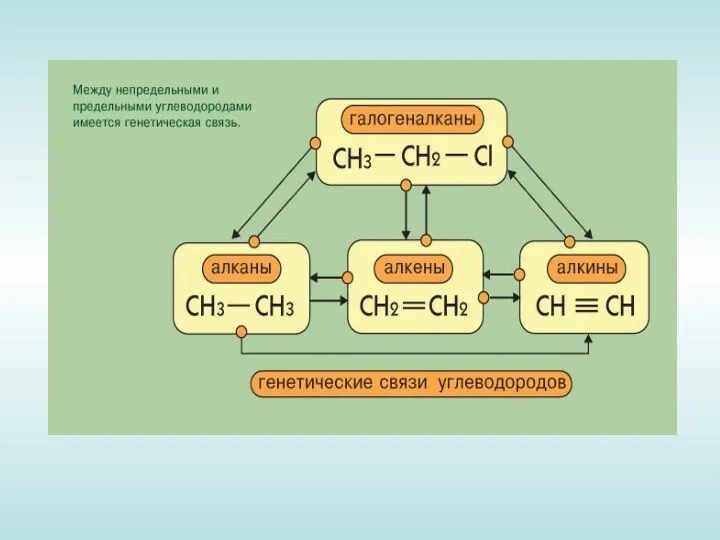
- 6. Изомерия алкинов Структурная изомерия 1. Изомерия положения тройной связи (начиная с С4Н6): СН ≡С−СН2−СН3 СН3−С≡С−СН3 бутин-1
- 7. Ацетилен получают в промышленности двумя способами: 1. Термический крекинг метана: 1500°С 2СН4 ⎯⎯→ С2Н2 + 3Н2
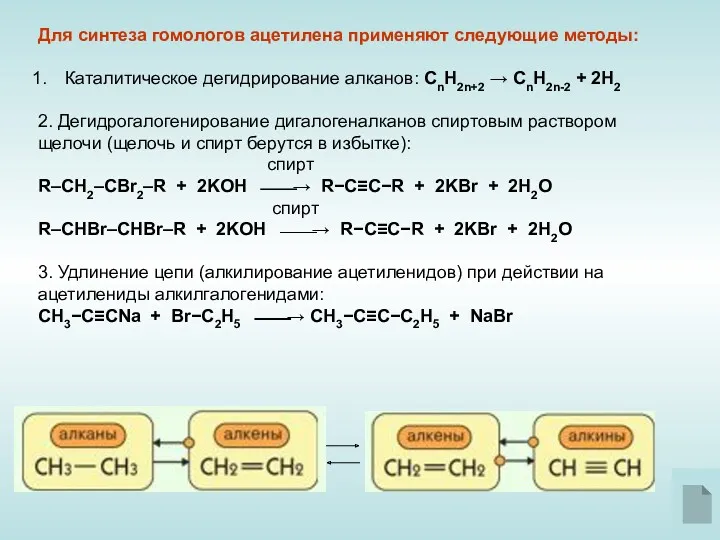
- 8. Для синтеза гомологов ацетилена применяют следующие методы: Каталитическое дегидрирование алканов: СnH2n+2 → CnH2n-2 + 2H2 2.
- 9. Физические свойства Температуры кипения и плавления ацетиленовых углеводородов увеличиваются с ростом их молекулярной массы. При обычных
- 10. Химические свойства Реакции присоединения Образование солей Окисление
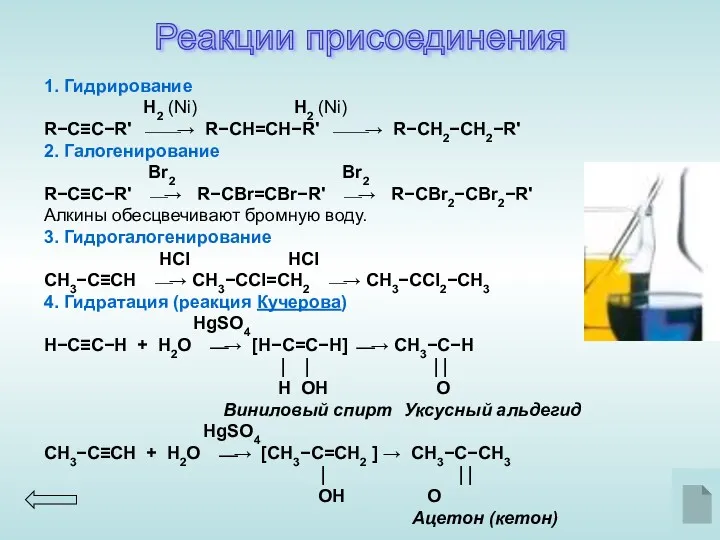
- 11. Реакции присоединения 1. Гидрирование H2 (Ni) H2 (Ni) R−C≡C−R' ⎯⎯→ R−CН=CН−R' ⎯⎯→ R−CН2−CН2−R' 2. Галогенирование Br2
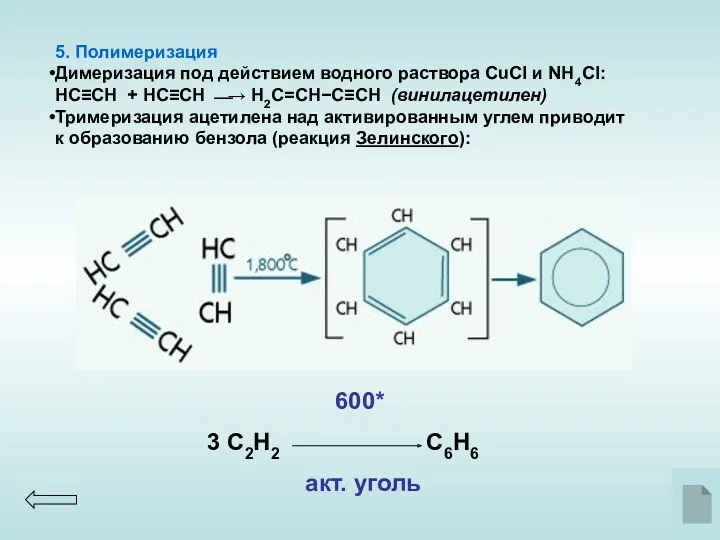
- 12. 5. Полимеризация Димеризация под действием водного раствора CuCl и NH4Cl: НC≡CH + НC≡CH ⎯→ Н2C=CH−C≡CH (винилацетилен)
- 13. Реакции окисления Ацетилен и его гомологи окисляются перманганатом калия с расщеплением тройной связи и образованием карбоновых
- 14. Образование солей Ацетилен и его гомологи с концевой тройной связью R−C≡C−H (алкины-1) вследствие полярности связи С(sp)−Н
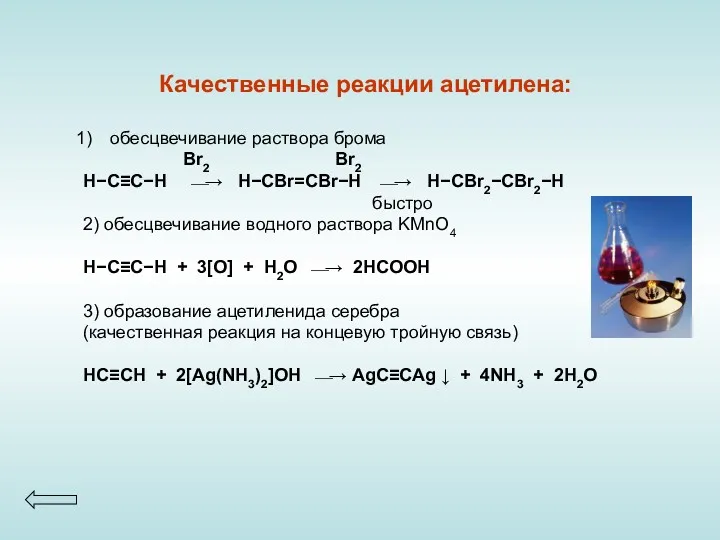
- 15. Качественные реакции ацетилена: обесцвечивание раствора брома Br2 Br2 H−C≡C−H ⎯→ H−CBr=CBr−H ⎯→ H−CBr2−CBr2−H быстро 2) обесцвечивание
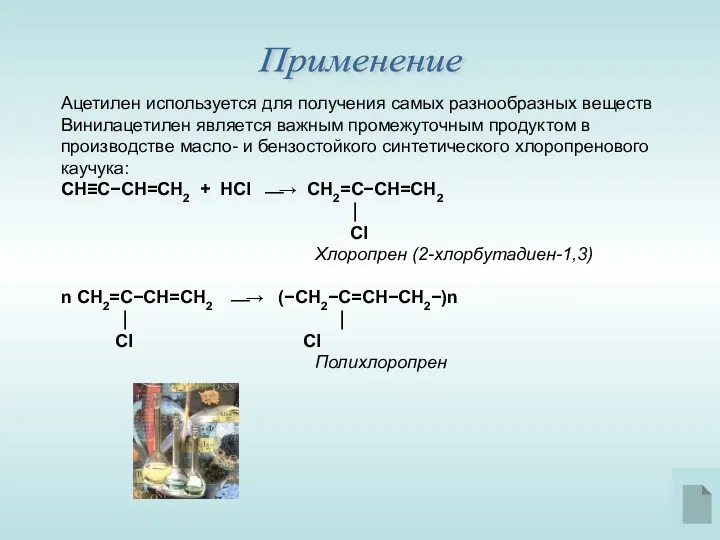
- 16. Ацетилен используется для получения самых разнообразных веществ Винилацетилен является важным промежуточным продуктом в производстве масло- и
- 18. Вопросы для контроля: 1. Какие вещества относят к алкинам? 2. Какие виды изомерии возможны у алкинов?
- 20. Скачать презентацию








 Чистые вещества и смеси
Чистые вещества и смеси Мыло и синтетические моющие средства
Мыло и синтетические моющие средства Материаловедение. Лекция 1
Материаловедение. Лекция 1 Залізо. Фізичні та хімічні властивості
Залізо. Фізичні та хімічні властивості Почему мыло пенится
Почему мыло пенится Алюминий
Алюминий Гидрогеохимия урана и тория
Гидрогеохимия урана и тория Природные источники углеводородов
Природные источники углеводородов Химические волокна (7 класс)
Химические волокна (7 класс) Аргентум, или серебро
Аргентум, или серебро Алкины. Физические и химические свойства
Алкины. Физические и химические свойства Спирты: общая характеристика
Спирты: общая характеристика Бескислородные керамические материалы
Бескислородные керамические материалы Химическая посуда и лабораторное оборудование
Химическая посуда и лабораторное оборудование Objectives and background. Apply for an unknown mixture
Objectives and background. Apply for an unknown mixture Процессы, проходящие в растворах (продолжение темы)
Процессы, проходящие в растворах (продолжение темы) The Molecules of Life
The Molecules of Life Зеленая химия полиуретанов: механизм, катализ, проблемы использования возобновляемого сырья
Зеленая химия полиуретанов: механизм, катализ, проблемы использования возобновляемого сырья Электродные процессы
Электродные процессы Физические и химические свойства алмаза. Алмазная промышленность в России
Физические и химические свойства алмаза. Алмазная промышленность в России Кислоты
Кислоты Вклад ученых-химиков в победу в Великой Отечественной войне
Вклад ученых-химиков в победу в Великой Отечественной войне Окислительно-восстановительные реакции
Окислительно-восстановительные реакции Основні класи неорганічних сполук
Основні класи неорганічних сполук Совершенствование урока химии в условиях ФГОС
Совершенствование урока химии в условиях ФГОС Игра Химические элементы (формулы и названия)
Игра Химические элементы (формулы и названия) Химическая кинетика и катализ
Химическая кинетика и катализ Органічні сполуки. 3D моделі органічних сполук
Органічні сполуки. 3D моделі органічних сполук