Содержание
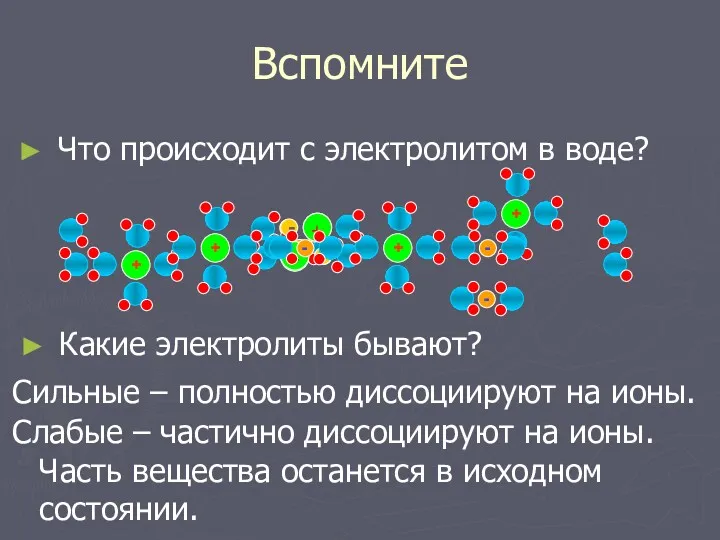
- 2. Вспомните Что происходит с электролитом в воде? - + - + Какие электролиты бывают? Сильные –
- 3. Реакции ионного обмена Реакции в которых вещества обмениваются составными частями – реакции обмена. Реакции обмена протекающие
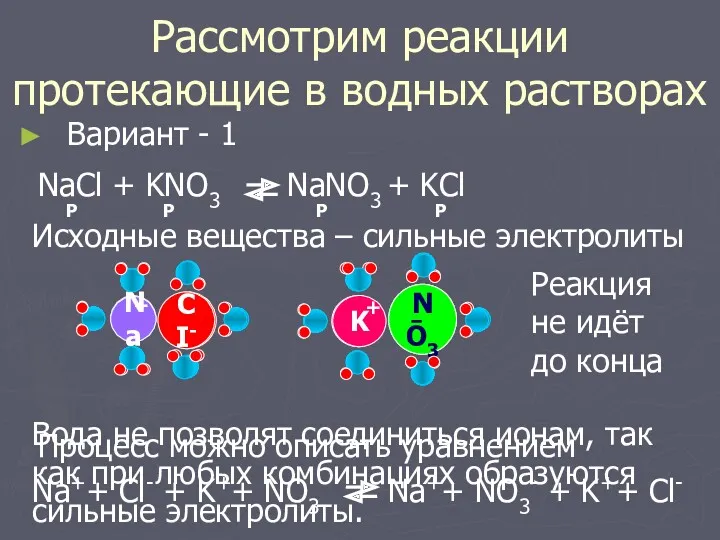
- 4. Рассмотрим реакции протекающие в водных растворах Вариант - 1 Na++ Cl- + K++ NO3- Na++ NO3-
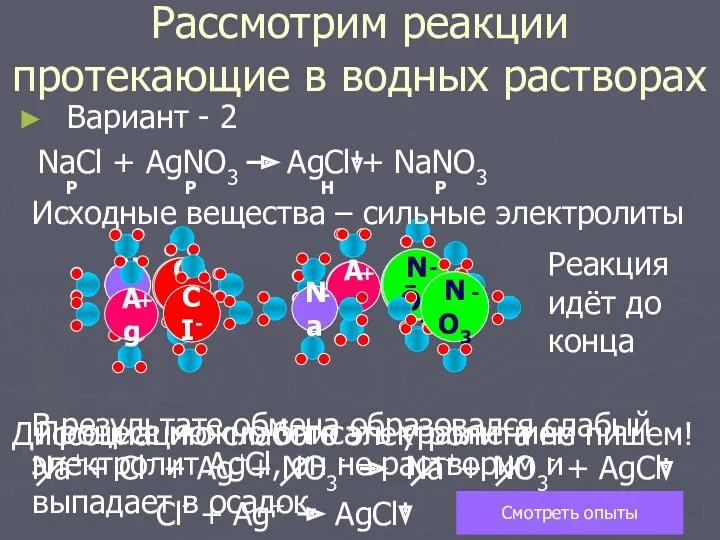
- 5. NO3 - Вариант - 2 NaCl + AgNO3 Р Р Na CI- Ag + + Исходные
- 6. ВЫВОД Реакции ионного обмена протекают до конца если происходит связывание ионов то есть образуется слабый электролит.
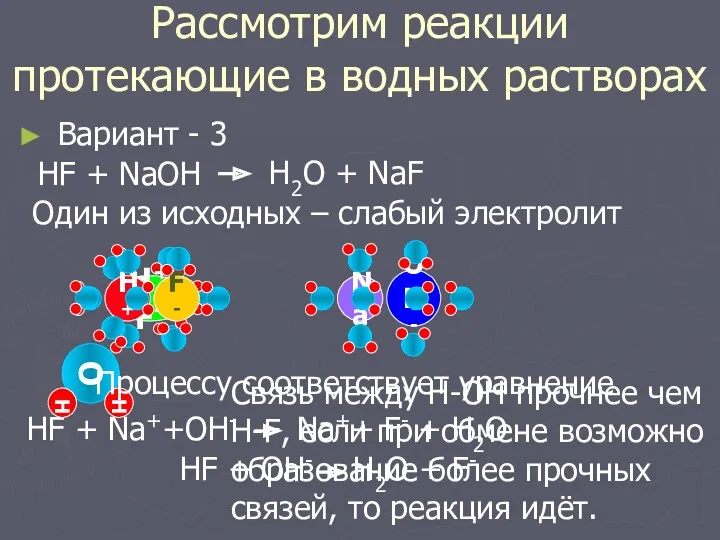
- 7. H+F- Вариант - 3 Рассмотрим реакции протекающие в водных растворах HF + NaOH Один из исходных
- 8. Реакции ионного обмена между сильным и слабым электролитом протекают до конца, если происходит более прочное связывание
- 9. Общий вывод Реакции ионного обмена протекают до конца, если происходит связывание ионов с выделением слабого электролита
- 10. План решения заданий Возможна ли реакция между НСl и CaCO3? Записываем реакцию, меняя в формулах кислотные
- 12. Скачать презентацию





 Общие вопросы аналитической химии. Химические методы обнаружения неорганических веществ
Общие вопросы аналитической химии. Химические методы обнаружения неорганических веществ Карбонильные соединения. Альдегиды и кетоны
Карбонильные соединения. Альдегиды и кетоны Гидролиз солей
Гидролиз солей Предмет и объекты исследования коллоидной химии. Лекция 01
Предмет и объекты исследования коллоидной химии. Лекция 01 Элементы химической термодинамики и биоэнергетики
Элементы химической термодинамики и биоэнергетики Идеал газ. Молекулалы-кинетикалық теорияның негізгі теңдеуі. Молекулалық орташа квадраттық жылдамдығына есептер шығару
Идеал газ. Молекулалы-кинетикалық теорияның негізгі теңдеуі. Молекулалық орташа квадраттық жылдамдығына есептер шығару Химические реакции органических соединений
Химические реакции органических соединений Фосфор
Фосфор Неметаллы. Элементы V группы
Неметаллы. Элементы V группы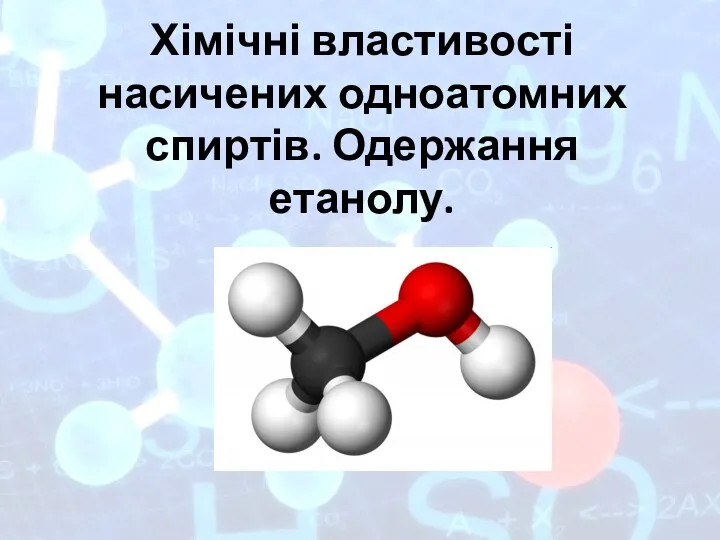 Хімічні властивості насичених одноатомних спиртів. Одержання етанолу
Хімічні властивості насичених одноатомних спиртів. Одержання етанолу Кислотность и основность рганических соединений. Инфракрасная спектроскопия
Кислотность и основность рганических соединений. Инфракрасная спектроскопия Гидроксикислоты (оксикислоты)
Гидроксикислоты (оксикислоты) Соли. Свойства солей
Соли. Свойства солей Назначение установки Пенекс
Назначение установки Пенекс Химические элементы. Строение вещества. Химическая связь
Химические элементы. Строение вещества. Химическая связь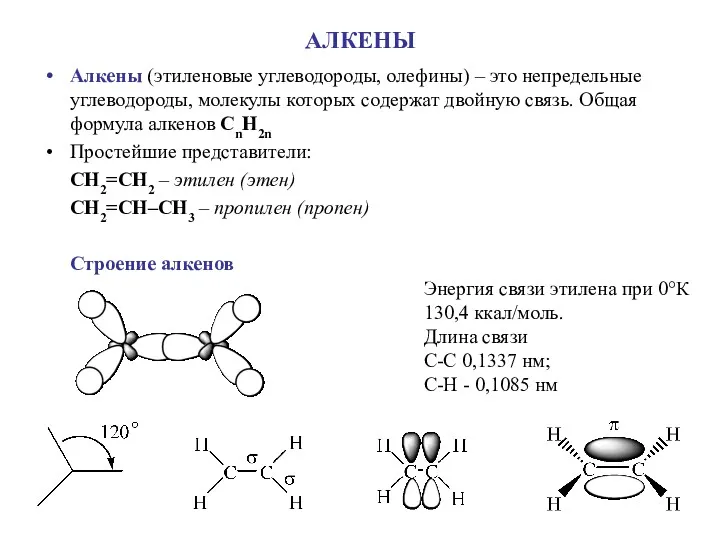 Алкены (этиленовые углеводороды, олефины)
Алкены (этиленовые углеводороды, олефины) Железо и его свойства
Железо и его свойства Чисті речовини та суміші. (7 клас)
Чисті речовини та суміші. (7 клас) Основные физико-химические свойства нефтей и нефтепродуктов
Основные физико-химические свойства нефтей и нефтепродуктов Зерттеу әдістері
Зерттеу әдістері Добування кисню в лабораторії та промисловості. Реакція розкладу. Поняття про каталізатор
Добування кисню в лабораторії та промисловості. Реакція розкладу. Поняття про каталізатор Главная подгруппа II группы
Главная подгруппа II группы драгоценные и поделочные
драгоценные и поделочные Химия титанорганических соединений
Химия титанорганических соединений Медициналық тәжірибедегі потенциометриялар
Медициналық тәжірибедегі потенциометриялар Кислотно-основное титрование
Кислотно-основное титрование Основания. Состав, классификация, свойства, получение
Основания. Состав, классификация, свойства, получение Спирты: классификация, изомерия, номенклатура
Спирты: классификация, изомерия, номенклатура