Узагальнення та систематизація знань
Дай відповіді на питання.
1. Які умови перебігу
реакцій є загальними для описаних лабораторних методів добування кисню?
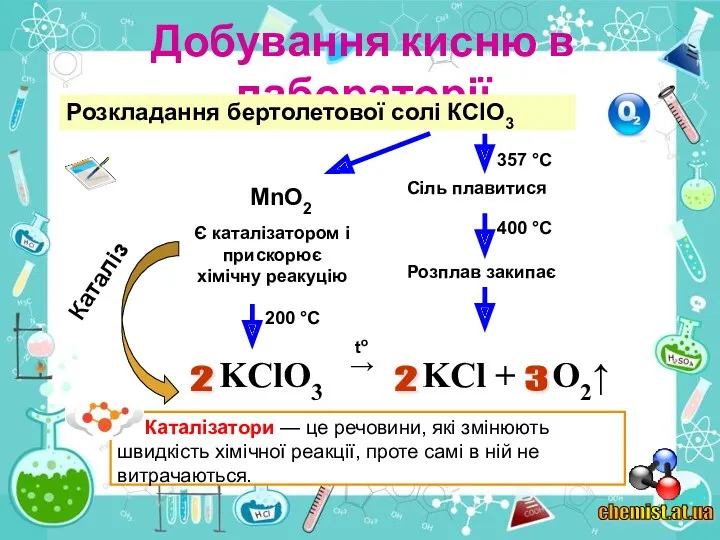
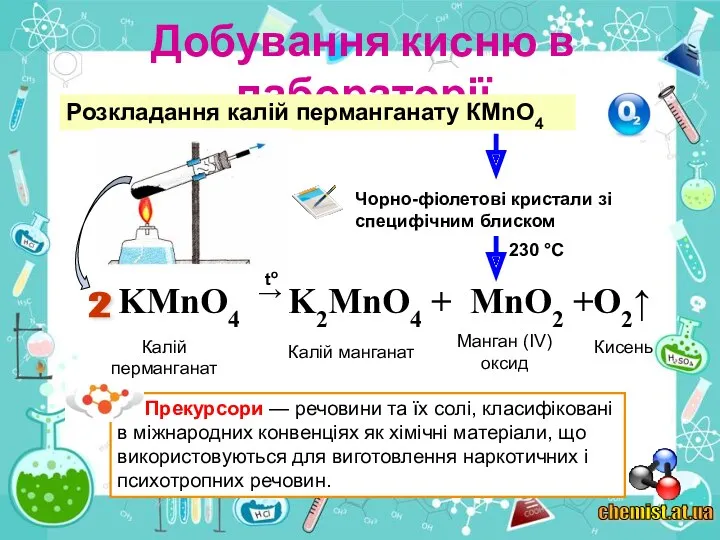
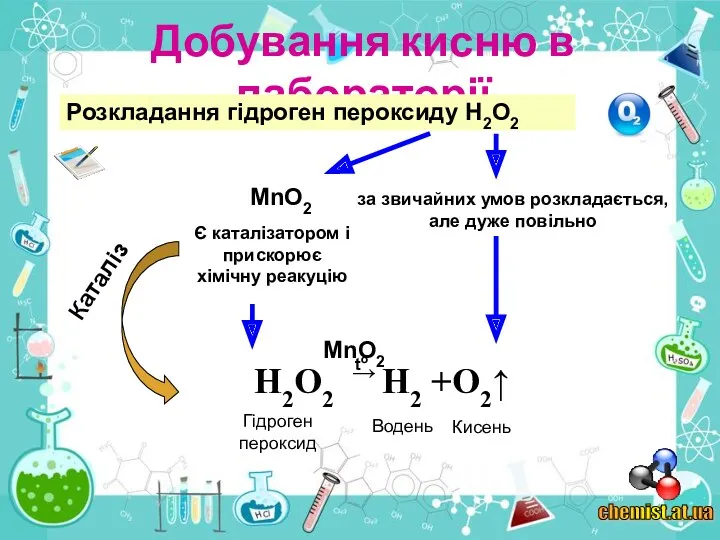
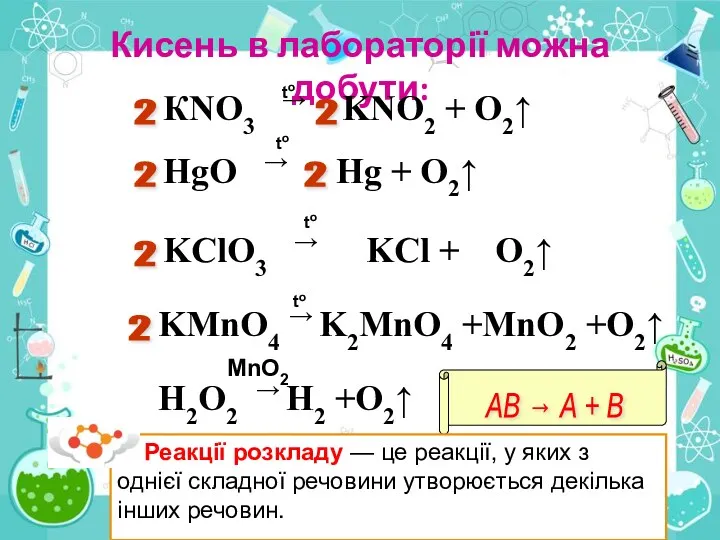
2. Виберіть речовини, розкладанням яких можна добути кисень: а) калій перманганат КМпО4; б) вуглекислий газ СО2; в) вода Н2О; г) манган(І\/) оксид МnO2.
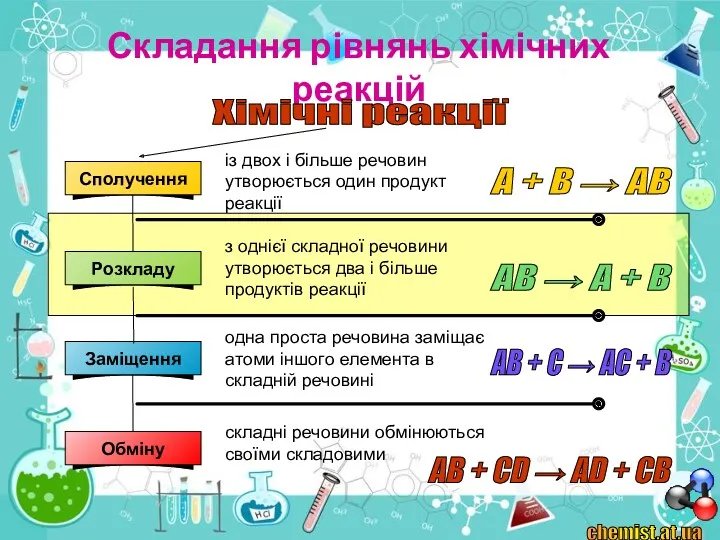
3. Які реакції називають реакціями розкладу?
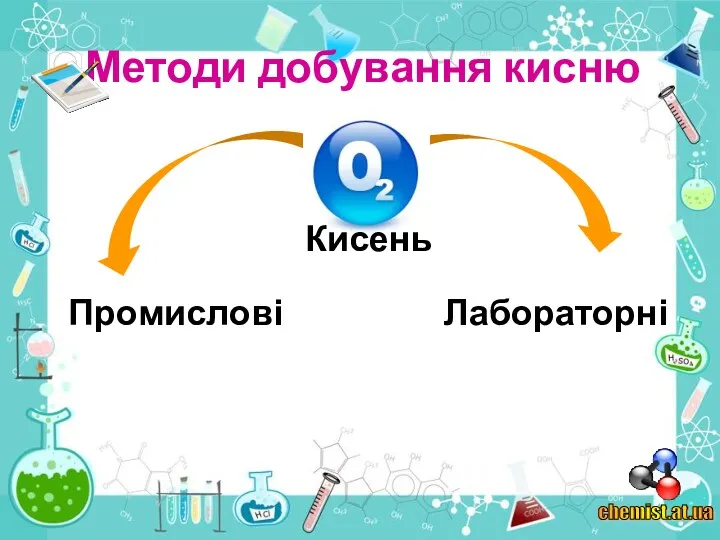
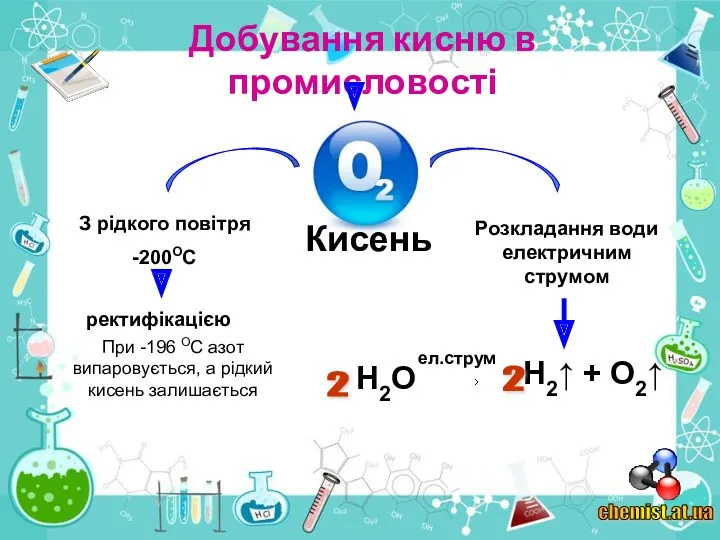
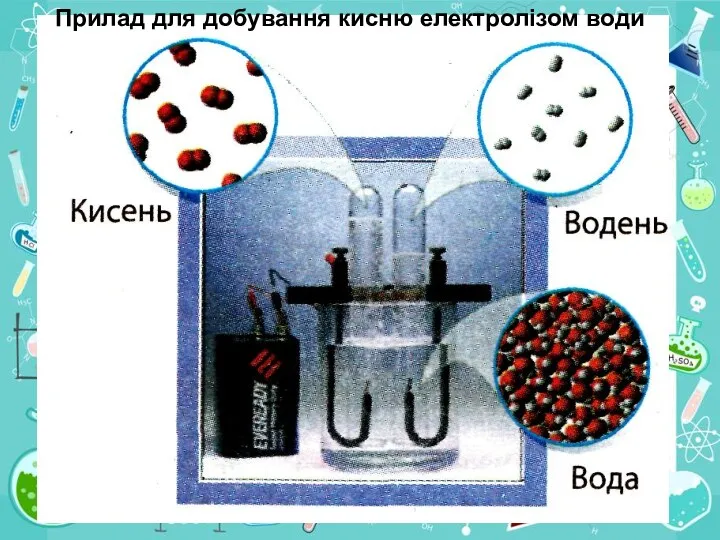
4. Як кисень добувають у промисловості?
5. Які речовини називаються каталізаторами? Чому каталізатори додають у невеликих кількостях?
6. Чим принципово відрізняються лабораторні та промислові способи добування кисню?
7 У яких посудинах зберігають газуватий і рідкий кисень?
8 Як відрізнити балон, у якому зберігається кисень? Чому не можна змащувати вентилі кисневих балонів мастилом?
chemist.at.ua




 Пестициды. Лекция
Пестициды. Лекция Хинолин. Строение хинолина
Хинолин. Строение хинолина Бор и его соединения
Бор и его соединения Адсорбция. Механизм адсорбции
Адсорбция. Механизм адсорбции Интеллектуальная игра Знатоки по химии
Интеллектуальная игра Знатоки по химии Твердые смазки
Твердые смазки Сплавы на основе железа. Диаграмма состояния сплавов системы железо–углерод. Лекция 2. Тема 4
Сплавы на основе железа. Диаграмма состояния сплавов системы железо–углерод. Лекция 2. Тема 4 Реконструкция установки получения элементарной серы
Реконструкция установки получения элементарной серы Нуклеофильное замещение галогена и других функциональных групп
Нуклеофильное замещение галогена и других функциональных групп Значення хімічних процесів у природі
Значення хімічних процесів у природі Извлечение из растворов экстракцией органическими растворителями
Извлечение из растворов экстракцией органическими растворителями Химия - Кормилица. 10 класс
Химия - Кормилица. 10 класс Гидролиз солей
Гидролиз солей Периодический закон и Периодическая система химических элементов Д.И. Менделеева
Периодический закон и Периодическая система химических элементов Д.И. Менделеева Kарбонові кислоти. Гетерофункціональні похідні карбонових кислот
Kарбонові кислоти. Гетерофункціональні похідні карбонових кислот Основные классы неорганических соединений. Тема 2
Основные классы неорганических соединений. Тема 2 Основания. Классификация оснований
Основания. Классификация оснований Основные классы неорганических соединений
Основные классы неорганических соединений Lesson 2 and 3. The chemistry of life
Lesson 2 and 3. The chemistry of life Каучук. Немного из истории
Каучук. Немного из истории Металлы побочных подгрупп
Металлы побочных подгрупп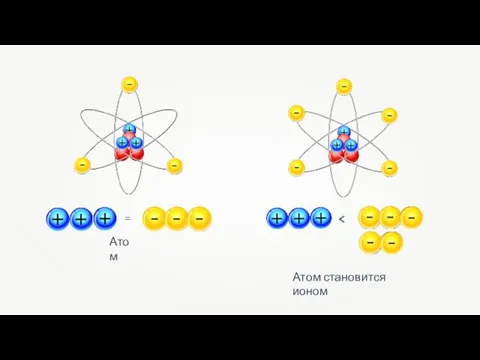 Ионная связь
Ионная связь Фазовые равновесия в системе ограниченно смешивающихся жидкостей
Фазовые равновесия в системе ограниченно смешивающихся жидкостей Тотығу-тотықсыздану реакциялары. Тотығу және тотықсыздану
Тотығу-тотықсыздану реакциялары. Тотығу және тотықсыздану Основные отличия химии органических производных элементов IV-Б группы от химии переходных элементов
Основные отличия химии органических производных элементов IV-Б группы от химии переходных элементов Химические свойства металлов
Химические свойства металлов Химические свойства солей
Химические свойства солей Лекция 1. Введение в биоорганическую химию
Лекция 1. Введение в биоорганическую химию