Содержание
- 2. Периодическая система химических элементов Д.И. Менделеева
- 3. Ионная связь Домашнее задание Читать п.56, вып.письм.2
- 4. Структура NaCl
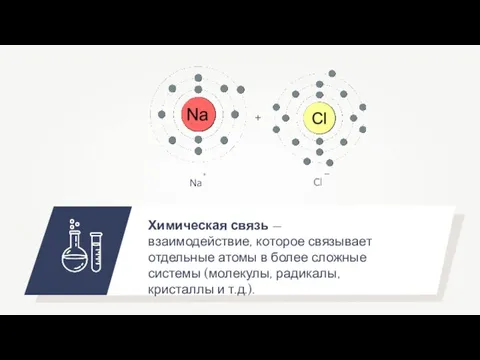
- 5. Химическая связь — взаимодействие, которое связывает отдельные атомы в более сложные системы (молекулы, радикалы, кристаллы и
- 6. Причина образования химической связи — стремление атомов посредством взаимодействия с другими атомами достичь более устойчивого состояния.
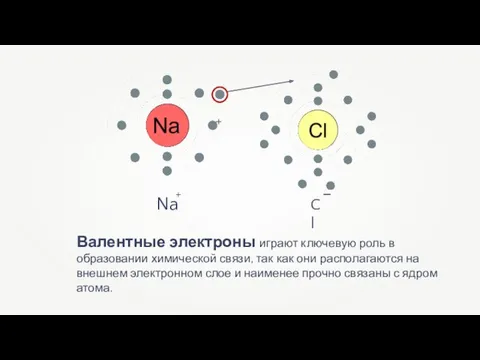
- 7. Валентные электроны играют ключевую роль в образовании химической связи, так как они располагаются на внешнем электронном
- 8. На внешнем энергетическом уровне у атома может находиться от одного до восьми электронов.
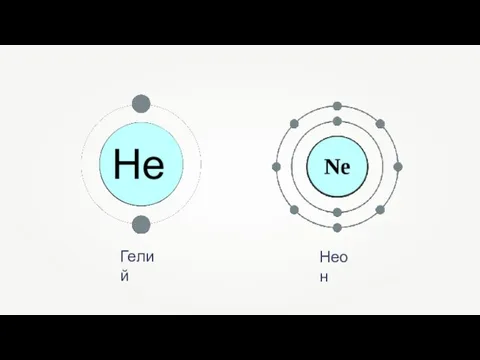
- 9. Гелий Неон
- 10. Внешние энергетические уровни всех атомов (кроме атомов благородных газов) являются незавершёнными, поэтому атомы вступают в химические
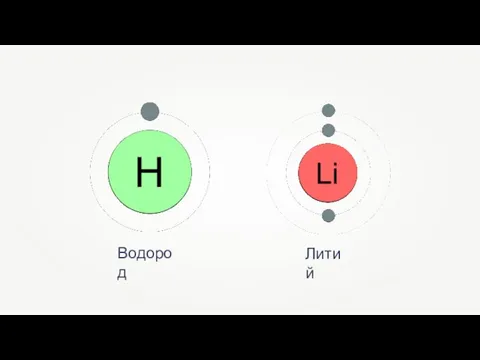
- 11. Водород Литий
- 12. Обобществление электронов — совместное пользование атомами одной и той же электронной пары. H Cl
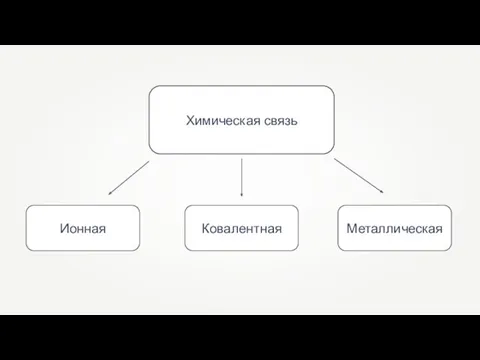
- 13. Химическая связь
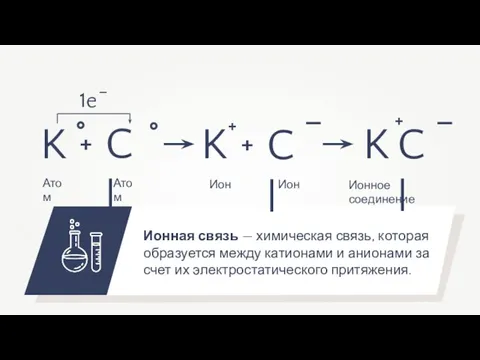
- 14. Ионная связь — химическая связь, которая образуется между катионами и анионами за счет их электростатического притяжения.
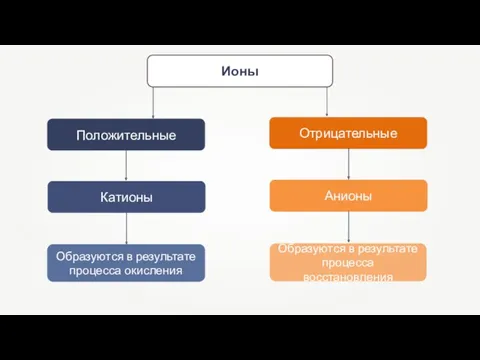
- 15. Положительные Отрицательные Катионы Анионы Ионы Образуются в результате процесса окисления Образуются в результате процесса восстановления
- 16. Как правило, ионная связь возникает между атомами типичных металлов и типичных неметаллов. K + Cl K
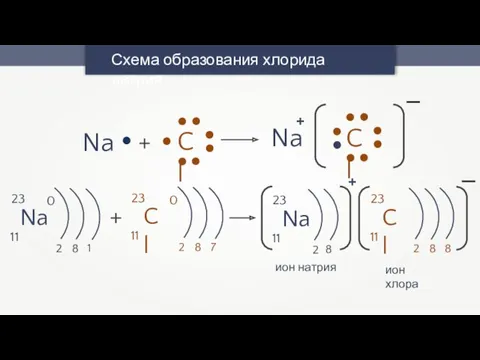
- 17. Схема образования хлорида натрия Na + Cl Na + Cl - 0 11 23 + 0
- 18. Силы электростатического взаимодействия ионных соединений направлены от иона во все стороны, т.е. каждый ион способен притягивать
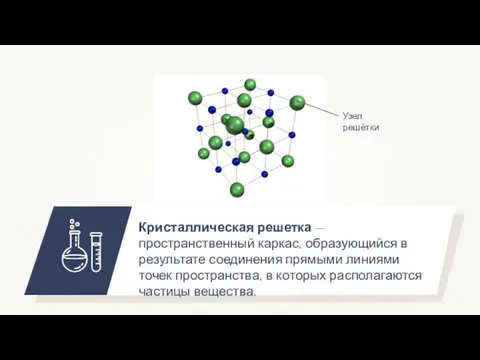
- 19. Кристаллическая решетка — пространственный каркас, образующийся в результате соединения прямыми линиями точек пространства, в которых располагаются
- 20. Кристаллическая ионная решётка
- 21. Физические свойства ионных веществ — твёрдые; — нелетучие; — имеют высокие температуры плавления и кипения; —
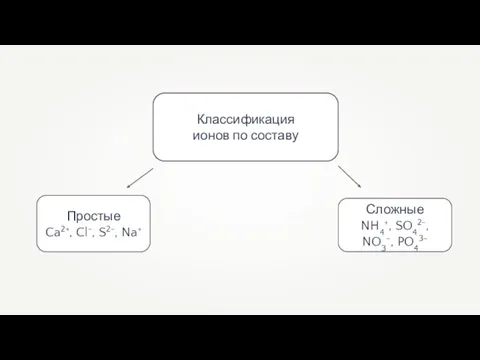
- 22. Классификация ионов по составу
- 25. Скачать презентацию












 Хімічні властивості металів
Хімічні властивості металів Карбоновые кислоты. Тест
Карбоновые кислоты. Тест Материаловедение. Основные задачи материаловедения
Материаловедение. Основные задачи материаловедения Электролитическая диссоциация. Вещества в растворах
Электролитическая диссоциация. Вещества в растворах Общая электронная теория восстановления и окисления металлов
Общая электронная теория восстановления и окисления металлов Фосфор. Урок в 9 классе
Фосфор. Урок в 9 классе Химические свойства кислот
Химические свойства кислот Кристаллические решетки
Кристаллические решетки Пробоотбор других ООС. Лекция 3
Пробоотбор других ООС. Лекция 3 Дисперсные системы в атмосфере
Дисперсные системы в атмосфере Хром. Физические и химические свойства
Хром. Физические и химические свойства Титан және оның қорытпалары. Титанның физика-химиялық қасиеттері
Титан және оның қорытпалары. Титанның физика-химиялық қасиеттері Химический факультет
Химический факультет Химия как компонент системы естественнонаучного образования
Химия как компонент системы естественнонаучного образования Cromatografia ionică
Cromatografia ionică Основні класи неорганічних сполук
Основні класи неорганічних сполук Алюминий и сплавы на его основе
Алюминий и сплавы на его основе Комплексообразователь. (Лекция 5)
Комплексообразователь. (Лекция 5) Как и где используется соляная кислота
Как и где используется соляная кислота Электрохимические процессы
Электрохимические процессы Кислород. Атом кислорода
Кислород. Атом кислорода Тепловой эффект химических реакций. 8 класс
Тепловой эффект химических реакций. 8 класс Классификация и общая характеристика механизмов образования свободных радикалов и активных форм кислорода
Классификация и общая характеристика механизмов образования свободных радикалов и активных форм кислорода Гранулометрический состав горных пород
Гранулометрический состав горных пород Дезодоранты. Антиперспиранты
Дезодоранты. Антиперспиранты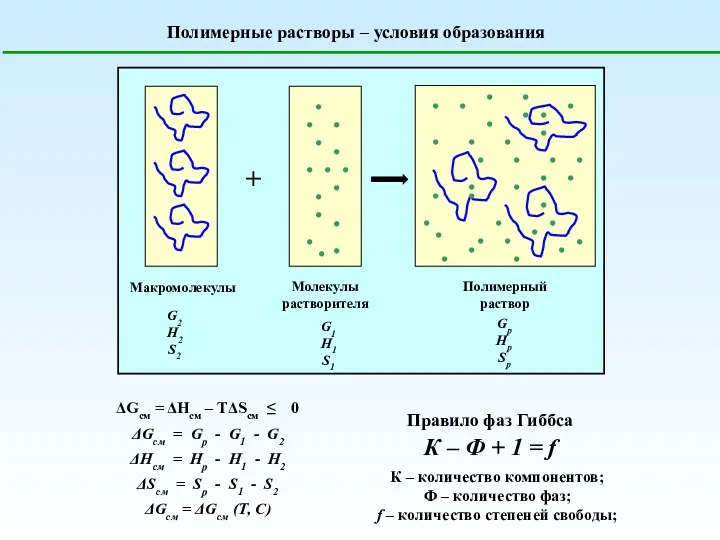 Полимерные растворы. Условия образования
Полимерные растворы. Условия образования Химиялық тепе-теңдік
Химиялық тепе-теңдік Неметаллы. Общая характеристика неметаллов
Неметаллы. Общая характеристика неметаллов