Содержание
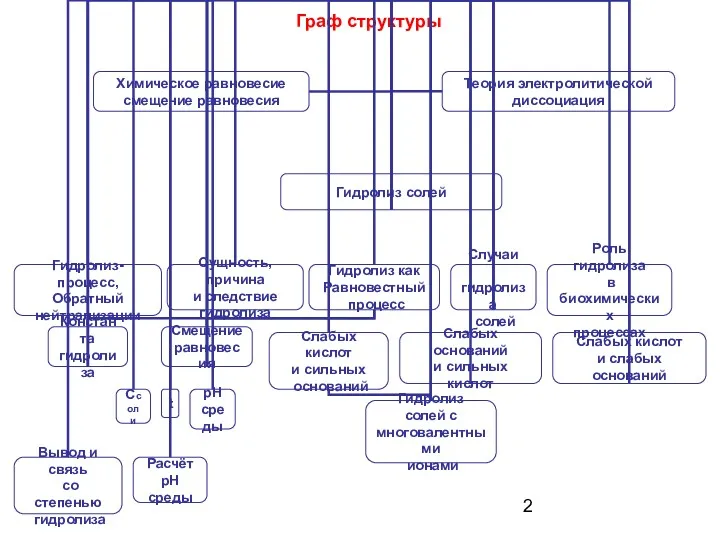
- 2. Граф структуры
- 3. Гидролиз солей - процесс взаимодействия ионов соли с составными частями воды (Н+ и ОН–). Причина-образование малодиссоциированных
- 4. Гидролиз – процесс: обратимый ( ↔ ) ступенчатый эндотермический (-Q), так как обратен реакции нейтрализации. Гидролиз
- 5. К сильным электролитам относятся: 1. Кислоты - НСI , НВг , HI , H2SО4 , H2S2O7
- 6. 1)BaCl2, 2)Sr(NO3)2, 3)K3PO4, 4)Sr(NO2)2, 5)CaI2, 6)NH4Br, 7)Na2SO3, 8)KNO2, 9)CsCl, 10)Na2SO4, 11)RbNO3, 12)KHCOO, 13)K2CO3, 14)Na2SO3, 15)CuCl2, 16)NH4NO3,
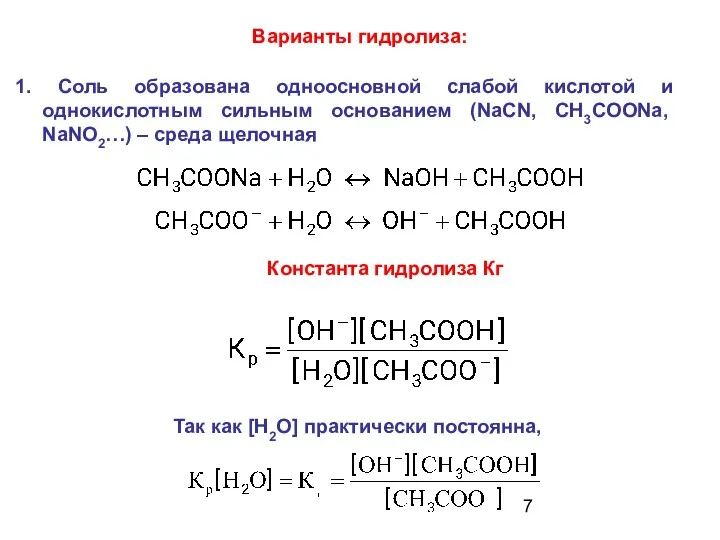
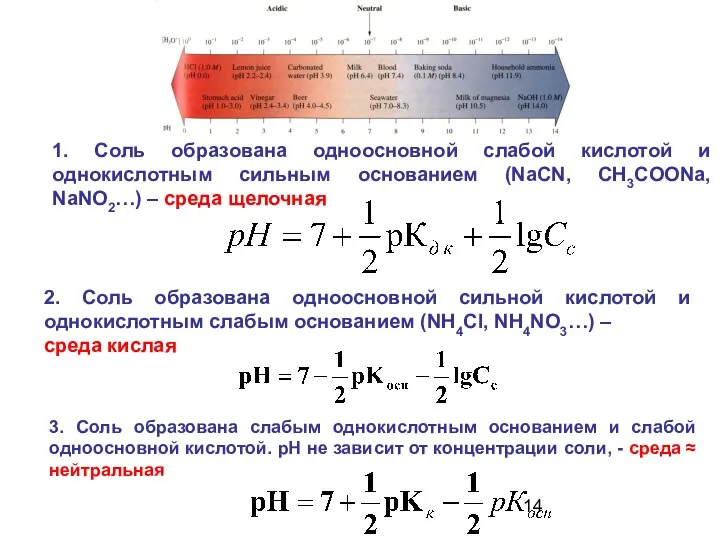
- 7. 1. Соль образована одноосновной слабой кислотой и однокислотным сильным основанием (NaСN, CH3COONa, NaNO2…) – среда щелочная
- 8. Домножим числитель и знаменатель на [H+]: Значение Кг показывает, что в момент равновесия произведение концентраций исходных
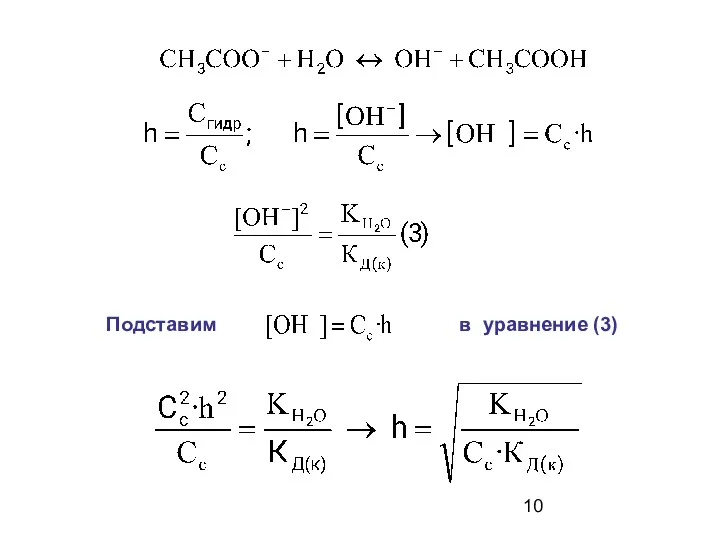
- 9. Приравнивая формулы (1) и (2), получим: [OH-]=[CH3COOH] Вывод степени гидролиза h
- 10. Подставим в уравнение (3)
- 11. Вывод формулы для расчёта pH CH3COONa ( рН>7 )
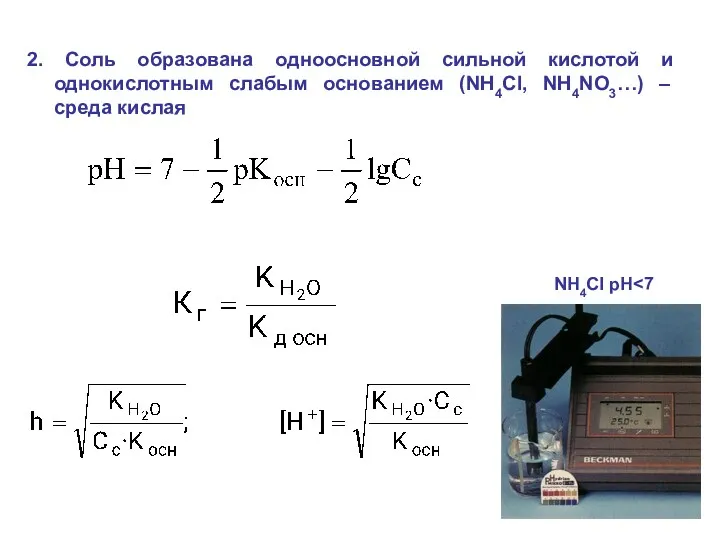
- 12. 2. Соль образована одноосновной сильной кислотой и однокислотным слабым основанием (NH4Cl, NH4NO3…) – среда кислая NH4Cl
- 13. 3. Соль образована слабым однокислотным основанием и слабой одноосновной кислотой (NH4CN, CH3COONH4…) – среда ≈ нейтральная
- 14. Общий взгляд: 1. Соль образована одноосновной слабой кислотой и однокислотным сильным основанием (NaСN, CH3COONa, NaNO2…) –
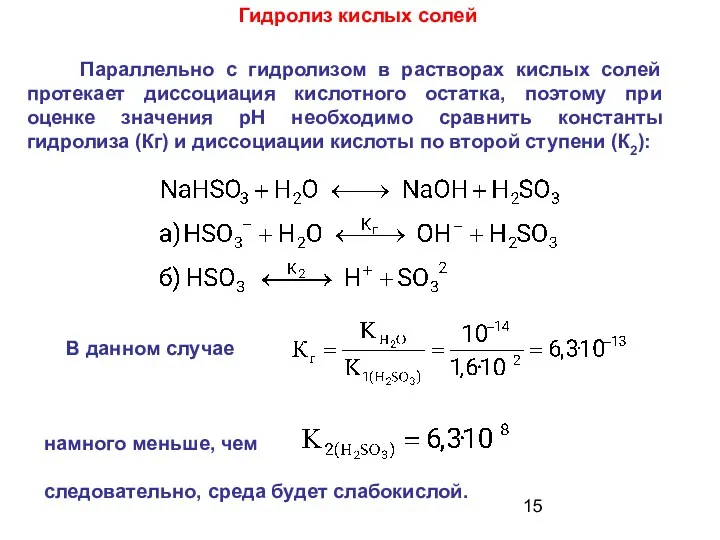
- 15. В данном случае намного меньше, чем следовательно, среда будет слабокислой. Параллельно с гидролизом в растворах кислых
- 16. Расчет степени гидролиза концентрации ионов водорода и рН среды для кислых солей Раствор питьевой соды NaHSO3
- 17. Растворы кислых солей фосфорной кислоты имеют различный характер среды: Na2HPO4 - щелочная NaH2PO4 – кислая
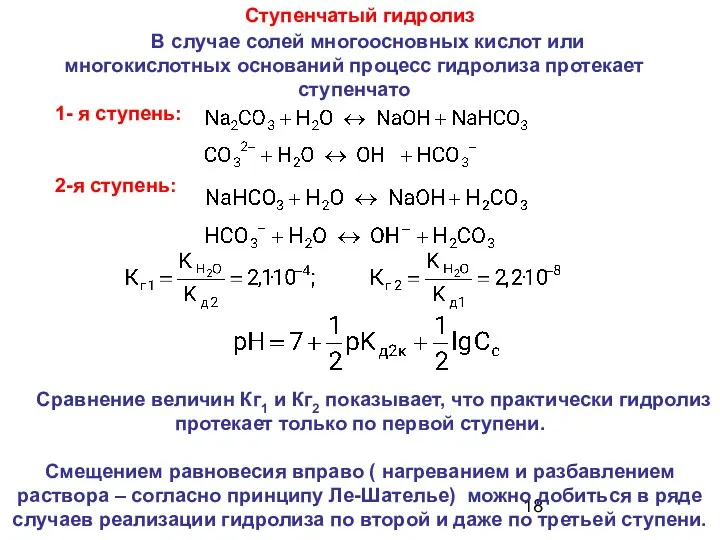
- 18. Ступенчатый гидролиз В случае солей многоосновных кислот или многокислотных оснований процесс гидролиза протекает ступенчато 1- я
- 19. Смещение равновесия обратимого гидролиза
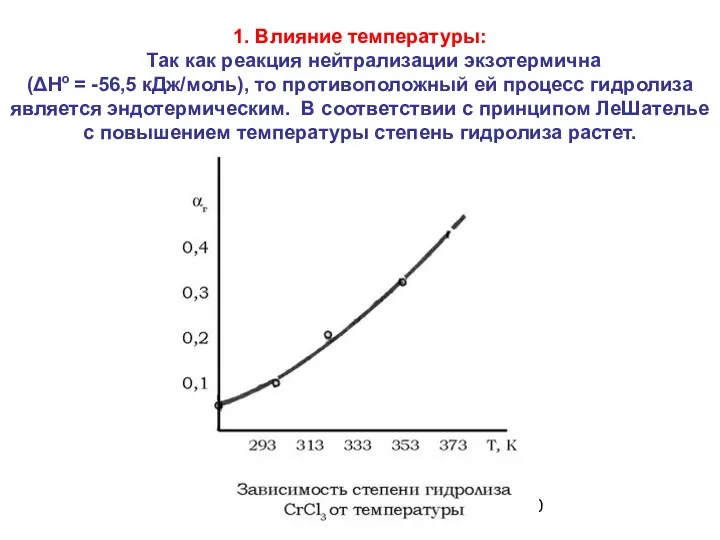
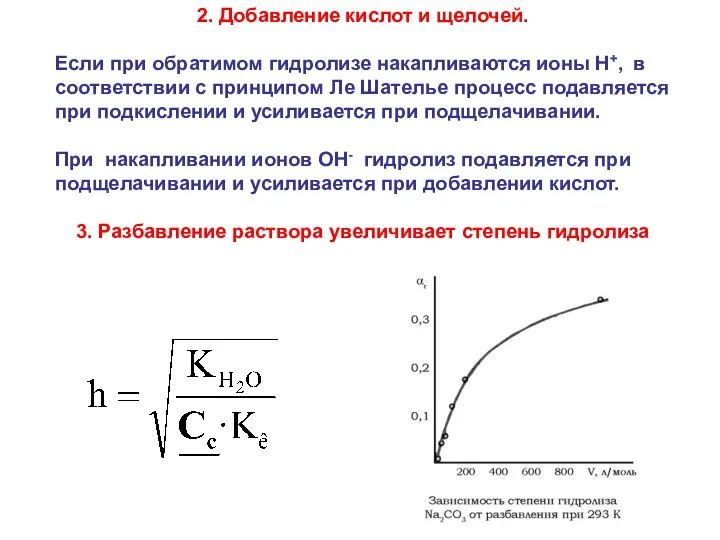
- 20. 1. Влияние температуры: Так как реакция нейтрализации экзотермична (ΔHo = -56,5 кДж/моль), то противоположный ей процесс
- 21. 2. Добавление кислот и щелочей. Если при обратимом гидролизе накапливаются ионы Н+, в соответствии с принципом
- 22. Необратимый гидролиз Если какое-либо из образующихся в процессе гидролиза веществ накапливается в растворе в таких количествах,
- 23. Роль гидролиза биоорганических соединений в процессах жизнедеятельности 1. Каждый из ферментов активен при строго определенных значениях
- 24. 2. Без ферментативного гидролиза невозможно усвоение пищевых продуктов (жиры, углеводы, белки) , так как всасываться в
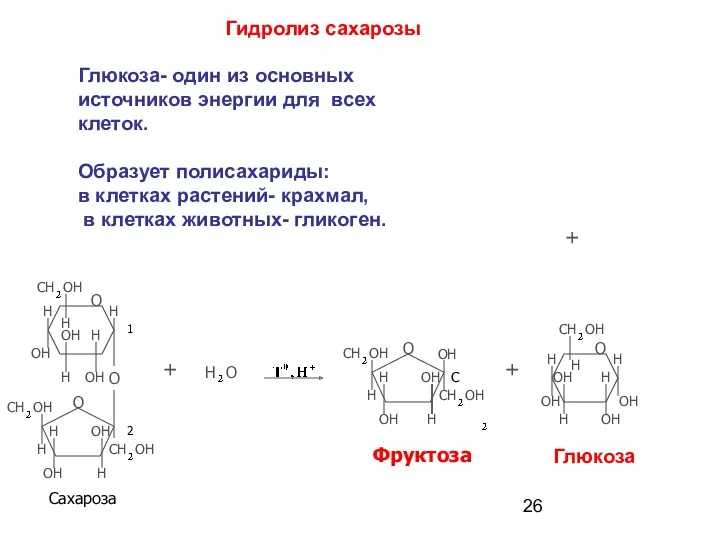
- 25. Углеводы – CnH2nOn (сахар, хлеб, крупы, макаронные изделия) В процессе усвоения углеводы расщепляются до моносахаридов, которые
- 26. Гидролиз сахарозы + H O + О С OH H CH OH OH OH H H
- 27. Белки - основной строительный материал клеток (рыба, творог, сыр, говядина, крупы) Вещества, молекулы которых состоят из
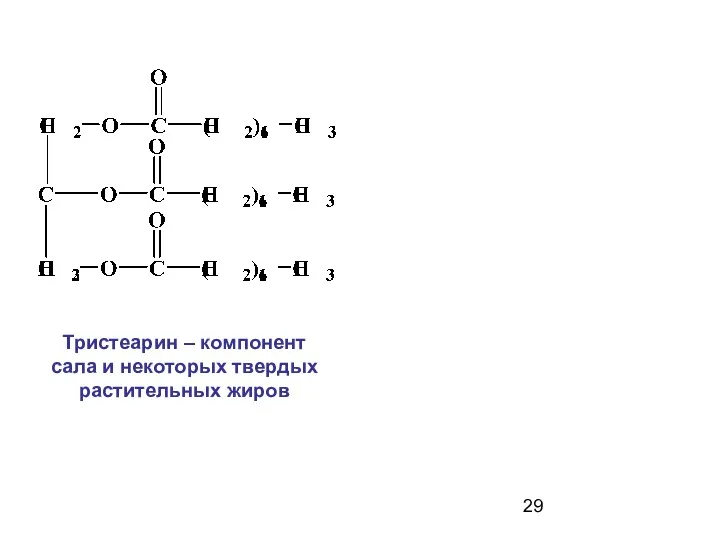
- 28. Жиры - сложные эфиры глицерина и жирных кислот. где R, R' и R" — радикалы жирных
- 29. Тристеарин – компонент сала и некоторых твердых растительных жиров
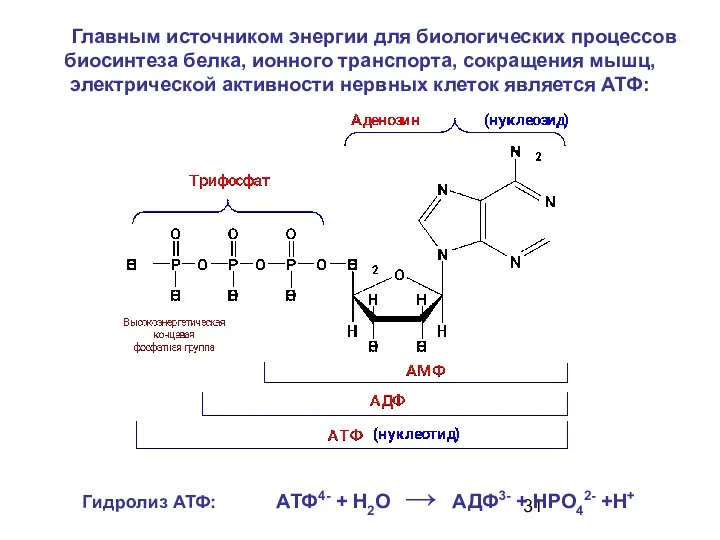
- 30. 3. Гидролиз АТФ - источник энергии в организме Человек получает энергию как за счет многостадийного процесса
- 31. Главным источником энергии для биологических процессов биосинтеза белка, ионного транспорта, сокращения мышц, электрической активности нервных клеток
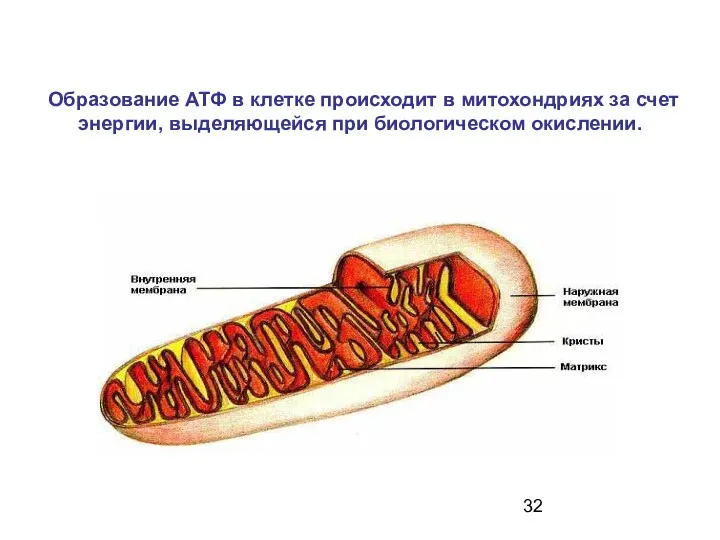
- 32. Образование АТФ в клетке происходит в митохондриях за счет энергии, выделяющейся при биологическом окислении.
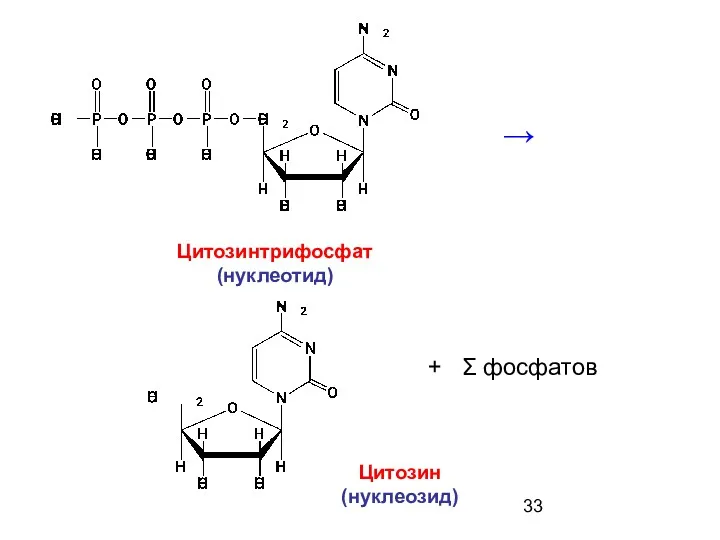
- 33. Цитозин (нуклеозид) Цитозинтрифосфат (нуклеотид) → + Σ фосфатов
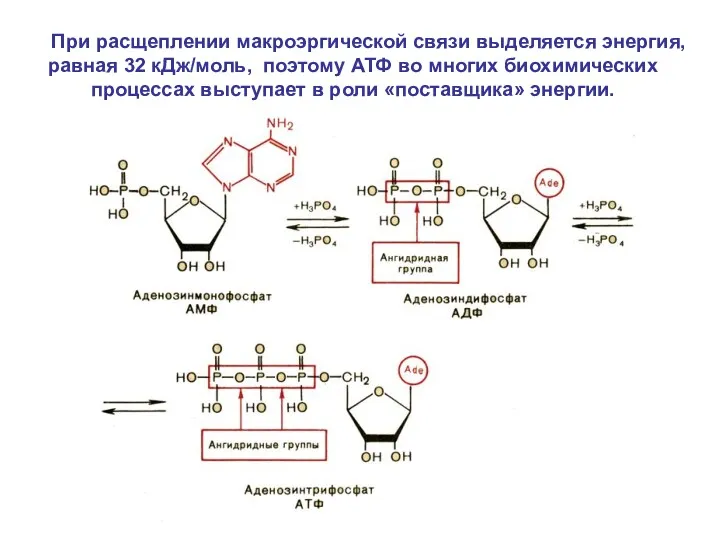
- 34. При расщеплении макроэргической связи выделяется энергия, равная 32 кДж/моль, поэтому АТФ во многих биохимических процессах выступает
- 35. 4. Гидролиз –один из важнейших путей метаболизма лекарственных препаратов и пищевых продуктов Процесс гидролиза может идти:
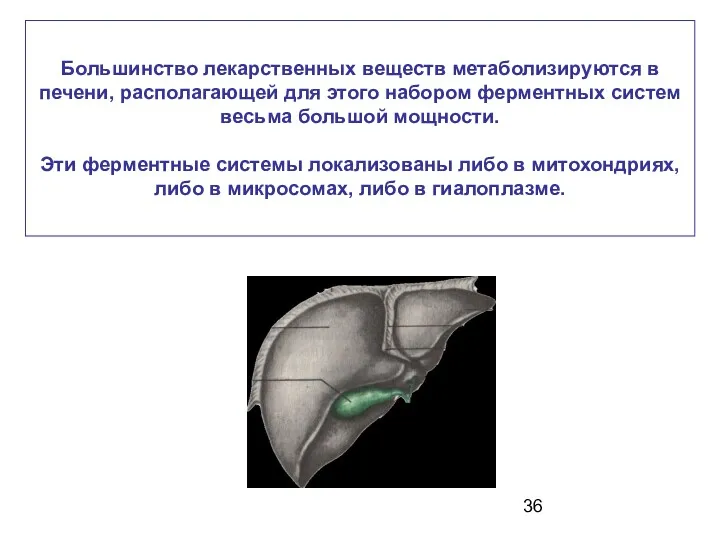
- 36. Большинство лекарственных веществ метаболизируются в печени, располагающей для этого набором ферментных систем весьма большой мощности. Эти
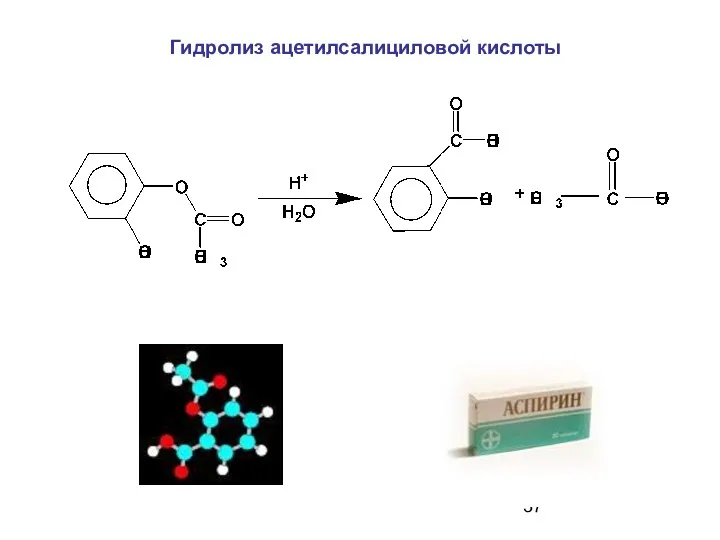
- 37. Гидролиз ацетилсалициловой кислоты
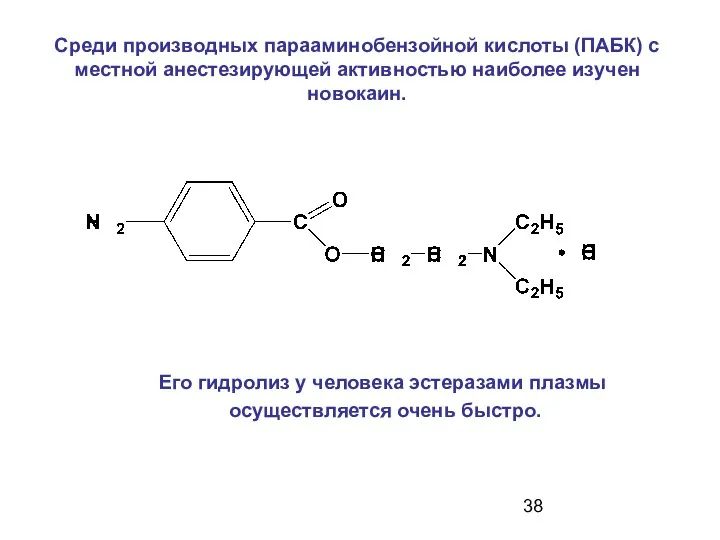
- 38. Среди производных парааминобензойной кислоты (ПАБК) с местной анестезирующей активностью наиболее изучен новокаин. Его гидролиз у человека
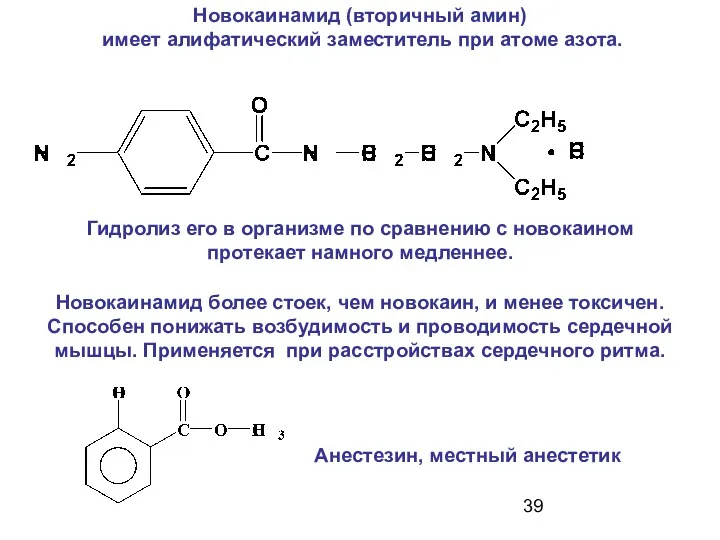
- 39. Новокаинамид (вторичный амин) имеет алифатический заместитель при атоме азота. Новокаинамид более стоек, чем новокаин, и менее
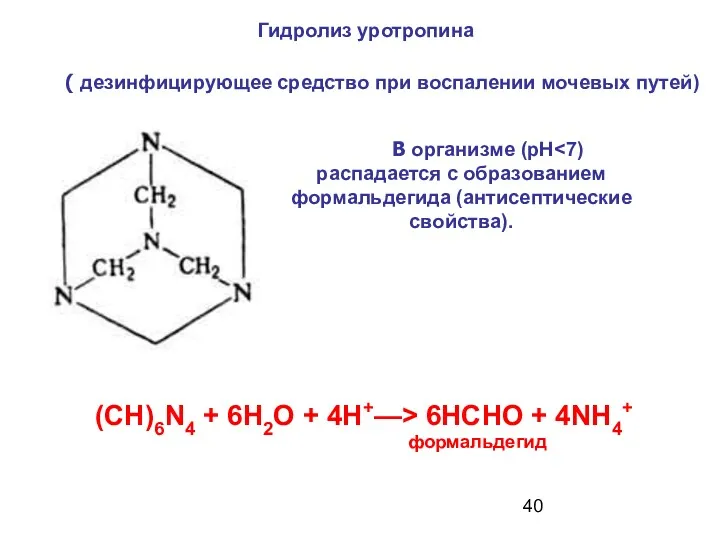
- 40. (CH)6N4 + 6Н2О + 4H+—> 6НСНО + 4NH4+ формальдегид Гидролиз уротропина В организме (pH ( дезинфицирующее
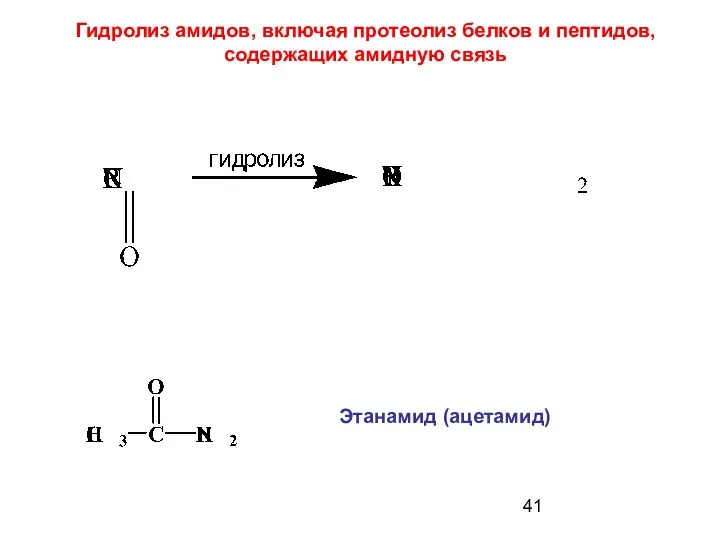
- 41. Этанамид (ацетамид) Гидролиз амидов, включая протеолиз белков и пептидов, содержащих амидную связь
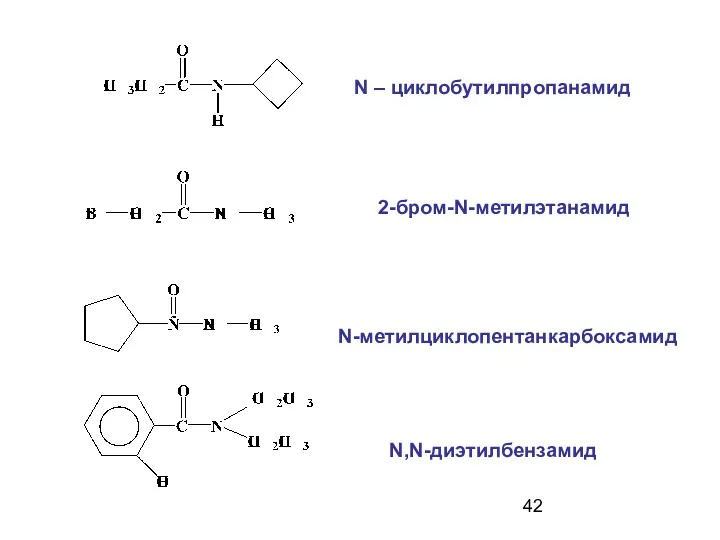
- 42. N – циклобутилпропанамид 2-бром-N-метилэтанамид N-метилциклопентанкарбоксамид N,N-диэтилбензамид
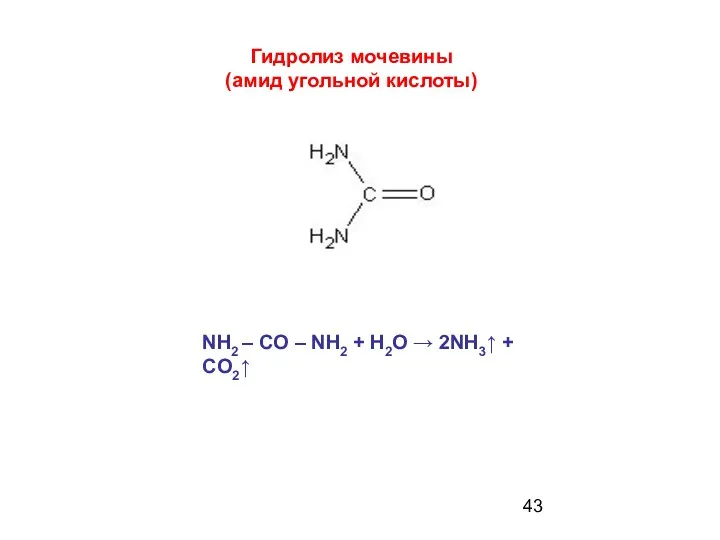
- 43. Гидролиз мочевины (амид угольной кислоты) NH2 – CO – NH2 + H2O → 2NH3↑ + CO2↑
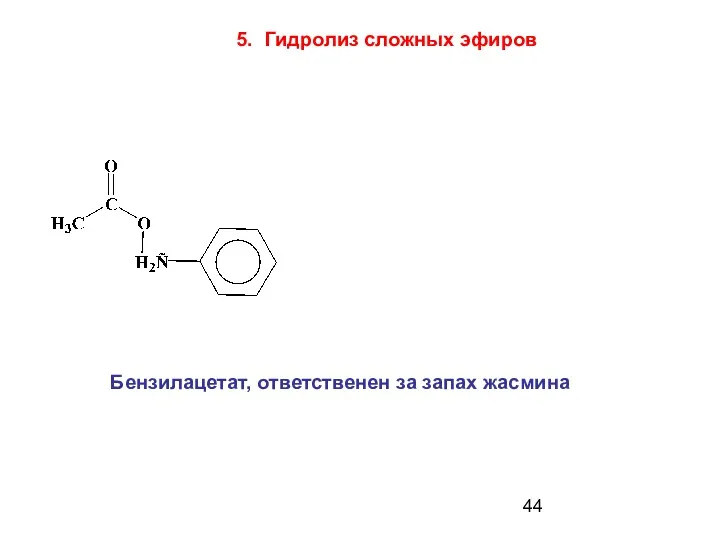
- 44. Бензилацетат, ответственен за запах жасмина 5. Гидролиз сложных эфиров
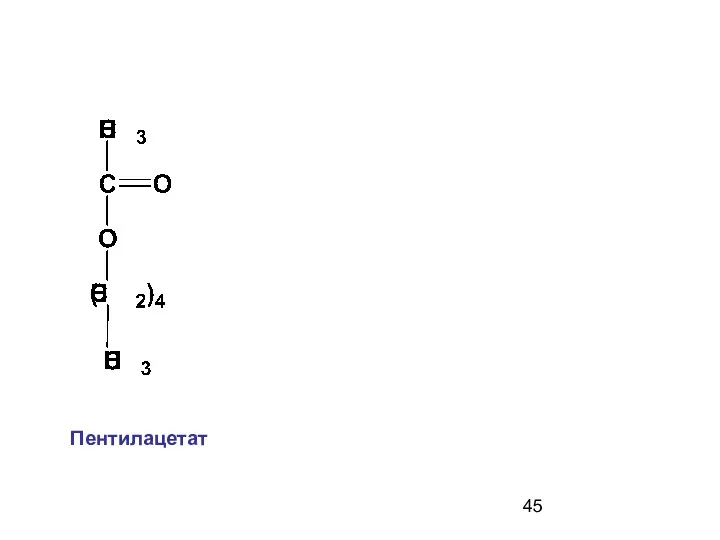
- 45. Пентилацетат
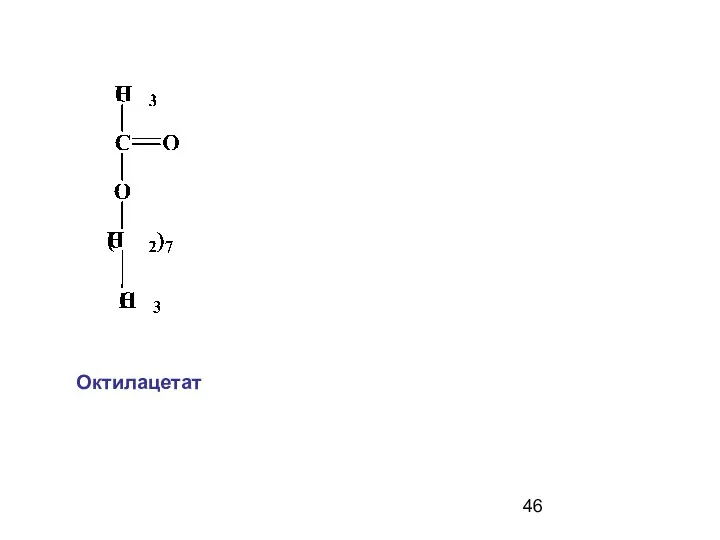
- 46. Октилацетат
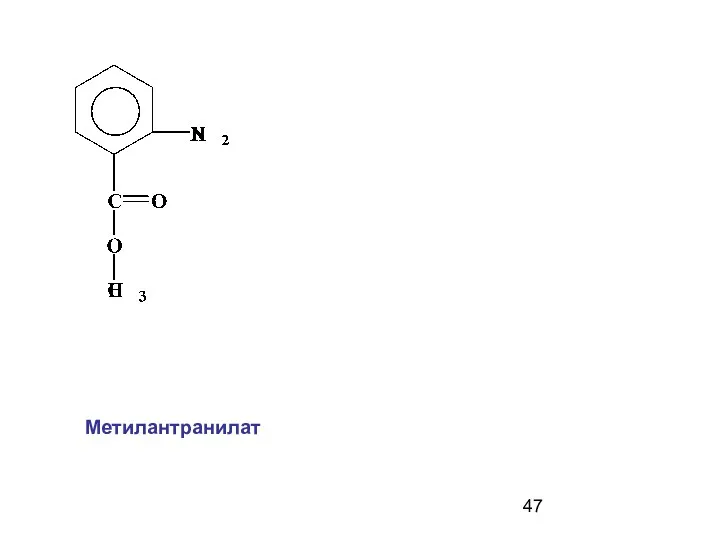
- 47. Метилантранилат
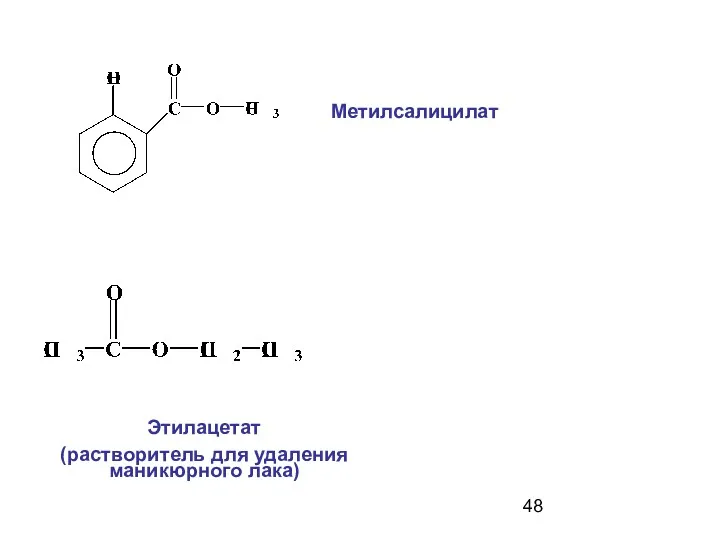
- 48. Метилсалицилат Этилацетат (растворитель для удаления маникюрного лака)
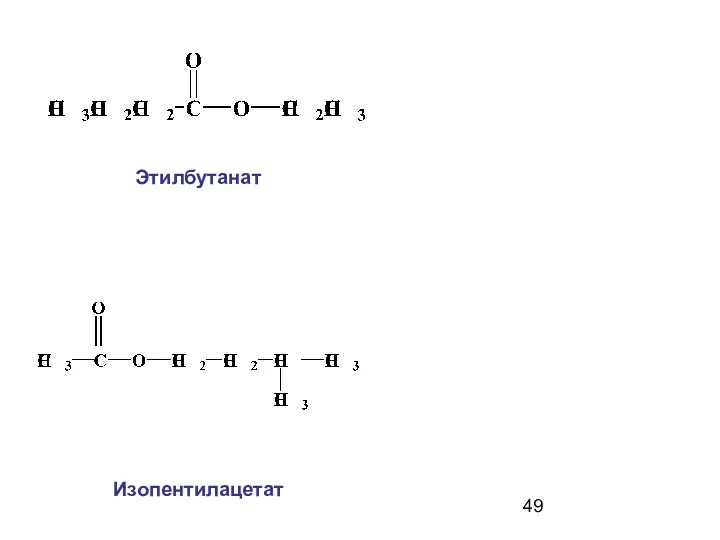
- 49. Этилбутанат Изопентилацетат
- 51. Скачать презентацию




![Домножим числитель и знаменатель на [H+]: Значение Кг показывает, что](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/235789/slide-7.jpg)
![Приравнивая формулы (1) и (2), получим: [OH-]=[CH3COOH] Вывод степени гидролиза h](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/235789/slide-8.jpg)













 Карбоновые кислоты. 10 класс
Карбоновые кислоты. 10 класс Взаимодействие кислоты с основанием (реакция нейтрализации)
Взаимодействие кислоты с основанием (реакция нейтрализации)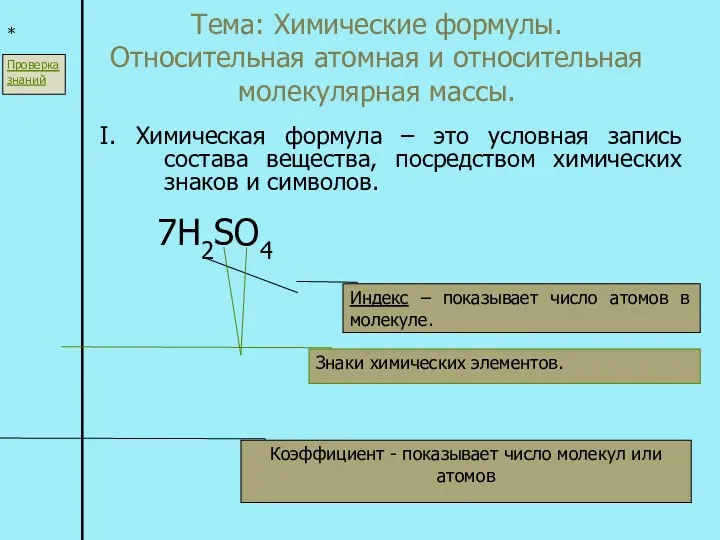 Химические формулы. Относительная атомная и относительная молекулярная массы
Химические формулы. Относительная атомная и относительная молекулярная массы Автомобильные пластичные смазки
Автомобильные пластичные смазки Кристаллы. Кристаллические вещества
Кристаллы. Кристаллические вещества Периодическая система химических элементов Д.И. Менделеева. Строение атома
Периодическая система химических элементов Д.И. Менделеева. Строение атома Витаминдер. Витаминдердің классификациясы. Алиментарлы және екіншілік авитаминоздар. Гипервитаминоздар
Витаминдер. Витаминдердің классификациясы. Алиментарлы және екіншілік авитаминоздар. Гипервитаминоздар Приготовление растворов с определенной массовой долей растворенного вещества. Практическая работа
Приготовление растворов с определенной массовой долей растворенного вещества. Практическая работа Полимеры органические и неорганические
Полимеры органические и неорганические Лабораторна робота. Властивості амінів
Лабораторна робота. Властивості амінів Электролиз
Электролиз Роль химии в современной цивилизации
Роль химии в современной цивилизации Углеводородное сырье: способы переработки
Углеводородное сырье: способы переработки Карбон қышқылдары, жіктелуі, сипаттамалары, таралуы
Карбон қышқылдары, жіктелуі, сипаттамалары, таралуы Осмий. Нахождение в природе
Осмий. Нахождение в природе Альдегиды и кетоны
Альдегиды и кетоны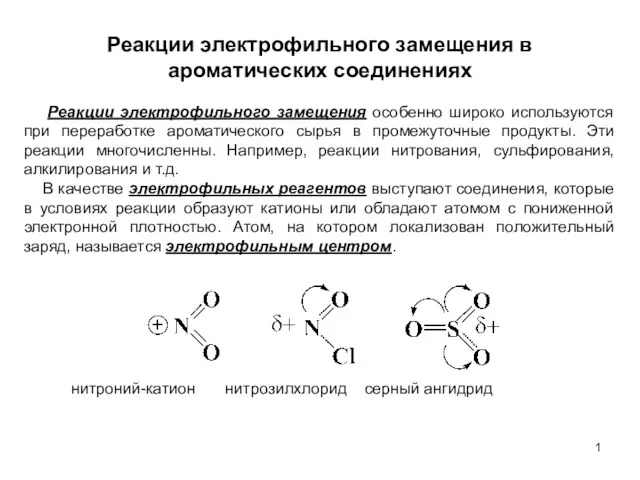 Реакции электрофильного замещения в ароматических соединениях. (Лекция 6)
Реакции электрофильного замещения в ароматических соединениях. (Лекция 6) Триглицериды. Липиды. Средства ухода за кожей. Лекция 3. Индустрия красоты
Триглицериды. Липиды. Средства ухода за кожей. Лекция 3. Индустрия красоты Ауыл шаруашылығындағы минералды. Тыңайтқыш-азық-түліктегі нитраттар
Ауыл шаруашылығындағы минералды. Тыңайтқыш-азық-түліктегі нитраттар Тепловий ефект хімічних реакцій. Екзотермічні ї ендотермічні реакції термохімічні рівняння
Тепловий ефект хімічних реакцій. Екзотермічні ї ендотермічні реакції термохімічні рівняння Осадочные и метаморфические горные породы
Осадочные и метаморфические горные породы Объемная доля компонента газовой смеси
Объемная доля компонента газовой смеси Органічна хімія
Органічна хімія Первичная переработка нефти
Первичная переработка нефти Nuclear Energy, Controlled Fission and Fusion 2016
Nuclear Energy, Controlled Fission and Fusion 2016 Гидроксикислоты (оксикислоты)
Гидроксикислоты (оксикислоты) Лекция 3. Протолитические равновесия и процессы
Лекция 3. Протолитические равновесия и процессы Карбоновые кислоты и их функциональные производные. Хроматографические методы исследования
Карбоновые кислоты и их функциональные производные. Хроматографические методы исследования