Содержание
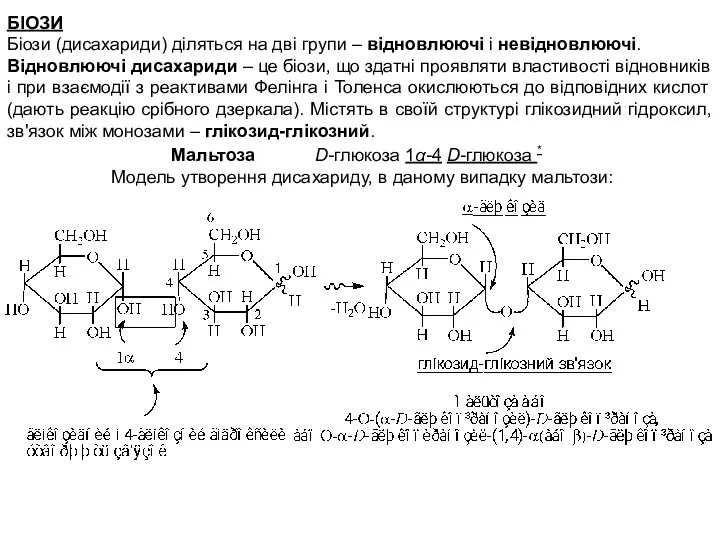
- 2. БІОЗИ Біози (дисахариди) діляться на дві групи – відновлюючі і невідновлюючі. Відновлюючі дисахариди – це біози,
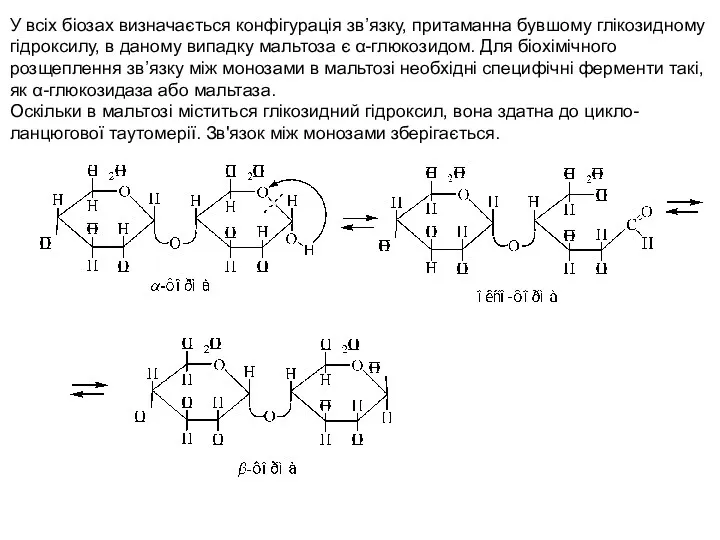
- 3. У всіх біозах визначається конфігурація зв’язку, притаманна бувшому глікозидному гідроксилу, в даному випадку мальтоза є α-глюкозидом.
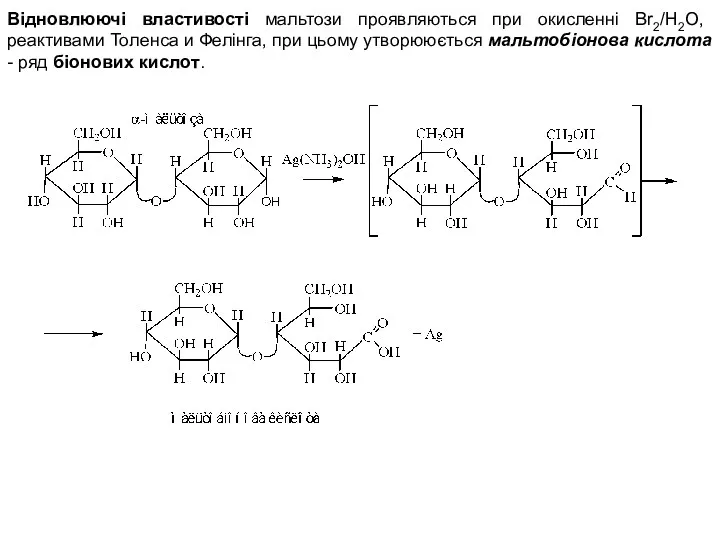
- 4. Відновлюючі властивості мальтози проявляються при окисленні Br2/H2O, реактивами Толенса и Фелінга, при цьому утворююється мальтобіонова кислота
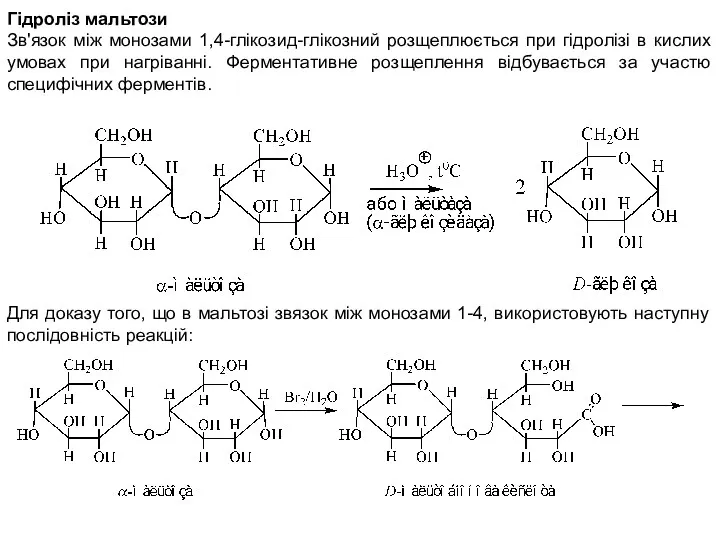
- 5. Гідроліз мальтози Зв'язок між монозами 1,4-глікозид-глікозний розщеплюється при гідролізі в кислих умовах при нагріванні. Ферментативне розщеплення
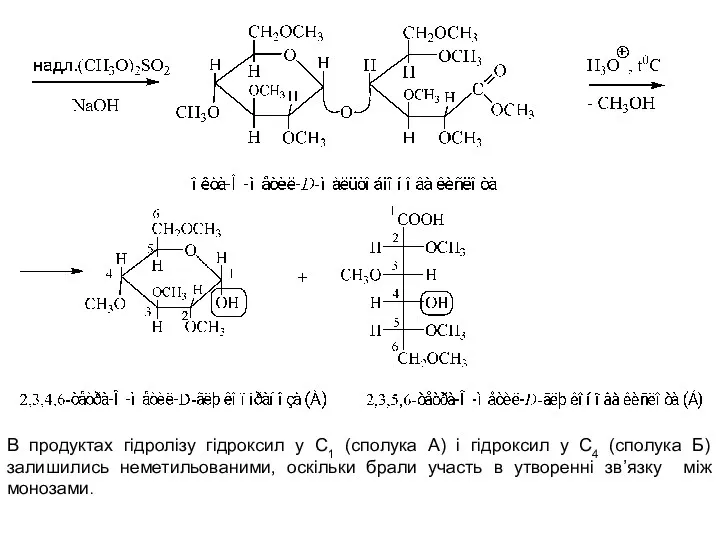
- 6. В продуктах гідролізу гідроксил у С1 (сполука А) і гідроксил у С4 (сполука Б) залишились неметильованими,
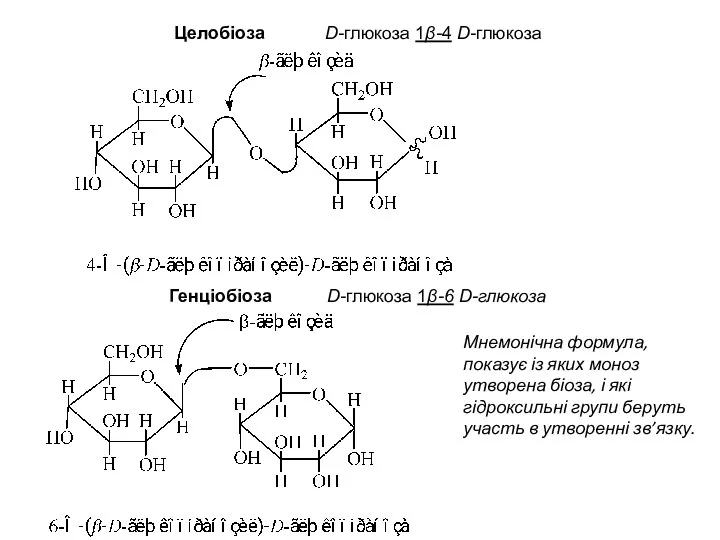
- 7. Целобіоза D-глюкоза 1β-4 D-глюкоза Генціобіоза D-глюкоза 1β-6 D-глюкоза Мнемонічна формула, показує із яких моноз утворена біоза,
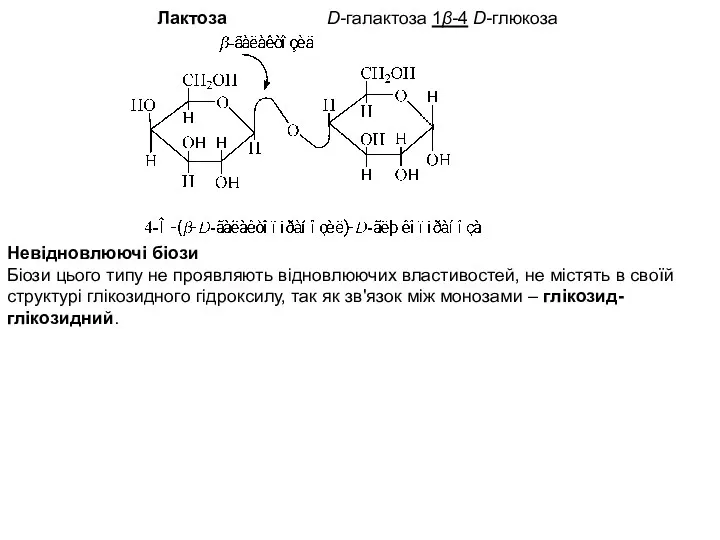
- 8. Лактоза D-галактоза 1β-4 D-глюкоза Невідновлюючі біози Біози цього типу не проявляють відновлюючих властивостей, не містять в
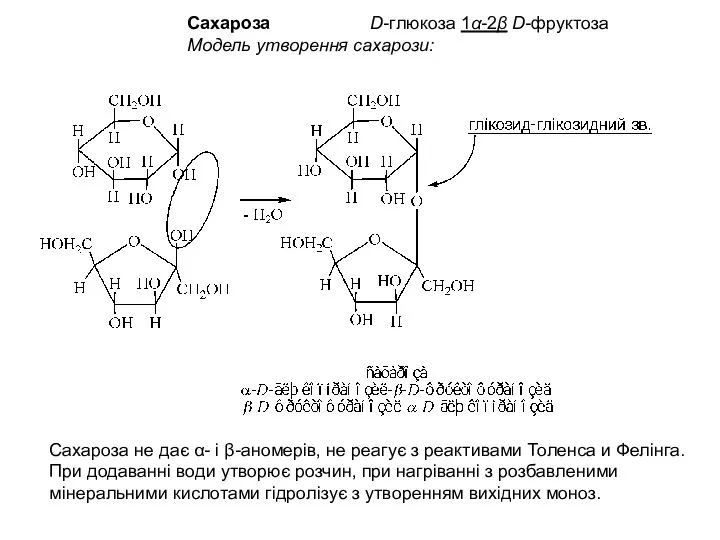
- 9. Сахароза D-глюкоза 1α-2β D-фруктоза Модель утворення сахарози: Сахароза не дає α- і β-аномерів, не реагує з
- 10. Інверсія сахарози При кислому гідролизі (+) сахарози або при дії інвертази утворюються рівні кількості D(+)глюкози і
- 11. Амінокислота – це азотовмісна карбонова кислота, тобто — це хімічна речовина, молекула якої одночасно містить аміногрупу
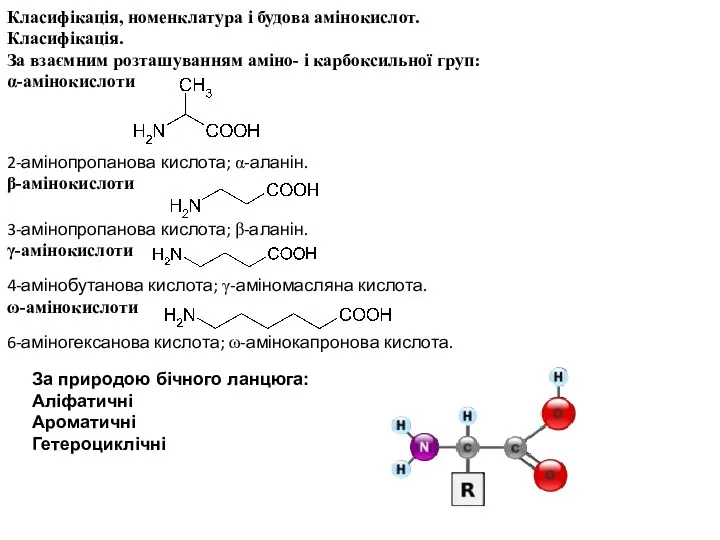
- 12. Класифікація, номенклатура і будова амінокислот. Класифікація. За взаємним розташуванням аміно- і карбоксильної груп: α-амінокислоти 2-амінопропанова кислота;
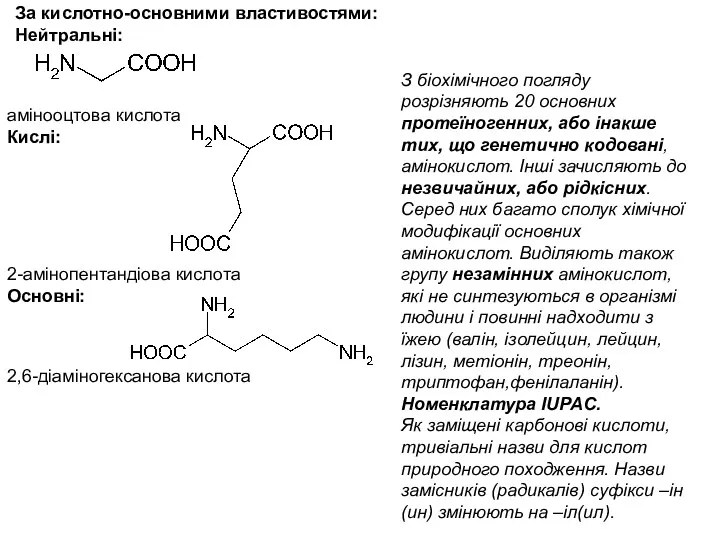
- 13. За кислотно-основними властивостями: Нейтральні: амінооцтова кислота Кислі: 2-амінопентандіова кислота Основні: 2,6-діаміногексанова кислота З біохімічного погляду розрізняють
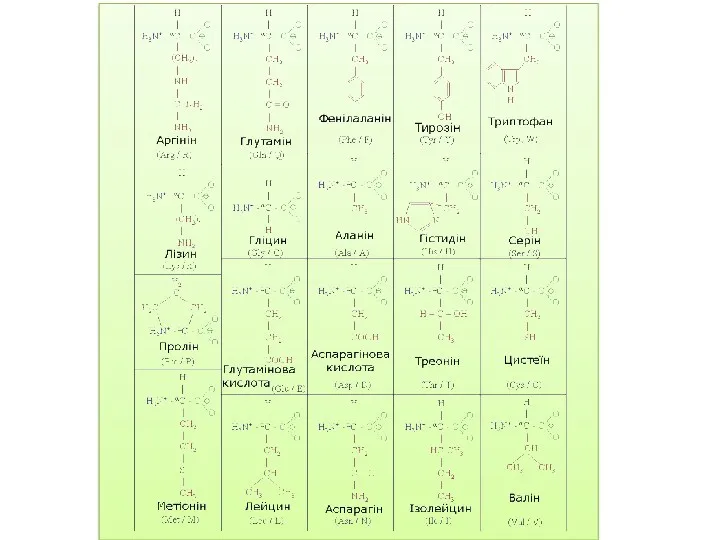
- 15. У залежності від природи вуглеводневого радикала, з яким зв'язана карбоксильна група, амінокислоти підрозділяють на аліфатичні й
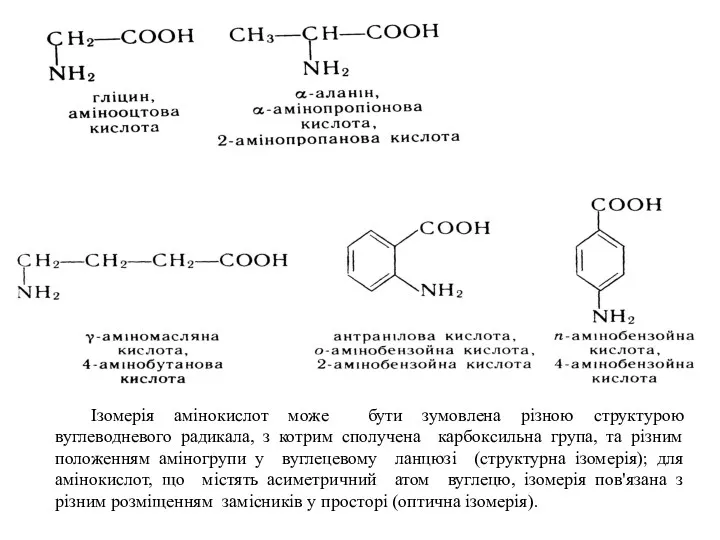
- 16. Ізомерія амінокислот може бути зумовлена різною структурою вуглеводневого радикала, з котрим сполучена карбоксильна група, та різним
- 17. Фізичні та хімічні властивості Амінокислоти являють собою білі кристалічні речовини з високими температурами плавлення, добре розчинні
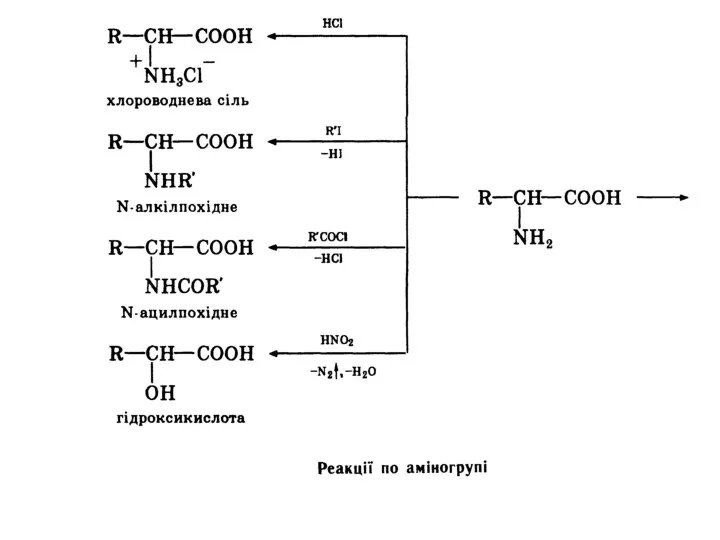
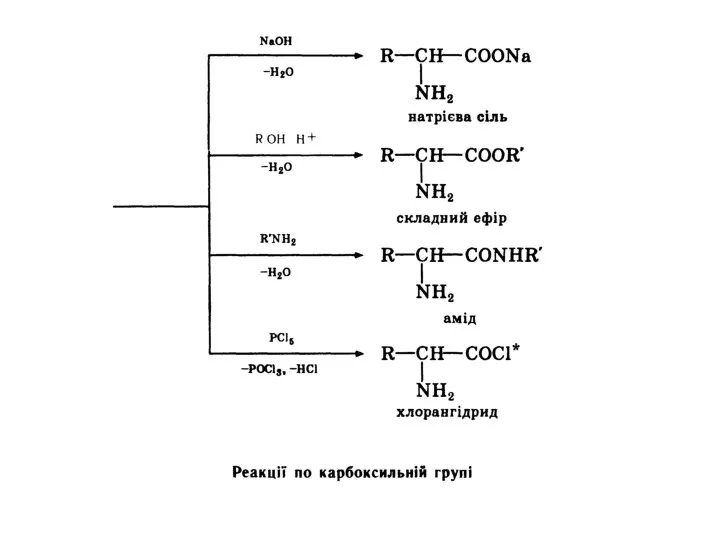
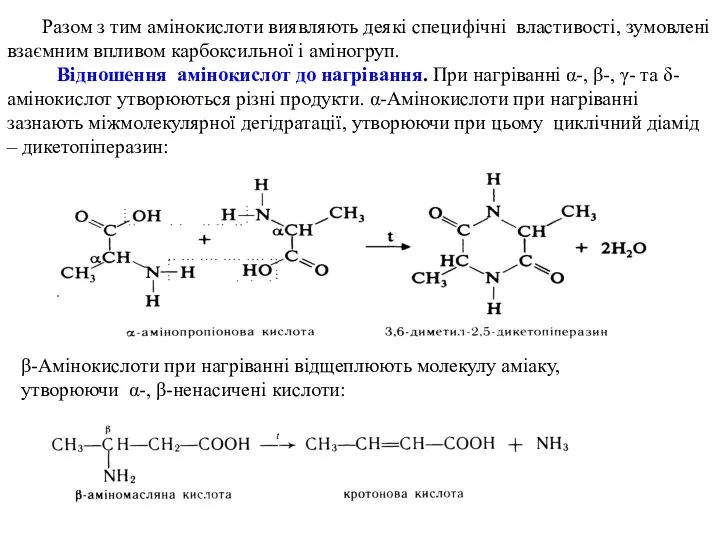
- 20. Разом з тим амінокислоти виявляють деякі специфічні властивості, зумовлені взаємним впливом карбоксильної і аміногруп. Відношення амінокислот
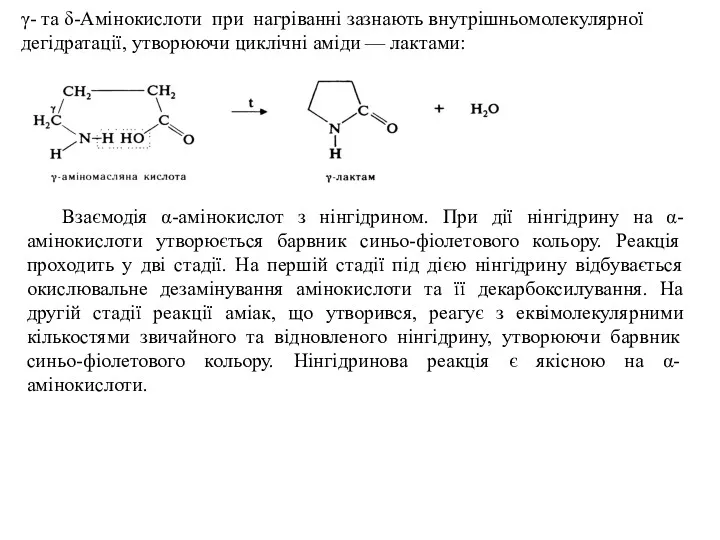
- 21. γ- та δ-Амінокислоти при нагріванні зазнають внутрішньомолекулярної дегідратації, утворюючи циклічні аміди — лактами: Взаємодія α-амінокислот з
- 23. Скачать презентацию




 Молекулы и атомы (часть 2)
Молекулы и атомы (часть 2) Лекция 3. Разновидности химических связей
Лекция 3. Разновидности химических связей Кислородсодержащие органические соединения. 9 класс
Кислородсодержащие органические соединения. 9 класс Хімічний зв’язок
Хімічний зв’язок Определение критических точек двойного сплава
Определение критических точек двойного сплава Бейорганикалық химия туралы
Бейорганикалық химия туралы Этил спирті және оның адам ағзасына әсері
Этил спирті және оның адам ағзасына әсері Водород
Водород Закон сохранения массы веществ. Урок вместе с умной колонкой
Закон сохранения массы веществ. Урок вместе с умной колонкой Металлы в организме человека
Металлы в организме человека Функціональні похідні аліфатичних вуглеводнів галогенопохідні вуглеводнів
Функціональні похідні аліфатичних вуглеводнів галогенопохідні вуглеводнів Вещества. Чистые вещества. Смеси
Вещества. Чистые вещества. Смеси Комплексные соединения
Комплексные соединения Соли. Свойства солей
Соли. Свойства солей Классификация химических реакций
Классификация химических реакций Производные бис-(β-хлорэтил)-амина, препараты для лечения онкозаболеваний
Производные бис-(β-хлорэтил)-амина, препараты для лечения онкозаболеваний Основные понятия и законы химии. Тема1
Основные понятия и законы химии. Тема1 Возникновение и развитие научной химии
Возникновение и развитие научной химии Нитрид галлия. Основные свойства и применение. GaN и твердые растворы на его основе
Нитрид галлия. Основные свойства и применение. GaN и твердые растворы на его основе Нуклеиновые кислоты
Нуклеиновые кислоты Глицерин. Свойства и применение
Глицерин. Свойства и применение Предмет химии. Вещества и их физические свойства
Предмет химии. Вещества и их физические свойства Серная кислота H2SO4. 9 классы
Серная кислота H2SO4. 9 классы Оксиды. 9 класс
Оксиды. 9 класс Калийные Удобрения
Калийные Удобрения Химическая связь. (Лекция 4, 5)
Химическая связь. (Лекция 4, 5) Углерод, как химический элемент и простое вещество
Углерод, как химический элемент и простое вещество Характеристика элемента по его положению в периодической системе химических элементов (1)
Характеристика элемента по его положению в периодической системе химических элементов (1)