Содержание
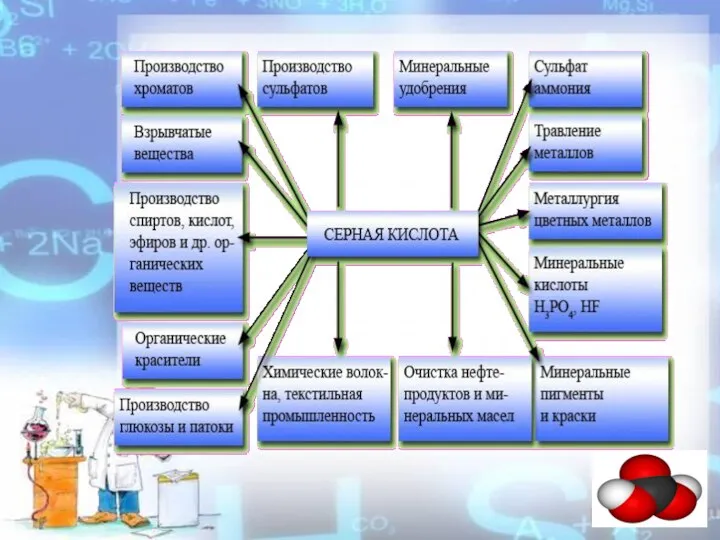
- 2. Серная кислота H2SO4 — сильная двухосновная кислота, отвечающая высшей степени окисления серы (+6). При обычных условиях
- 3. FeS2 S H2S SO2 → SO3 → H2SO4 Пирит Серный колчедан Получение серной кислоты
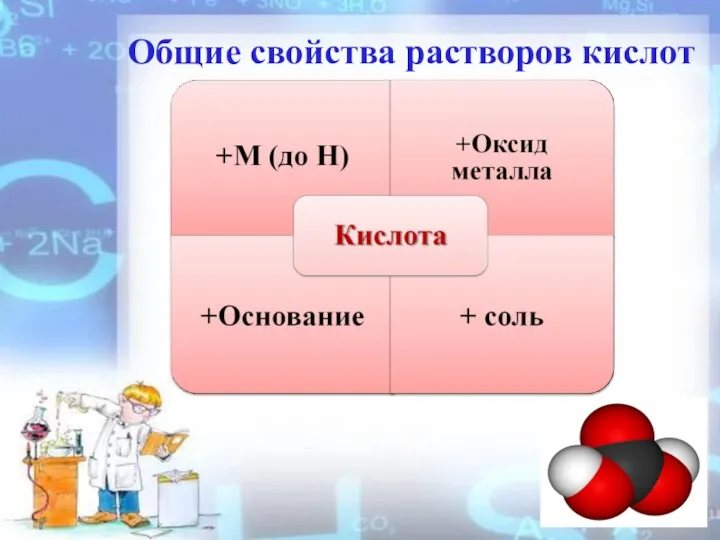
- 4. Общие свойства растворов кислот
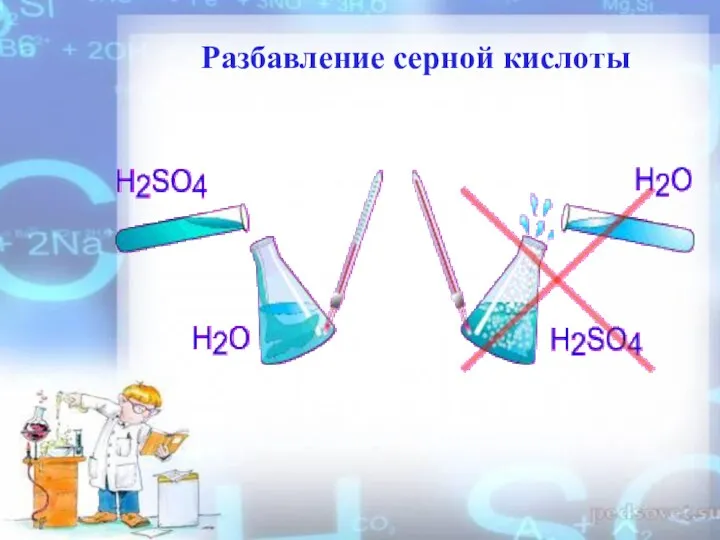
- 5. Разбавление серной кислоты
- 6. I. Химические свойства разбавленной серной кислоты 1.Диссоциация: H2SO4 → H+ + HSO4- HSO4- ↔ H+ +
- 7. 2. Взаимодействие с металлами ( до Н ) Zn + H2SO4 → ZnSO4 + H2↑ Mg
- 8. 3. Взаимодействие с оcновными и амфотерными оксидами CuO + H2SO4 → CuSO4 + H2O ZnO +
- 9. 4. Взаимодействие с основаниями и амфотерными гидроксидами 2NaOH + H2SO4 → Na2SO4 +2 H2O NaOH +
- 10. 5.Взаимодействие с солями H2SO4+BaCI2 = BaSO4 ↓ + 2HCI K2CO3 + H2SO4 = K2SO4 + CO2
- 11. Качественная реакция H2SO4+BaCI2 = BaSO4 ↓ + 2HCI Ba2+ + SO42- = BaSO4↓
- 12. Свойства концентрированной серной кислоты Органические вещества обугливаются !!! C12H22O11 (сахароза) → 12С (уголь)
- 13. концентрированная серная кислота окисляет неметаллы неМе + H2SO4(конц.) = H2O + SO2 + кислородсодержащая кислота неМе,
- 14. концентрированная серная кислота окисляет металлы концентрированная H2+6SO4 – сильный окислитель; при взаимодействии с металлами (кроме Au,
- 16. Лабораторная работа Опыт №1. Обнаружение сульфат ионов. https://www.youtube.c om/watch?v=bvEXNZfvh1g Опыт 2. Взаимодействие серной кислоты с цинком.
- 18. Скачать презентацию












 Полимерные материалы, пластмассы и изделия из них
Полимерные материалы, пластмассы и изделия из них Основы химической термодинамики (лекция 6)
Основы химической термодинамики (лекция 6) Изомерия в органической химии. Изомеры
Изомерия в органической химии. Изомеры Кислотно-основное титрование
Кислотно-основное титрование Субстраты и продукты биохимических реакций
Субстраты и продукты биохимических реакций Агрегатные состояния вещества с точки зрения атомно-молекулярных представлений
Агрегатные состояния вещества с точки зрения атомно-молекулярных представлений Окислительные методы получения органических соединений
Окислительные методы получения органических соединений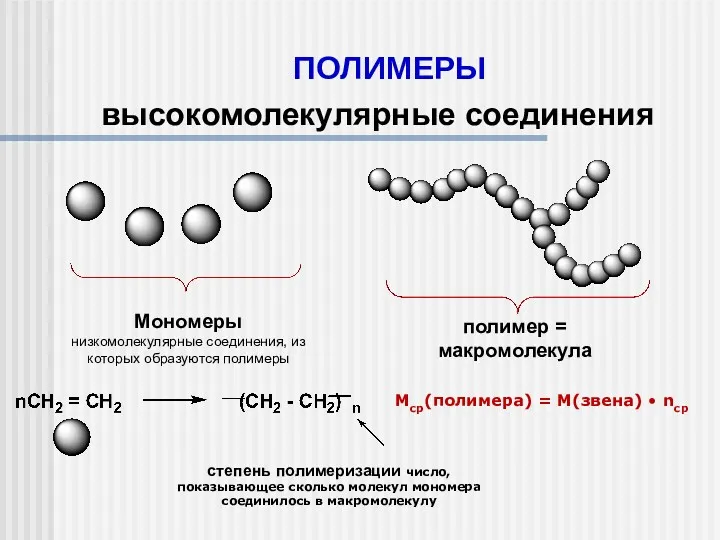 Полимеры. Высокомолекулярные соединения
Полимеры. Высокомолекулярные соединения Периодический закон Д.И. Менделеева
Периодический закон Д.И. Менделеева Чистые вещества и смеси
Чистые вещества и смеси Подготовка к ВПР по химии. 11 класс
Подготовка к ВПР по химии. 11 класс Оксиды неметаллов и кислородсодержащие кислоты. 11 класс
Оксиды неметаллов и кислородсодержащие кислоты. 11 класс Галогены VII группы. Биологическая роль и применение в медицине
Галогены VII группы. Биологическая роль и применение в медицине Щелочные металлы. 9 класс
Щелочные металлы. 9 класс Механизмы органических реакций
Механизмы органических реакций Карбоновые кислоты. Нахождение в природе
Карбоновые кислоты. Нахождение в природе Почему мыло пенится
Почему мыло пенится Оптические свойства дисперсных систем. Оптические методы исследования коллоидных систем
Оптические свойства дисперсных систем. Оптические методы исследования коллоидных систем Азотная кислота
Азотная кислота Химические формулы. Относительная молекулярная масса вещества
Химические формулы. Относительная молекулярная масса вещества Галогены. Химические свойства. Применение
Галогены. Химические свойства. Применение Химические свойства основных неорганических соединений в свете ЭД и ОВР
Химические свойства основных неорганических соединений в свете ЭД и ОВР Redox reactions
Redox reactions Молекулалық орбиталдың негіздері ТФП 315
Молекулалық орбиталдың негіздері ТФП 315 Химическая связь
Химическая связь Амінокислоти. Склад і будова молекул, загальні та структурні формули, систематична номенклатура
Амінокислоти. Склад і будова молекул, загальні та структурні формули, систематична номенклатура Учение об агрегатных состояниях вещества. Жидкое состояние. Твердое состояние. Плазма
Учение об агрегатных состояниях вещества. Жидкое состояние. Твердое состояние. Плазма Спирты. Классификация спиртов
Спирты. Классификация спиртов