Содержание
- 2. Вопросы: 1.Где в периодической таблице расположены неметаллы? 2) Какой из неметаллов имеет самый маленький радиус атома?
- 3. Самостоятельная работа Вариант 1 А1. Число электронов на внешнем электронном слое атома серы в основном состоянии:
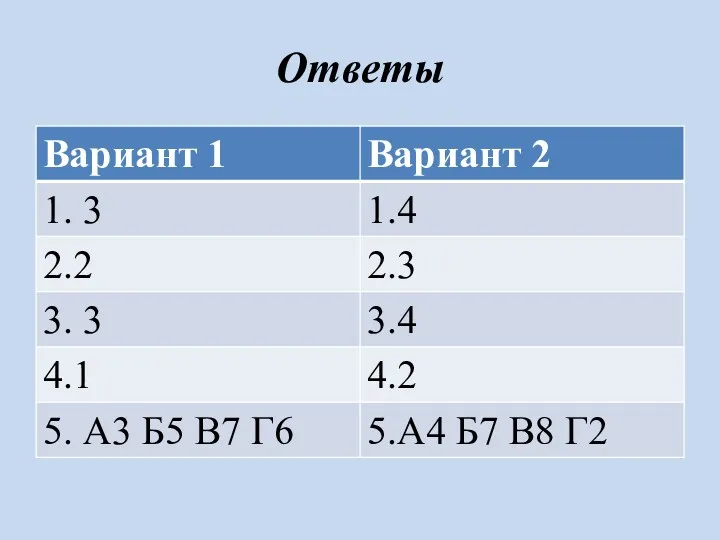
- 4. Ответы
- 5. Сицилийское озеро
- 6. Оксиды неметаллов и кислородсодержащие кислоты 11 класс 14.04.2023г.
- 7. 1. Рассматривать классификацию оксидов НеМе 2.Делать выводы по химической активности оксидов НеМе 3.Рассматривать физические св-ва НеМеО
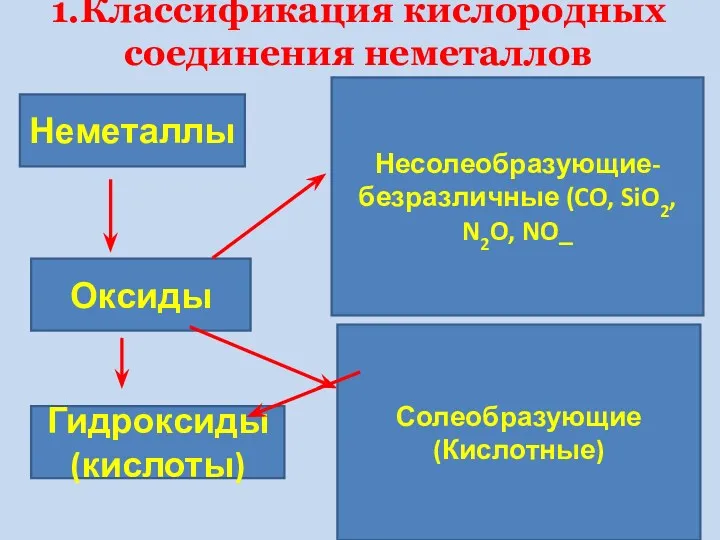
- 8. 1.Классификация кислородных соединения неметаллов Неметаллы Оксиды Гидроксиды (кислоты) Несолеобразующие-безразличные (CO, SiO2, N2O, NO_ Солеобразующие (Кислотные)
- 9. 1. Определяем СО элемента, образующего оксид. 1) Если СО элемента = +3 или более, то оксид
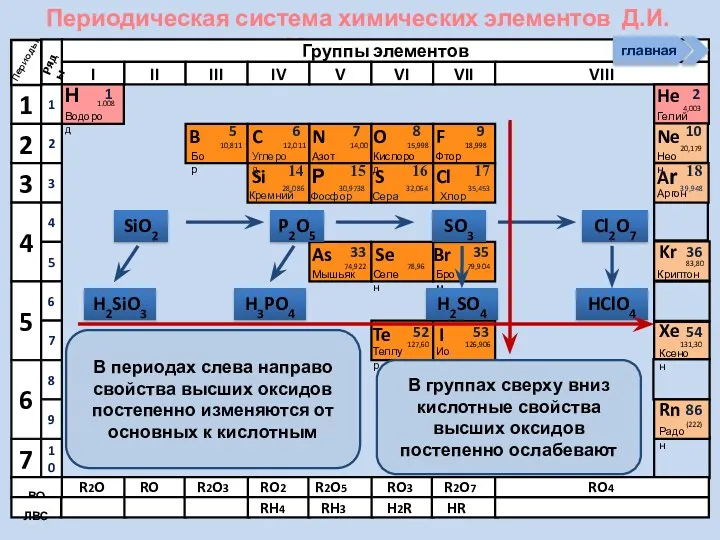
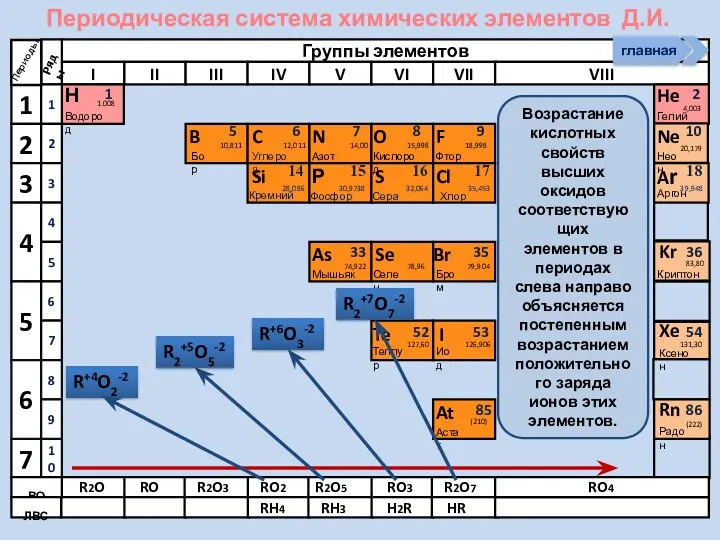
- 10. Периодическая система химических элементов Д.И. Менделеева Н Водород 1 1.008 Периоды B C N As He
- 11. Периодическая система химических элементов Д.И. Менделеева Н Водород 1 1.008 Периоды B C N As He
- 12. Задание Даны формулы кислотных оксидов. Расположите эти формулы в порядке усиления кислотных свойств оксидов.
- 13. 2.Оксиды НеМе 1.Кристаллическая решетка: Преимущественно молекулярная, SiO2 - атомная 2.Физические свойства: газы(CO2, SO2, CO, NO2), жидкости(H2O,
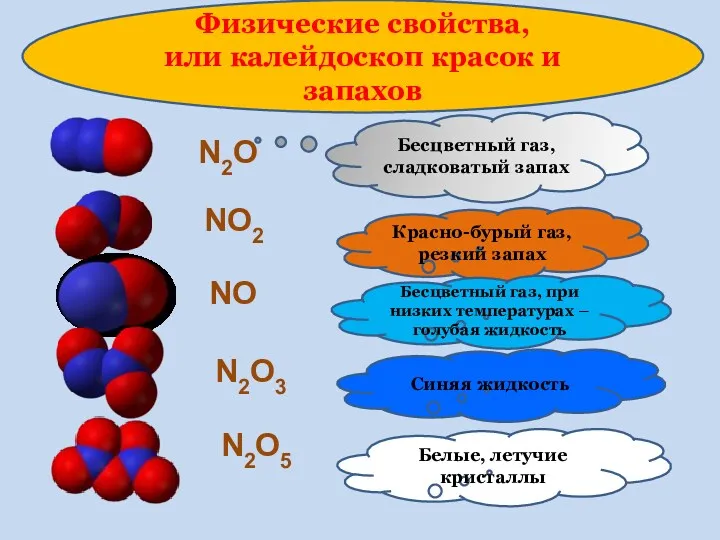
- 14. Физические свойства, или калейдоскоп красок и запахов N2O Бесцветный газ, сладковатый запах NO2 Красно-бурый газ, резкий
- 15. Соедините между собой оксиды неметаллов и кислородсодержащие кислоты, соответствующие им.
- 16. 3.Получение оксидов НеМе Задание 1.Написать уравнения реакций 1.Взаимодействие простых веществ с кислородом 2. Окисление сложных веществ
- 17. Физкультминутка «Сложные вещества делятся на оксиды, основания, кислоты и соли» — прямые руки и опустить, вдоль
- 18. Окисление безразличных- несолеобразующих оксидов до кислотных 2CO+O2↔2CO2 Восстановление Ме с помощью безразличных- несолеобразующих оксидов CO+FeO↔Fe+CO2↑ t
- 19. 4.Химические свойства оксидов НеМе Взаимодействие со щелочами Взаимодействие с основными оксидами Взаимодействие с кислородом (если возможно
- 20. Задание 2.Группа 1.С какими из следующих веществ будет реагировать CO2:
- 21. Группа 1.С какими из следующих веществ будет реагировать CO2: Проверка!
- 22. Группа 2.С какими из следующих веществ будет реагировать P2O5 :
- 23. Группа 2.С какими из следующих веществ будет реагировать P2O5 : Проверка!
- 24. Группа 3.С какими из следующих веществ будет реагировать SO3:
- 25. Группа 3.С какими из следующих веществ будет реагировать SO3: Проверка!
- 26. Группа 4.С какими из следующих веществ будет реагировать SO2:
- 27. Группа 4.С какими из следующих веществ будет реагировать SO2: Проверка!
- 28. Группа 5.С какими из следующих веществ будет реагировать N2O5 :
- 29. Группа 5.С какими из следующих веществ будет реагировать N2O5 : Проверка!
- 30. Лабораторная работа №7. Распознавание хлоридов и сульфатов Цель работы: ознакомиться и провести качественные реакции на сульфат-,
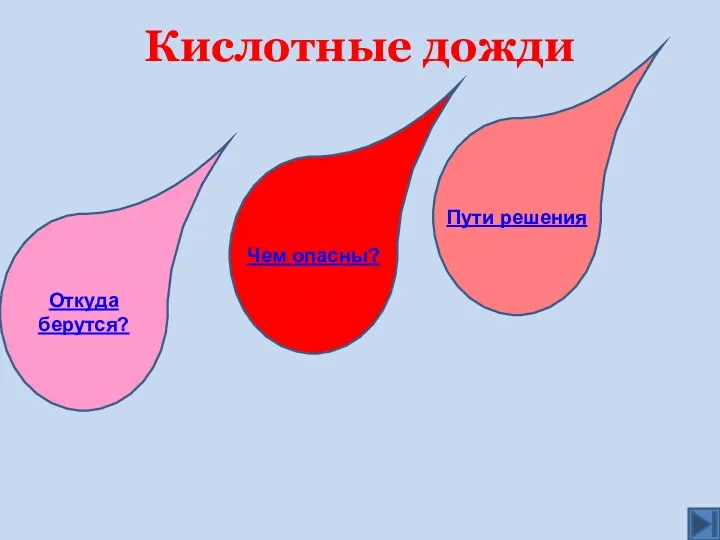
- 31. Кислотные дожди Чем опасны? Откуда берутся? Пути решения
- 33. Домашнее задание: 1) проработать §38, используя электронное приложение к учебнику, выполните тесты к §38 2) Для
- 35. Скачать презентацию


























 Rates of reaction
Rates of reaction Пластмассалар, пластикалық материалдар
Пластмассалар, пластикалық материалдар Бензины. Основные требования к свойствам бензинов. Автомобильные, Авиационные бензины. Антидетонационные присадки
Бензины. Основные требования к свойствам бензинов. Автомобильные, Авиационные бензины. Антидетонационные присадки Азот. Аммиак (9 класс)
Азот. Аммиак (9 класс) Розрахункові задачі. Обчислення за хімічними рівняннями. Відносного виходу продукту реакції
Розрахункові задачі. Обчислення за хімічними рівняннями. Відносного виходу продукту реакції Оксиген. Кисень, склад молекули, поширеність у природі. Фізичні властивості кисню
Оксиген. Кисень, склад молекули, поширеність у природі. Фізичні властивості кисню osobennosti_i_klassifikatsiya_khimicheskikh_reaktsiy_v_organicheskoy_khimii
osobennosti_i_klassifikatsiya_khimicheskikh_reaktsiy_v_organicheskoy_khimii Ароматические соединения
Ароматические соединения Строение электронных оболочек атомов химических элементов 8 класс
Строение электронных оболочек атомов химических элементов 8 класс Относительная атомная и молекулярная массы
Относительная атомная и молекулярная массы Кислоты. Состав, названия и определение кислот
Кислоты. Состав, названия и определение кислот Introduction to Periodic Table
Introduction to Periodic Table Алкилсульфонаттарды алу және технологиялық сызбанұсқасы
Алкилсульфонаттарды алу және технологиялық сызбанұсқасы Окисно-відновні реакції. 9 клас
Окисно-відновні реакції. 9 клас Етери та естери
Етери та естери Воздушные вяжущие вещества. Гипсоангидритовые вяжущие вещества. Основы процессов схватывания и твердения. (Лекция 1)
Воздушные вяжущие вещества. Гипсоангидритовые вяжущие вещества. Основы процессов схватывания и твердения. (Лекция 1) Ароматические углеводороды (арены)
Ароматические углеводороды (арены) Вуглеводи. Класифікація вуглеводів
Вуглеводи. Класифікація вуглеводів Синтетические моющие средства, порошки, омыление, выпадение в осадок мыла, жиров
Синтетические моющие средства, порошки, омыление, выпадение в осадок мыла, жиров Аминокислоты N H2 – C H – C O O H
Аминокислоты N H2 – C H – C O O H Что такое хорошо и что такое плохо, Или правила игры от очень строгой химички
Что такое хорошо и что такое плохо, Или правила игры от очень строгой химички Азотная кислота
Азотная кислота Коррозия металлов. Классификация коррозионных процессов
Коррозия металлов. Классификация коррозионных процессов Подземное хранение газа и жидкости
Подземное хранение газа и жидкости Масса и формулы. Химия 8 класс
Масса и формулы. Химия 8 класс Метал конструкциялық материалдар
Метал конструкциялық материалдар Вуглеводи
Вуглеводи Процессы и технологическая схема производства сегодня. АО Газпромнефть-ОНПЗ
Процессы и технологическая схема производства сегодня. АО Газпромнефть-ОНПЗ