Содержание
- 2. Зміст Кристалічні ґратки: молекулярні атомні йонні Тренувальні вправи: ковалентний зв’язок йонний зв’язок кристалічні ґратки Природа хімічного
- 3. Природа хімічного зв'язку Хімічний зв’язок виникає внаслідок електростатичної взаємодії позитивно заряджених ядер та негативно заряджених електронів
- 4. Природа хімічного зв'язку Причиною утворення хімічного зв'язку є «прагнення» атомів досягти найбільш стійких електронних конфігурацій, в
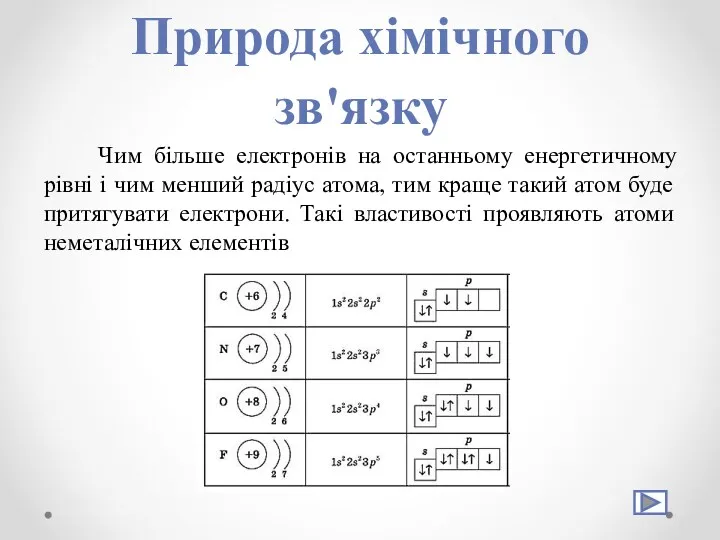
- 5. Природа хімічного зв'язку Чим більше електронів на останньому енергетичному рівні і чим менший радіус атома, тим
- 6. Природа хімічного зв'язку Чим менше електронів на останньому енергетичному рівні і чим більший радіус атома, тим
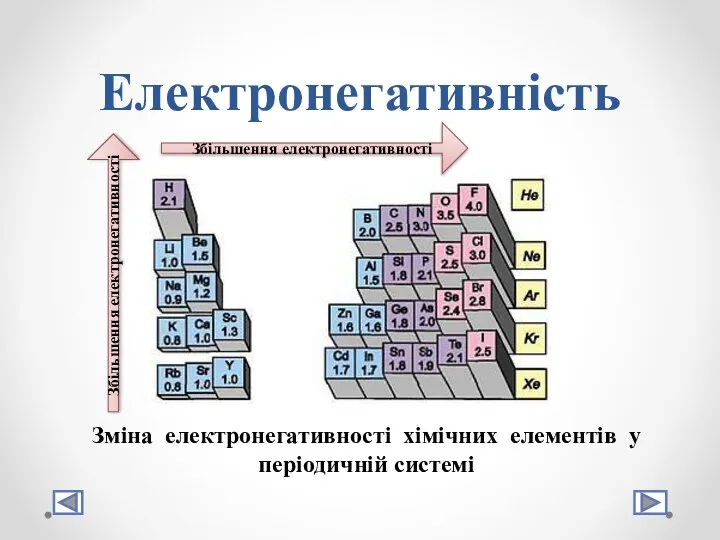
- 7. Електронегативність Електронегативність хімічного елемента (χ) – це властивість його атома притягувати електрони
- 8. Електронегативність Зміна електронегативності хімічних елементів у періодичній системі Збільшення електронегативності Збільшення електронегативності
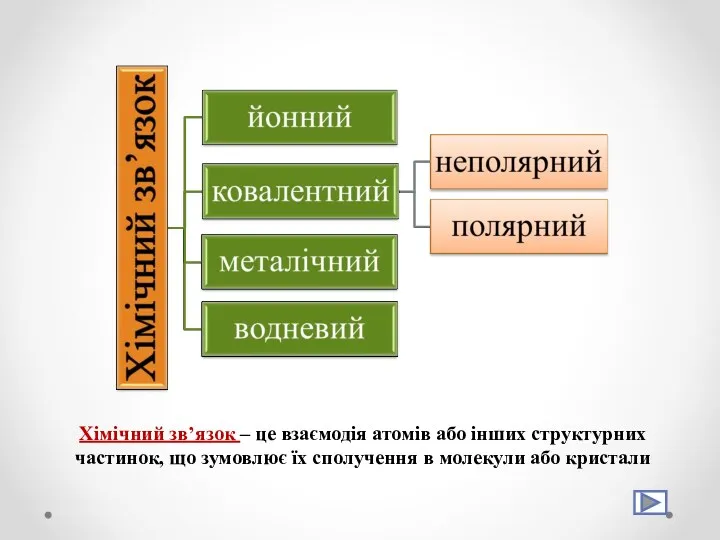
- 9. Хімічний зв’язок – це взаємодія атомів або інших структурних частинок, що зумовлює їх сполучення в молекули
- 10. Ковалентний зв’язок
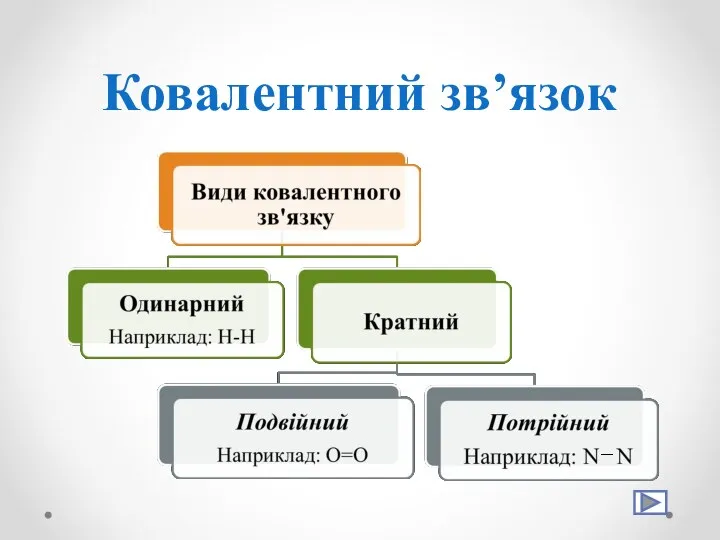
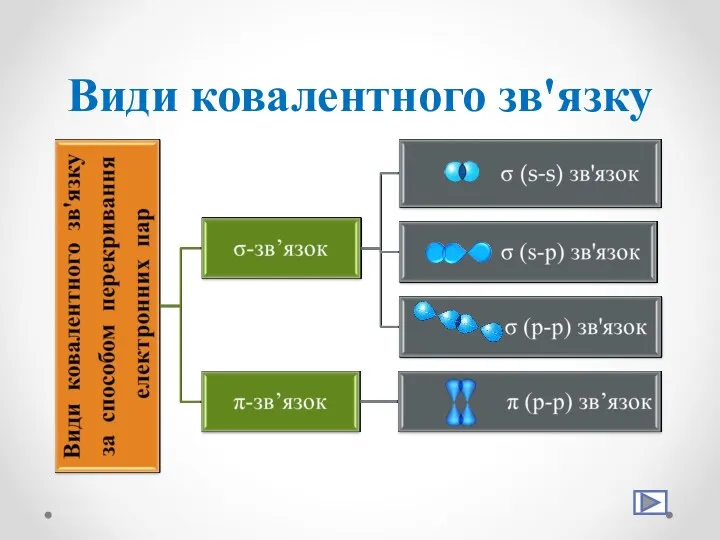
- 11. Види ковалентного зв'язку
- 12. Ковалентний зв’язок Хімічний зв’язок між атомами, зумовлений утворенням спільних електронних пар, називається ковалентним зв'язком
- 13. Ковалентний зв’язок Схема утворення ковалентного неполярного зв'язку Н Н Ковалентний зв’язок у молекулі кисню відео Ковалентний
- 14. Ковалентний зв’язок Ковалентний зв’язок, що виникає між атомами неметалічних елементів з однаковою електронегативністю називається ковалентним неполярним
- 15. Ковалентний зв’язок Схема утворення ковалентного зв'язку Н Cl
- 16. Ковалентний зв’язок Схема утворення ковалентного зв'язку Н Cl Н графічна формула електронна формула ᵟ+ ᵟ-
- 17. Ковалентний зв’язок Утворення ковалентного зв'язку Диполь – система двох зарядів, однакових за величиною і протилежних за
- 18. Ковалентний зв’язок Ковалентний зв’язок, що виникає між атомами неметалічних елементів з різною електронегативністю і їх спільна
- 19. Йонний зв’язок Йонний зв’язок – це зв’язок, що виникає між катіонами та аніонами речовини
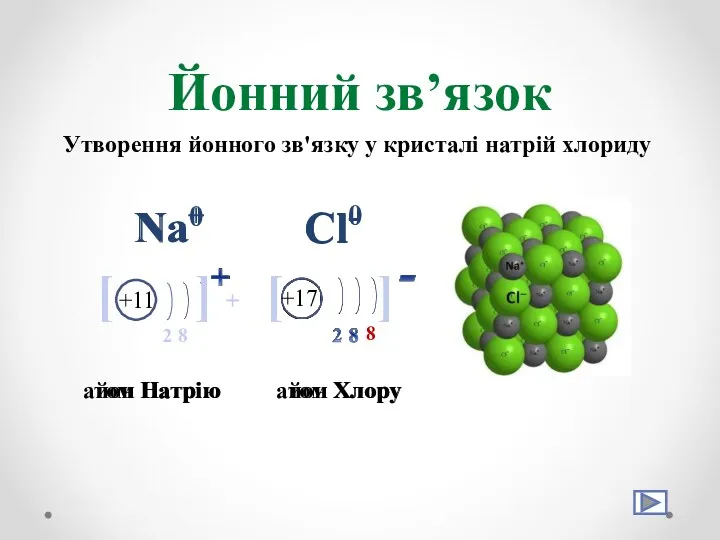
- 20. Йонний зв’язок Утворення йонного зв'язку у кристалі натрій хлориду атом Натрію Na0 +11 8 2 1
- 21. Йонний зв’язок Утворення йонного зв'язку у кристалі натрій хлориду Na0 +11 8 2 + Cl0 +17
- 22. Йонний зв’язок Схема утворення йонного зв’язку Na + Cl ⭢ + Na Cl [ ] -
- 23. Йонний зв’язок Йони – це заряджені частинки, на які перетворюються атоми і молекули внаслідок приєднання або
- 24. Йонний зв’язок Утворення хімічного зв'язку між йонами Натрію і Хлору
- 25. Діаграма Вена Йонний зв’язок Δχ > 1,9 Ковалентний полярний зв'язок Δχ = 0,5…1,9 Різні електроне-гативності хімічних
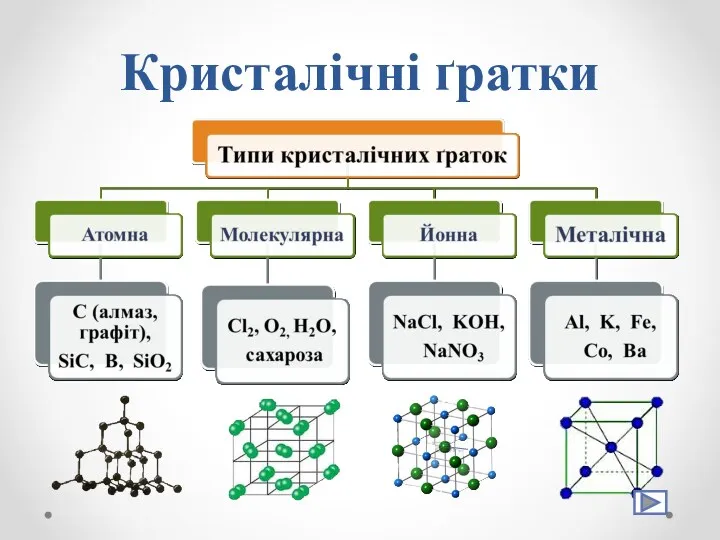
- 26. Кристалічні ґратки Кристалічні ґратки – модель, за допомогою якої описують внутрішню будову кристалів. Точки кристалічних ґраток
- 27. Кристалічні ґратки
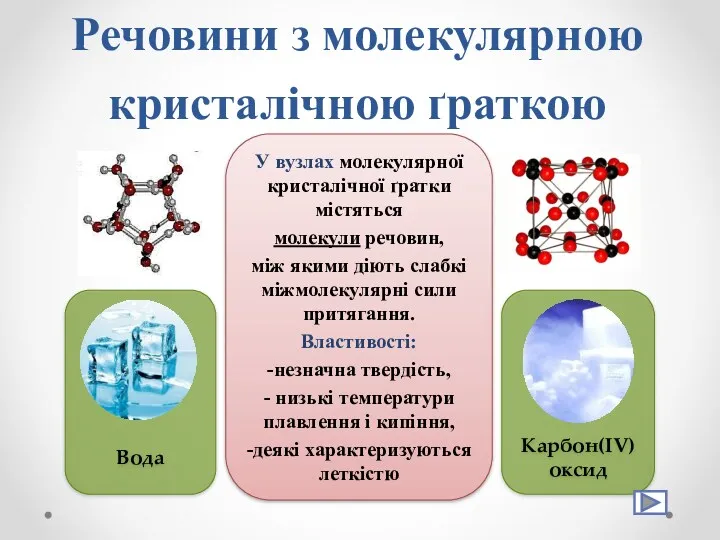
- 28. Йод Речовини з молекулярною кристалічною ґраткою Кисень Бром Сірка Фосфор
- 29. У вузлах молекулярної кристалічної ґратки містяться молекули речовин, між якими діють слабкі міжмолекулярні сили притягання. Властивості:
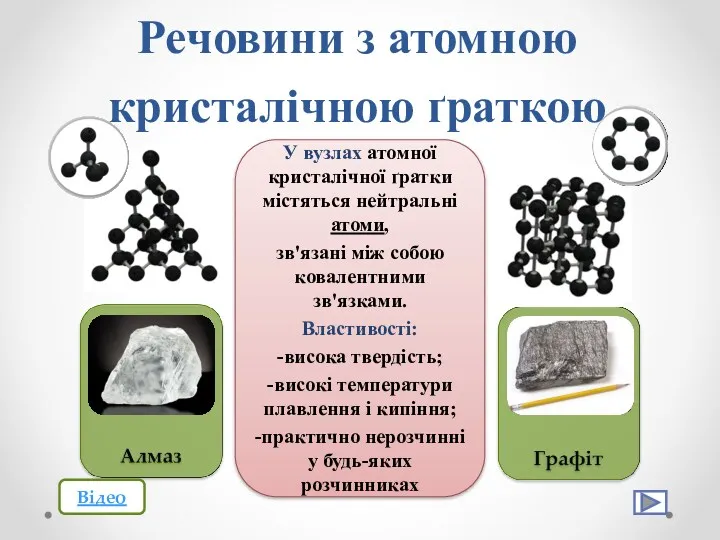
- 30. Речовини з атомною кристалічною ґраткою Алмаз Графіт Бор Кварц Кремній
- 31. Речовини з атомною кристалічною ґраткою У вузлах атомної кристалічної ґратки містяться нейтральні атоми, зв'язані між собою
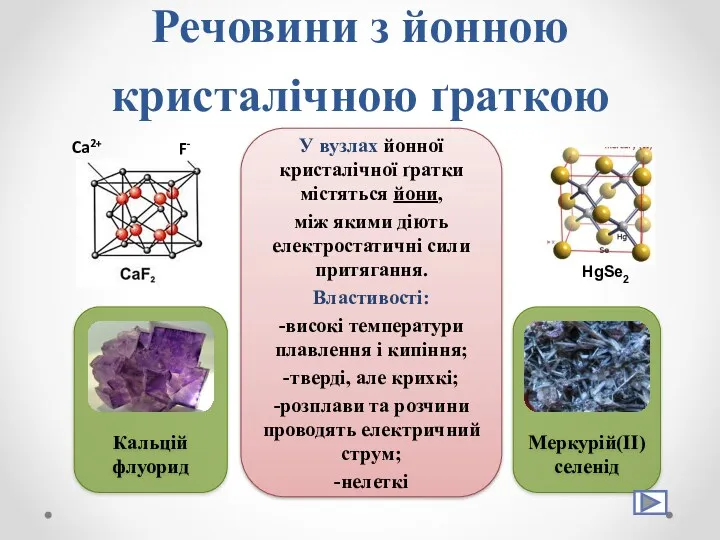
- 32. Речовини з йонною кристалічною ґраткою Кальцій флуорид Стронцій карбонат Купрум(ІІ) сульфат Цезій хлорид Меркурій(ІІ) селенід
- 33. У вузлах йонної кристалічної ґратки містяться йони, між якими діють електростатичні сили притягання. Властивості: -високі температури
- 34. http://LearningApps.org/watch?v=pz27imjat16 http://LearningApps.org/watch?v=psg51u7hj16 http://LearningApps.org/watch?v=pw61i52qa16 http://LearningApps.org/watch?v=pzrqsauda16 Тренувальні вправи
- 36. Скачать презентацию























 Алкены. Непредельные углеводороды
Алкены. Непредельные углеводороды Массовая доля вещества в растворе
Массовая доля вещества в растворе Металлы подгруппы железа Fe, Co, Ni
Металлы подгруппы железа Fe, Co, Ni АЛКАНЫ 9 класс
АЛКАНЫ 9 класс Поддержание заданного качества свинцового теплоносителя для энергетических ядерных реакторов
Поддержание заданного качества свинцового теплоносителя для энергетических ядерных реакторов Гониометрическое исследование кристаллов
Гониометрическое исследование кристаллов Закон сохранения массы веществ. Химические уравнения
Закон сохранения массы веществ. Химические уравнения Растворы. Смеси веществ
Растворы. Смеси веществ Полистирол өндірісі
Полистирол өндірісі Степень загрязнения почвы по химическому составу снежного покрова на разном удалении от источника загрязнения
Степень загрязнения почвы по химическому составу снежного покрова на разном удалении от источника загрязнения Электролиз. Коррозия и защита металлов
Электролиз. Коррозия и защита металлов Коррозия металлов. Методы защиты металлов от коррозии
Коррозия металлов. Методы защиты металлов от коррозии Химия в повседневной жизни
Химия в повседневной жизни Химические формулы
Химические формулы Драгоценные камни
Драгоценные камни Рекомендации по оформлению развёрнутых ответов на задания ЕГЭ
Рекомендации по оформлению развёрнутых ответов на задания ЕГЭ Нано-порошки. Способы получения нано-порошков
Нано-порошки. Способы получения нано-порошков Полимеры и пластические массы
Полимеры и пластические массы Anionic Polymerization
Anionic Polymerization Физико-химические свойства аммиака. Производство аммиака
Физико-химические свойства аммиака. Производство аммиака Обмен липидов
Обмен липидов Кислотно-основные свойства органических соединений. (Лекция 3)
Кислотно-основные свойства органических соединений. (Лекция 3) Массовая доля элемента в сложном веществе
Массовая доля элемента в сложном веществе Типы химических реакций
Типы химических реакций Кислоты. Растворы всех кислот
Кислоты. Растворы всех кислот Периодический закон Д.И. Менделеева. Строение атома. Химическая связь
Периодический закон Д.И. Менделеева. Строение атома. Химическая связь Алюминий
Алюминий Применение спиртов
Применение спиртов