Характеристика элемента по его положению в периодической системе химических элементов (1) презентация
Содержание
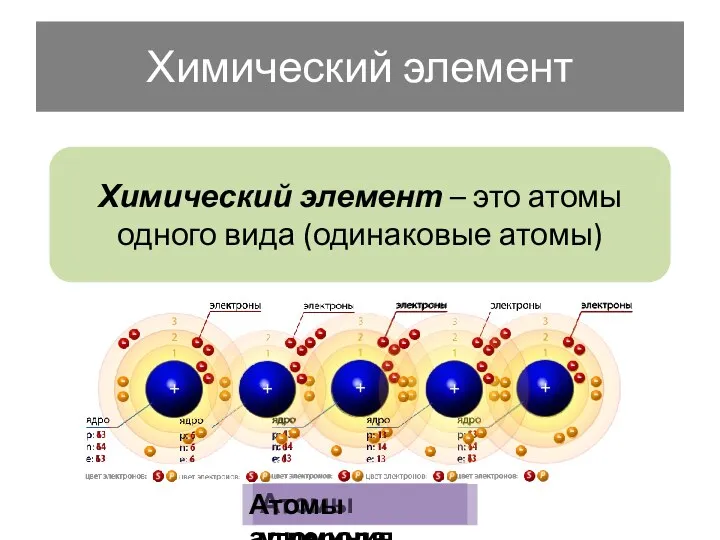
- 2. Химический элемент Химический элемент – это атомы одного вида (одинаковые атомы) Атомы углерода Атомы алюминия
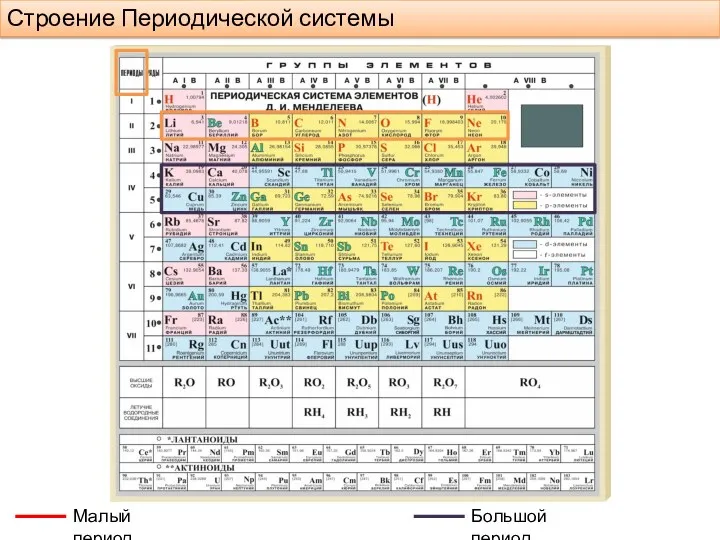
- 3. Строение Периодической системы Малый период Большой период
- 4. Строение Периодической системы
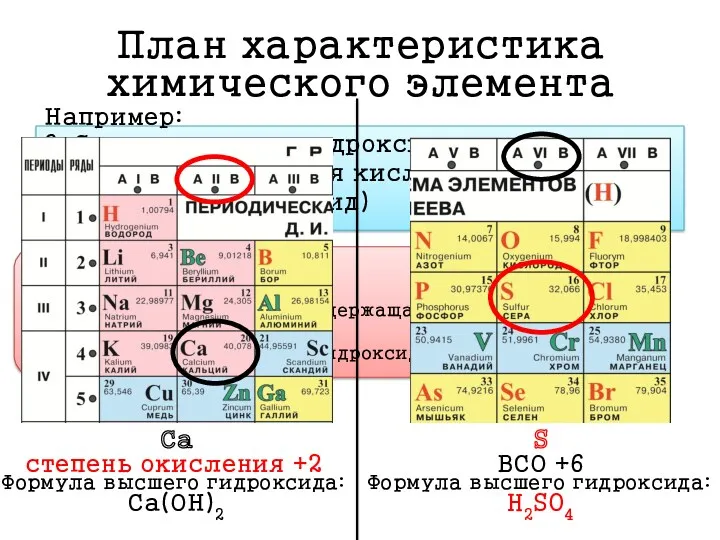
- 5. Алгоритм составления плана характеристики химического элемента: 1. Положение элемента в ПС и строение атома 2. Характеристика
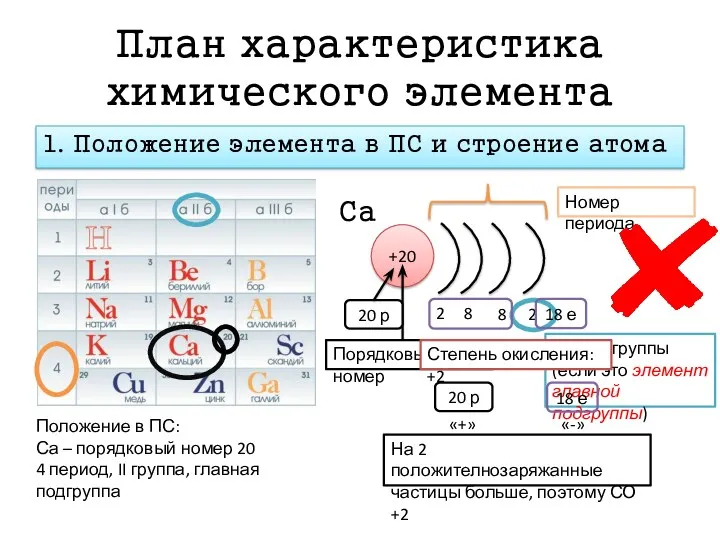
- 6. План характеристика химического элемента 1. Положение элемента в ПС и строение атома Положение в ПС: Са
- 7. План характеристика химического элемента 2. Характеристика простого вещества (Ме/НеМе) Металлы Неметаллы Только для элементов главных подгрупп!!!
- 8. План характеристика химического элемента 3. Сравнение свойств простого вещества со свойствами простых веществ – соседей по
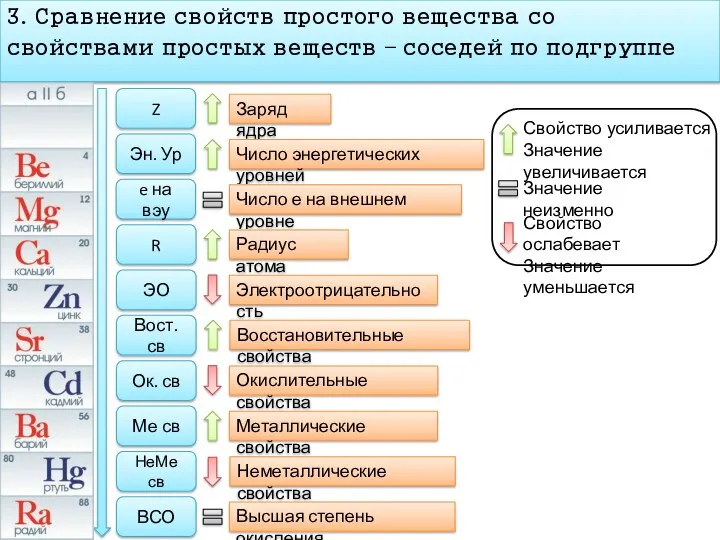
- 9. 3. Сравнение свойств простого вещества со свойствами простых веществ – соседей по подгруппе Z Эн. Ур
- 10. 3. Сравнение свойств простого вещества со свойствами простых веществ – соседей по подгруппе Z Эн. Ур
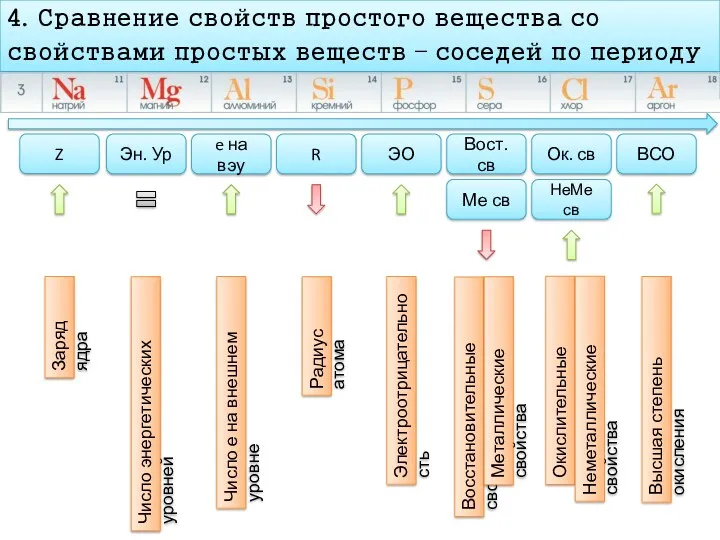
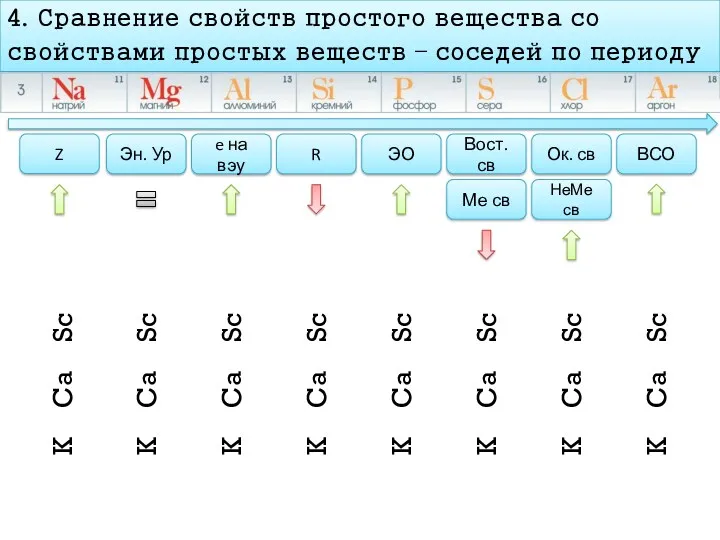
- 11. План характеристика химического элемента 4. Сравнение свойств простого вещества со свойствами простых веществ – соседей по
- 12. 4. Сравнение свойств простого вещества со свойствами простых веществ – соседей по периоду Z Эн. Ур
- 13. 4. Сравнение свойств простого вещества со свойствами простых веществ – соседей по периоду Z Эн. Ур
- 14. План характеристика химического элемента 5. Состав высшего оксида, его характер (основный, кислотный, амфотерный)
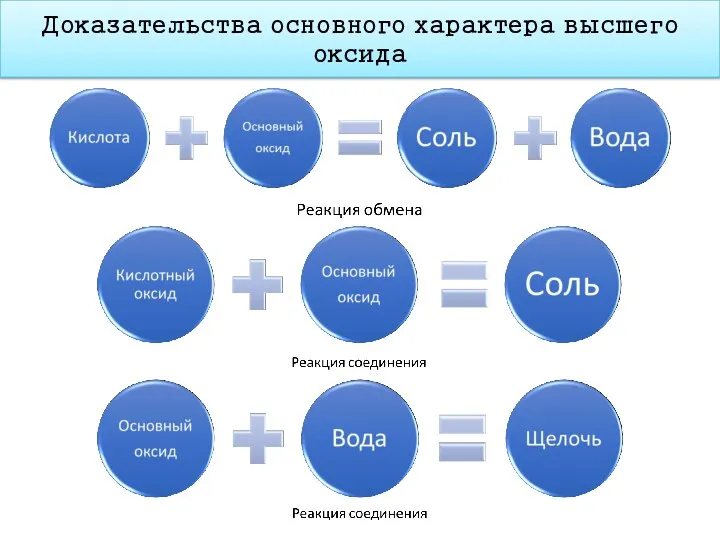
- 15. Доказательства основного характера высшего оксида
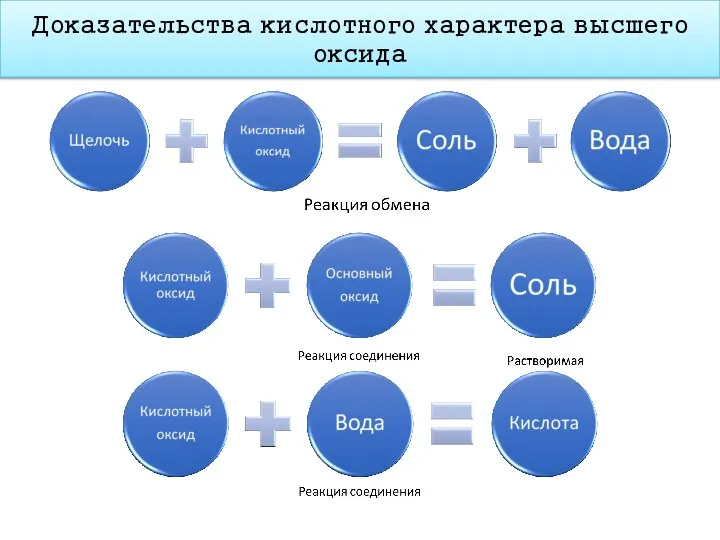
- 16. Доказательства кислотного характера высшего оксида
- 17. 6. Состав высшего гидроксида, его характер (кислородсодержащая кислота, основание, амфотерный гидроксид) План характеристика химического элемента Гидроксид
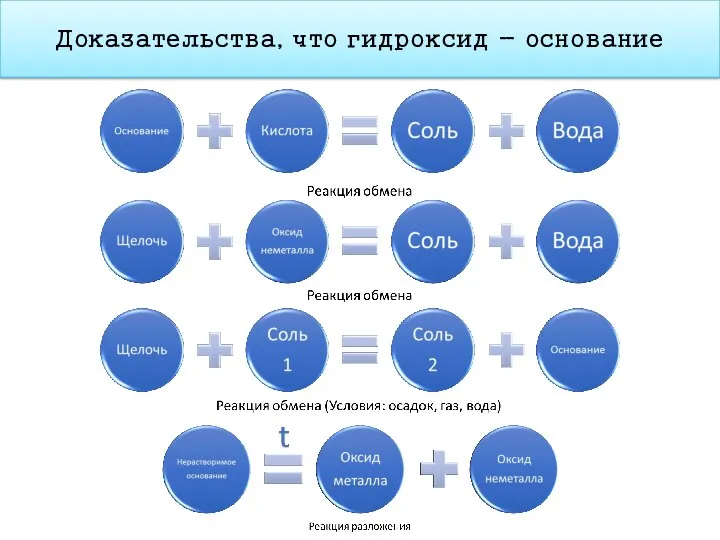
- 18. Доказательства, что гидроксид - основание
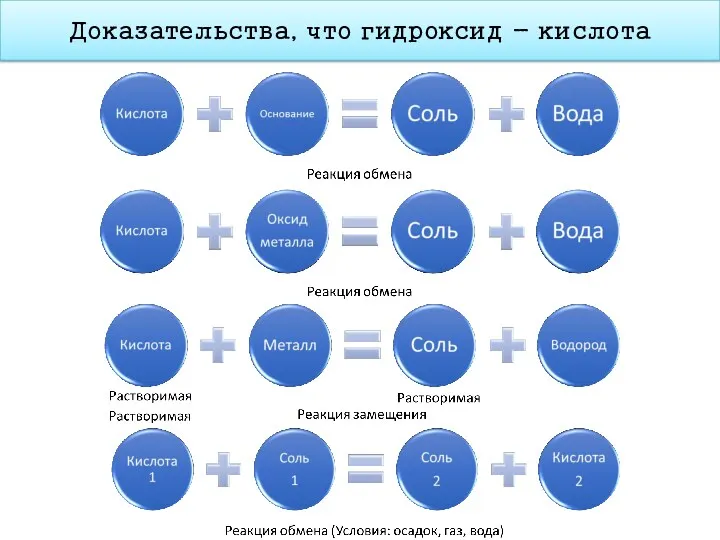
- 19. Доказательства, что гидроксид - кислота
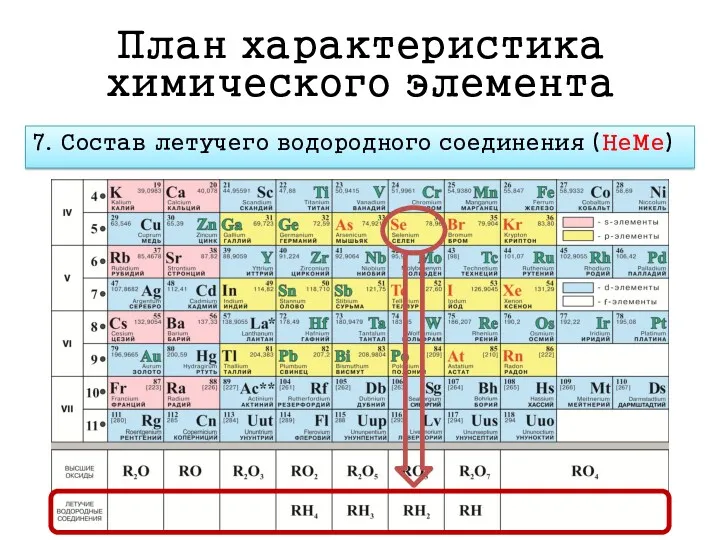
- 20. План характеристика химического элемента 7. Состав летучего водородного соединения (НеМе)
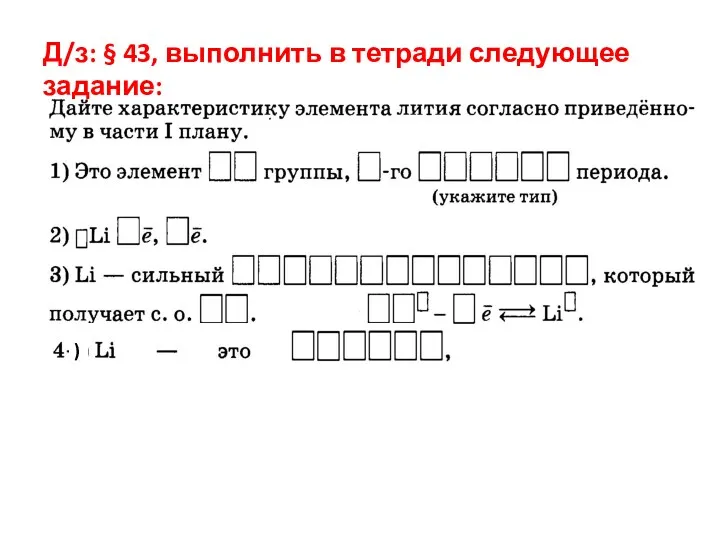
- 21. Д/з: § 43, выполнить в тетради следующее задание:
- 22. Д/з: § 43, выполнить в тетради следующее задание: )
- 23. 8) 6) 7) 5)
- 25. Скачать презентацию








 О проекте концепции преподавания химии в РФ
О проекте концепции преподавания химии в РФ Способы выражения состава растворов
Способы выражения состава растворов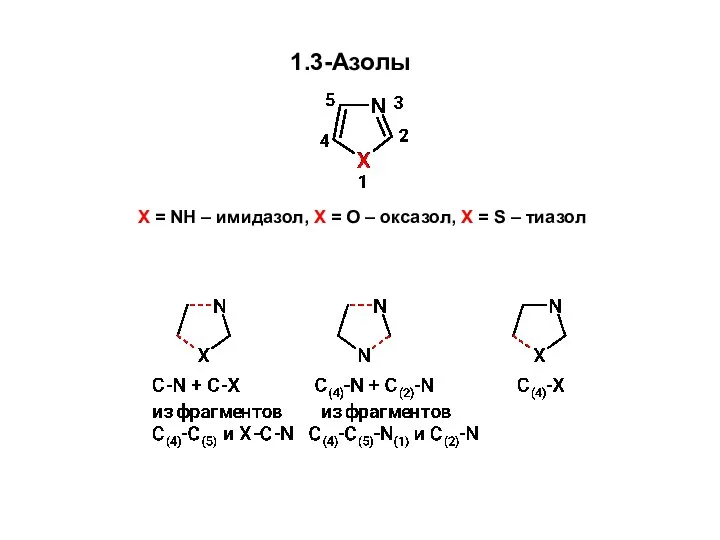 Образование связей C-N и C-X Синтез 1,3-азолов из углеродного фрагмента С(4)-С(5) и фрагмента X-C-N
Образование связей C-N и C-X Синтез 1,3-азолов из углеродного фрагмента С(4)-С(5) и фрагмента X-C-N Периодический закон Д.И. Менделеева
Периодический закон Д.И. Менделеева Минералды тыңайтқыштар өндірісі
Минералды тыңайтқыштар өндірісі Оксиды и гидроксиды
Оксиды и гидроксиды Органическая химия – химия соединений углерода
Органическая химия – химия соединений углерода Алкани
Алкани Углеводы. Урок №9. 9 класс
Углеводы. Урок №9. 9 класс Протекание ОВР зависит от рН среды
Протекание ОВР зависит от рН среды Кривые титрования: построение и анализ (лекция 6)
Кривые титрования: построение и анализ (лекция 6) Основные и опасные свойства природного газа
Основные и опасные свойства природного газа Литий. Общая характеристика элементов подгруппы 1А
Литий. Общая характеристика элементов подгруппы 1А Строение атома. Периодический закон Д. И. Менделеева
Строение атома. Периодический закон Д. И. Менделеева Химические фундаментные болты
Химические фундаментные болты Характер затвердевания
Характер затвердевания Понятие Химический элемент
Понятие Химический элемент Хімічний зв'язок і будова речовини
Хімічний зв'язок і будова речовини Спирты, фенолы, простые эфиры и их тиоаналоги. (Лекция 9)
Спирты, фенолы, простые эфиры и их тиоаналоги. (Лекция 9) Кристаллохимия негіздері
Кристаллохимия негіздері Алюминий и его свойства
Алюминий и его свойства Новые интеллектуальные материалы на основе полимеров
Новые интеллектуальные материалы на основе полимеров Глины каолиновые и каолино-гидрослюдистые
Глины каолиновые и каолино-гидрослюдистые Сульфур. Характеристика елемента та утворених ним сполук, кругообіг елемента в природі
Сульфур. Характеристика елемента та утворених ним сполук, кругообіг елемента в природі Единство химической организации живых организмов
Единство химической организации живых организмов Альдегиды и кетоны
Альдегиды и кетоны Введение. Методы и средства обучения химии
Введение. Методы и средства обучения химии