Содержание
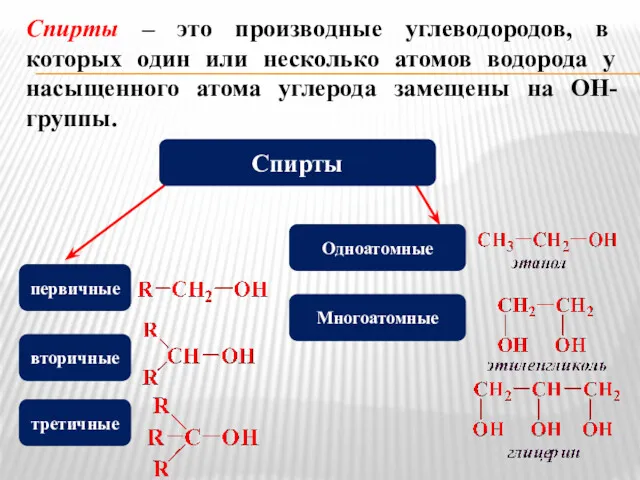
- 2. Спирты – это производные углеводородов, в которых один или несколько атомов водорода у насыщенного атома углерода
- 3. Способы получения одноатомных спиртов Гидратация алкенов Щелочной гидролиз галогенпроизводных Восстановление карбонильных соединений
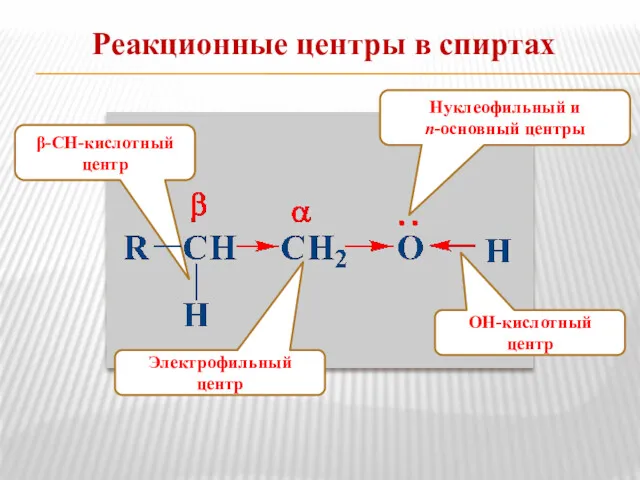
- 4. Реакционные центры в спиртах Электрофильный центр β-СН-кислотный центр ОН-кислотный центр Нуклеофильный и n-основный центры
- 5. Кислотные свойства спиртов Одноатомные спирты – слабые ОН-кислоты, реагируют только с активными металлами, образуя соли -
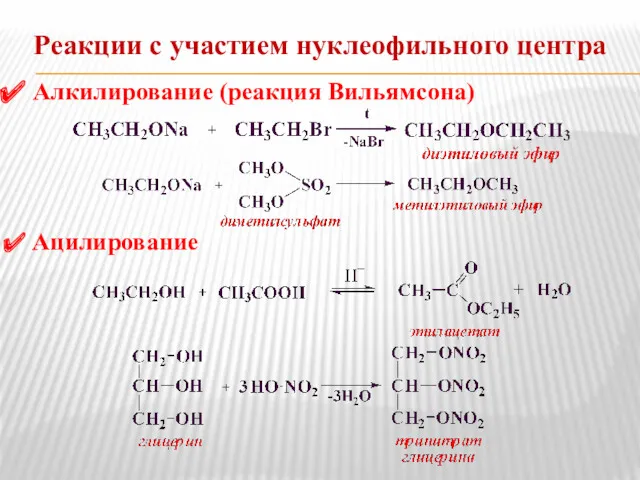
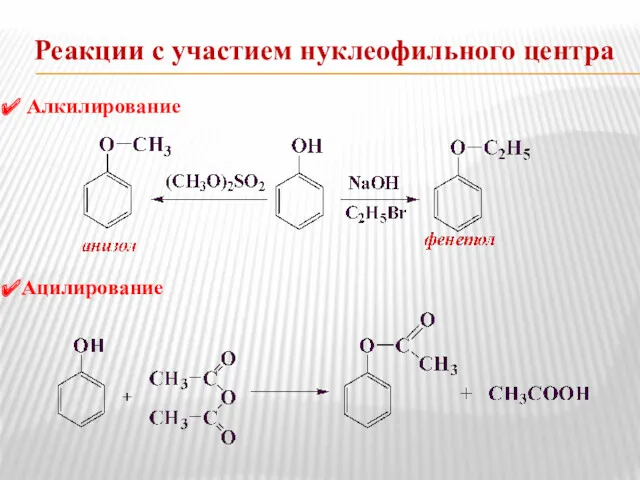
- 6. Реакции с участием нуклеофильного центра Алкилирование (реакция Вильямсона) Ацилирование
- 7. Реакции с участием электрофильного центра ОН-группа является плохо уходящей группой, поэтому , чтобы ее заместить, необходимо
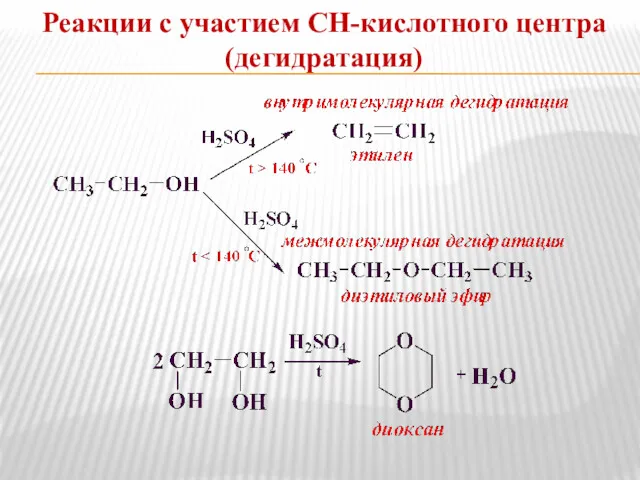
- 8. Реакции с участием СН-кислотного центра (дегидратация)
- 9. Окисление спиртов Первичные спирты окисляются до альдегидов, а затем – до карбоновых кислот Вторичные спирты окисляются
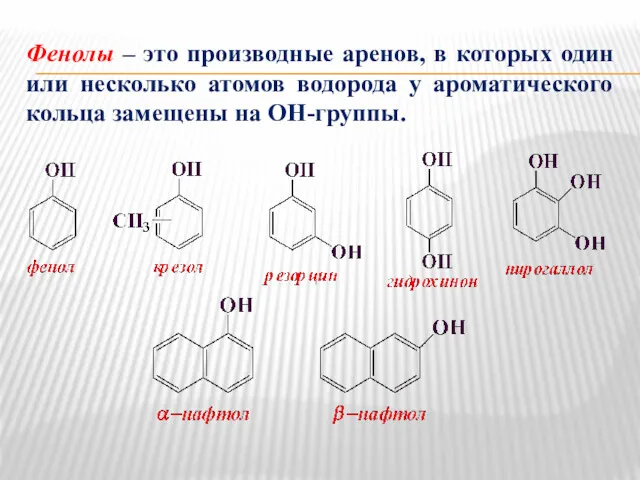
- 10. Фенолы – это производные аренов, в которых один или несколько атомов водорода у ароматического кольца замещены
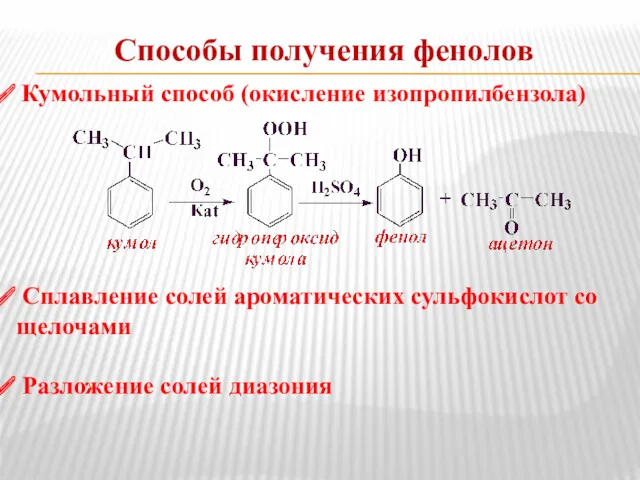
- 11. Способы получения фенолов Кумольный способ (окисление изопропилбензола) Сплавление солей ароматических сульфокислот со щелочами Разложение солей диазония
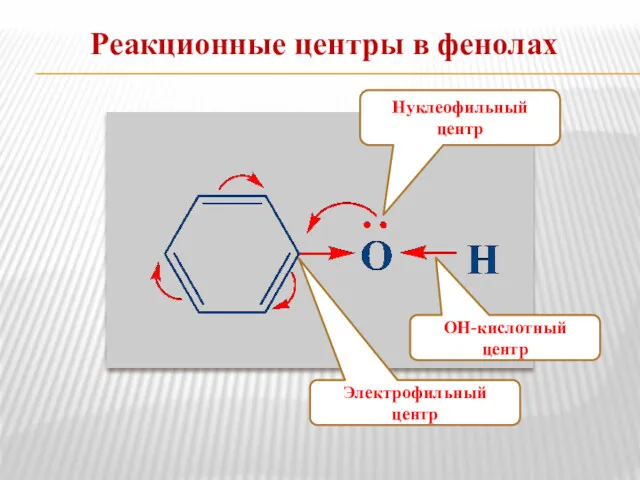
- 12. Реакционные центры в фенолах Электрофильный центр ОН-кислотный центр Нуклеофильный центр
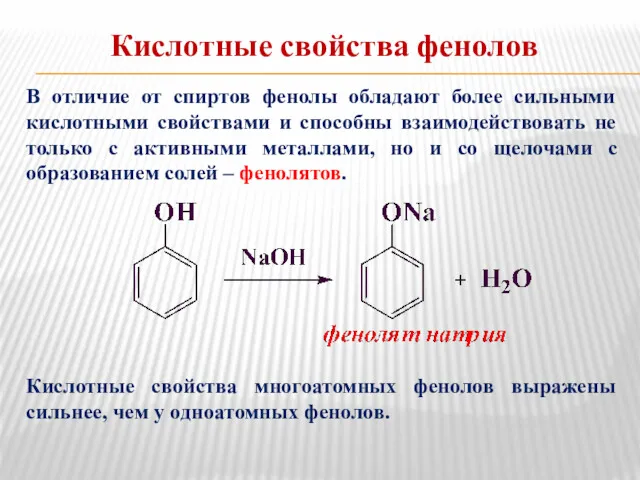
- 13. Кислотные свойства фенолов В отличие от спиртов фенолы обладают более сильными кислотными свойствами и способны взаимодействовать
- 14. Реакции с участием нуклеофильного центра Алкилирование Ацилирование
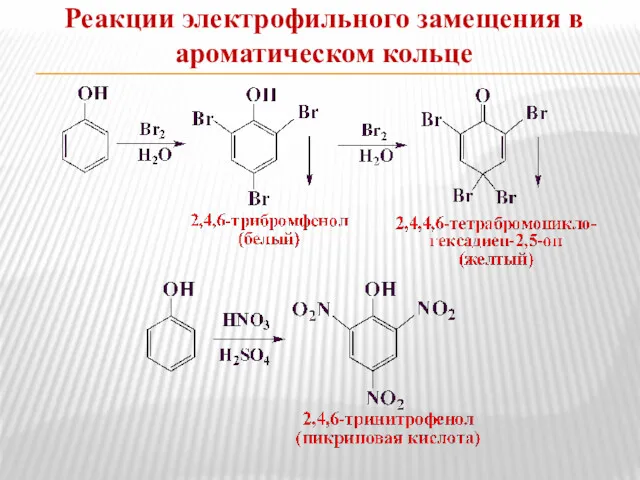
- 15. Реакции электрофильного замещения в ароматическом кольце
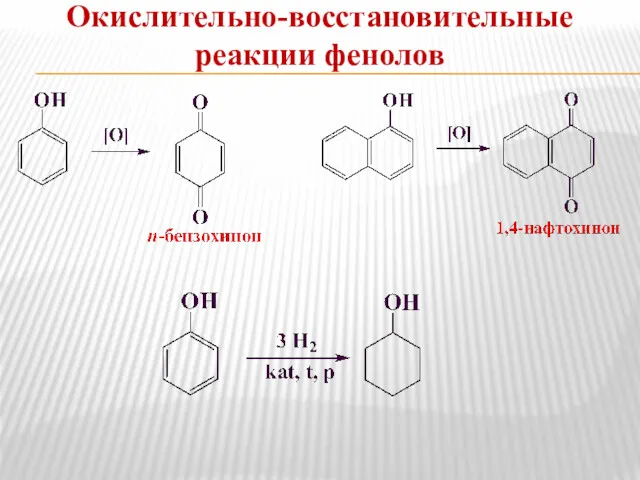
- 16. Окислительно-восстановительные реакции фенолов
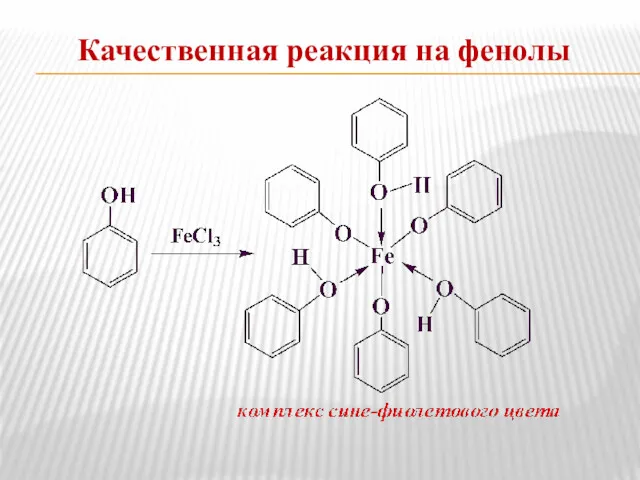
- 17. Качественная реакция на фенолы
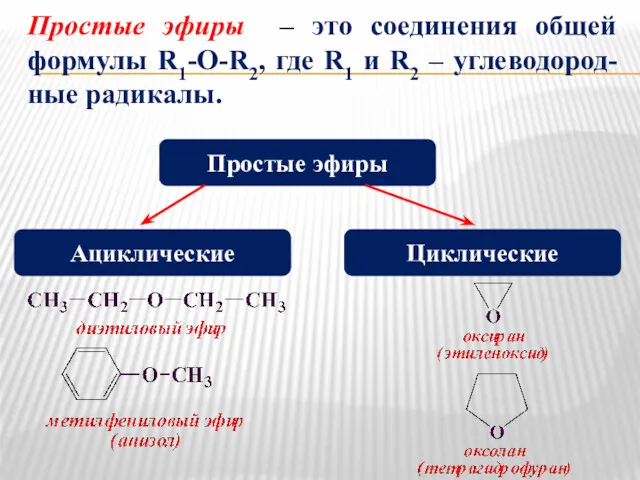
- 18. Простые эфиры – это соединения общей формулы R1-O-R2, где R1 и R2 – углеводород-ные радикалы. Простые
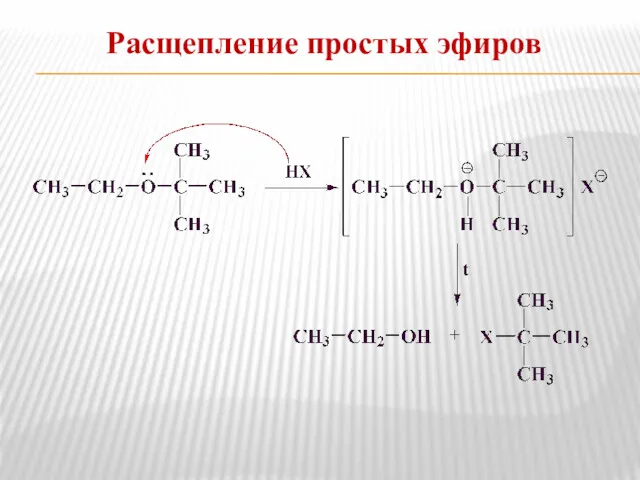
- 19. Расщепление простых эфиров
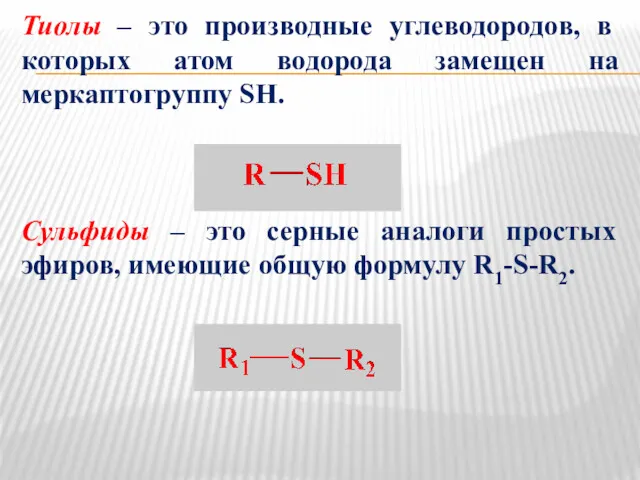
- 20. Тиолы – это производные углеводородов, в которых атом водорода замещен на меркаптогруппу SH. Сульфиды – это
- 21. Кислотные свойства тиолов Тиолы обладают повышенной кислотностью по сравнению со спиртами, реагируют как с активными металлами,
- 23. Скачать презентацию





 Антибиотики как ЛС
Антибиотики как ЛС Непредельные углеводороды
Непредельные углеводороды Открытие хлора
Открытие хлора Сложные вопросы ЕГЭ по химии
Сложные вопросы ЕГЭ по химии Полимерные материалы (ПМ). Классификация ПМ
Полимерные материалы (ПМ). Классификация ПМ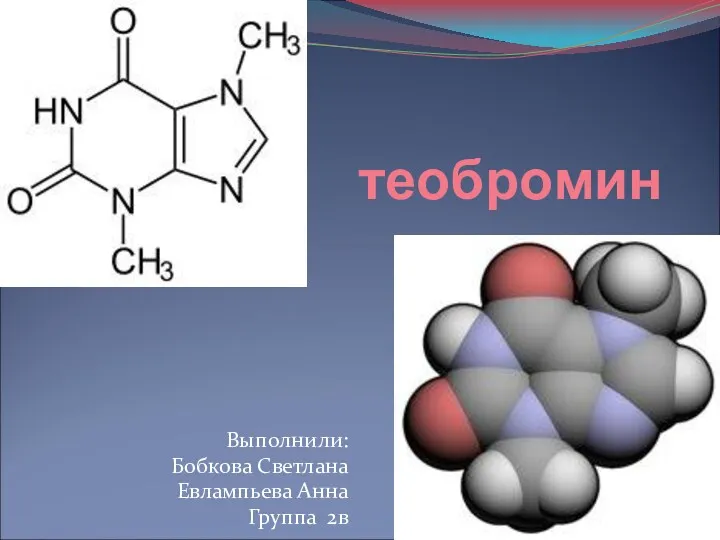 Теобромин
Теобромин Полимеры. Классификация. Строение
Полимеры. Классификация. Строение Аминокислоты. Пептиды. Белки
Аминокислоты. Пептиды. Белки Вода - вещество обычное или необычное
Вода - вещество обычное или необычное Липиды (Жиры)
Липиды (Жиры) Периодическая система химических элементов Д.И. Менделеева
Периодическая система химических элементов Д.И. Менделеева Карбоновые кислоты
Карбоновые кислоты Аммиак. Строение атома азота
Аммиак. Строение атома азота Химический тренажер. Химические элементы
Химический тренажер. Химические элементы Edexcel organic reaction mechanisms
Edexcel organic reaction mechanisms Галогены. Свойства
Галогены. Свойства Physical chemistry of nanostructured systems
Physical chemistry of nanostructured systems Бинарные соединения: оксиды, гидриды
Бинарные соединения: оксиды, гидриды Основания. 8 класс
Основания. 8 класс Химическая связь. 8 класс
Химическая связь. 8 класс Электролитическая диссоциация
Электролитическая диссоциация Природные источники углеводородов и их переработка
Природные источники углеводородов и их переработка Составление формул химических соединений
Составление формул химических соединений Превращение веществ
Превращение веществ 20231011_8_klass_binarnye_soedineniya
20231011_8_klass_binarnye_soedineniya 20230306_oksidy
20230306_oksidy Полимеры. Пластмассы. Волокна
Полимеры. Пластмассы. Волокна Кислород. Оксиды. Валентность
Кислород. Оксиды. Валентность