Содержание
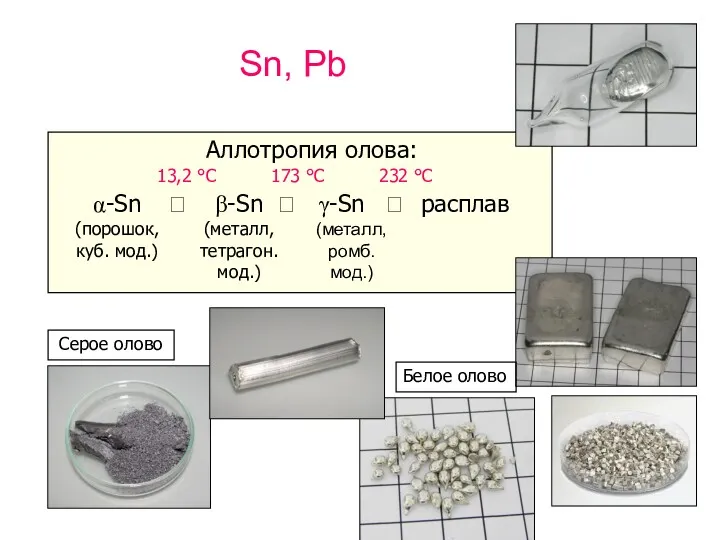
- 2. Sn, Pb Аллотропия олова: α-Sn (порошок,куб. мод.) ⮀ 13,2 °С β-Sn (металл, тетрагон. мод.) ⮀ γ-Sn
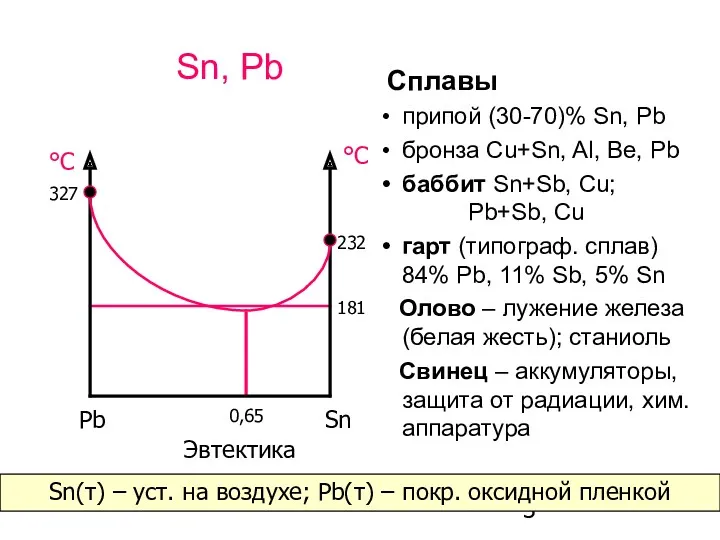
- 3. Sn, Pb Cплавы припой (30-70)% Sn, Pb бронза Cu+Sn, Al, Be, Pb баббит Sn+Sb, Cu; Pb+Sb,
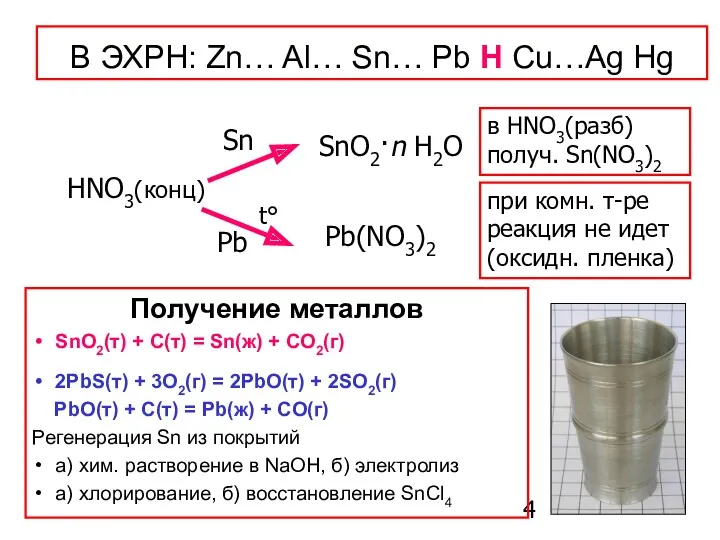
- 4. Получение металлов SnO2(т) + C(т) = Sn(ж) + CO2(г) 2PbS(т) + 3O2(г) = 2PbO(т) + 2SO2(г)
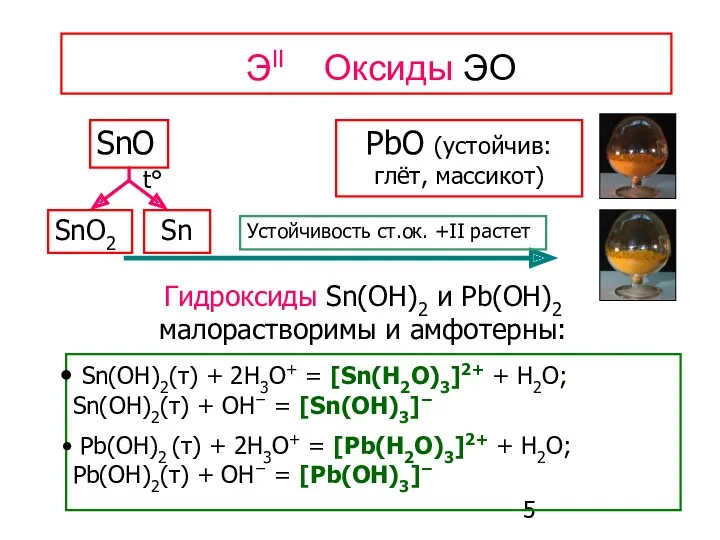
- 5. ЭII Оксиды ЭО SnO PbO (устойчив: глёт, массикот) Sn(OH)2(т) + 2H3O+ = [Sn(H2O)3]2+ + H2O; Sn(OH)2(т)
- 6. Аквакатионы ЭII [Э(H2O)3]2+ + H2O ⮀ [Э(H2O)2(OH)]+ + H3O+ SnII – сильный комплексообразователь (координирует ионы Cl–
- 7. [Pb2+]: PbSO4 > PbCrO4 > PbS PbSO4(т) + CrO42– = PbCrO4(т) + SO42– белый желтый PbCrO4(т)
- 8. амфотерные с преобладанием кислотных свойств полигидраты ЭO2.n H2O (уст. при рН ЭO2.n H2O + 2OH− =
- 9. Окислительно-восстановительные свойства Sn2+ – мягкий восстановитель рН ϕ° = +0,14 B рН > 7: [Sn(OH)3]− +
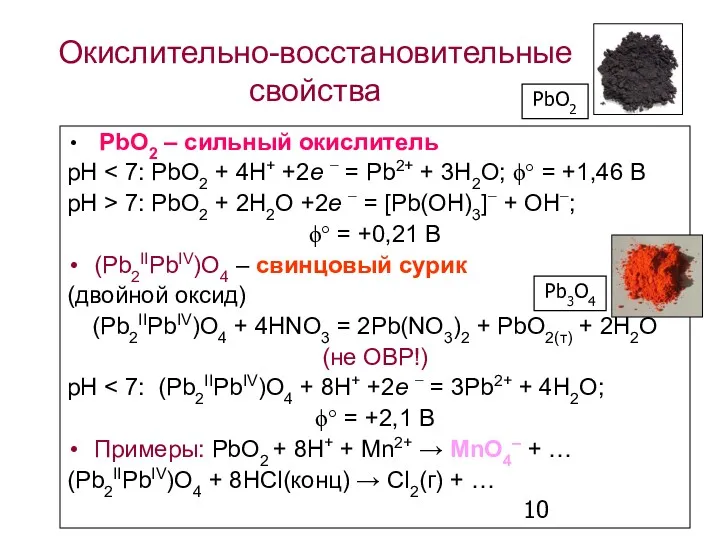
- 10. Окислительно-восстановительные свойства PbO2 – сильный окислитель рН рН > 7: PbO2 + 2H2O +2e − =
- 12. Скачать презентацию
![Аквакатионы ЭII [Э(H2O)3]2+ + H2O ⮀ [Э(H2O)2(OH)]+ + H3O+ SnII](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/226111/slide-5.jpg)
![[Pb2+]: PbSO4 > PbCrO4 > PbS PbSO4(т) + CrO42– =](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/226111/slide-6.jpg)


 Смог и его виды
Смог и его виды Химический эквивалент. Формульные единицы
Химический эквивалент. Формульные единицы Кристаллические решетки. Кристаллические вещества
Кристаллические решетки. Кристаллические вещества Уравнения химических реакций. Алгоритм расстановки коэффициентов
Уравнения химических реакций. Алгоритм расстановки коэффициентов Свинец
Свинец Строительное материаловедение. (Лекции 1-2)
Строительное материаловедение. (Лекции 1-2) Летучие органические соединения (ЛОС)
Летучие органические соединения (ЛОС) Общая схема радиолиза алифатических углеводородов. Радиолиз органических кислот. Радиолиз кетонов эфиров
Общая схема радиолиза алифатических углеводородов. Радиолиз органических кислот. Радиолиз кетонов эфиров Механизм реакции в органической химии
Механизм реакции в органической химии Агрегатные состояния вещества
Агрегатные состояния вещества Чистые вещества и смеси
Чистые вещества и смеси Атомы, молекулы и ионы
Атомы, молекулы и ионы №2 Практикалық жұмыс. Химиялық реакция жылдамдығына әртүрлі факторлардың әсерін зерттеу
№2 Практикалық жұмыс. Химиялық реакция жылдамдығына әртүрлі факторлардың әсерін зерттеу Обмен простых белков. Дезаминирование и трансаминирование аминокислот
Обмен простых белков. Дезаминирование и трансаминирование аминокислот Ионная химическая связь
Ионная химическая связь Виды химических реакций
Виды химических реакций Кислоты. Определение рН кислоты, щелочи, воды
Кислоты. Определение рН кислоты, щелочи, воды Кристалічні ґратки. Залежність фізичних властивостей речовини від типів кристалічних ґраток
Кристалічні ґратки. Залежність фізичних властивостей речовини від типів кристалічних ґраток Кристалы и их свойства
Кристалы и их свойства Фармацевтический анализ лекарственных средств группы алкилуреидов сульфокислот
Фармацевтический анализ лекарственных средств группы алкилуреидов сульфокислот Атомы, молекулы и ионы. Вещества молекулярного и немолекулярного строения
Атомы, молекулы и ионы. Вещества молекулярного и немолекулярного строения Поняття про багатоатомні спирти на прикладі гліцеролу, його хімічні властивості
Поняття про багатоатомні спирти на прикладі гліцеролу, його хімічні властивості Оксигеновмісні сполуки. Одноатомні та багатоатомні спирти. Феноли. Лекція №6
Оксигеновмісні сполуки. Одноатомні та багатоатомні спирти. Феноли. Лекція №6 Факторы, влияющие на скорость химической реакции
Факторы, влияющие на скорость химической реакции Водород H2
Водород H2 Окислительно-восстановительные реакции. Урок в 11 классе
Окислительно-восстановительные реакции. Урок в 11 классе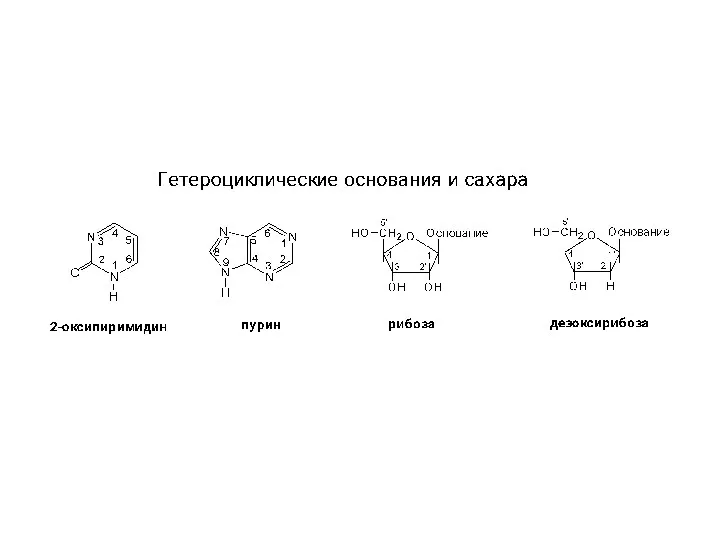 Структура гетероциклов, нуклеозидов и нуклеотидов
Структура гетероциклов, нуклеозидов и нуклеотидов Окислительно-восстановительные реакции
Окислительно-восстановительные реакции