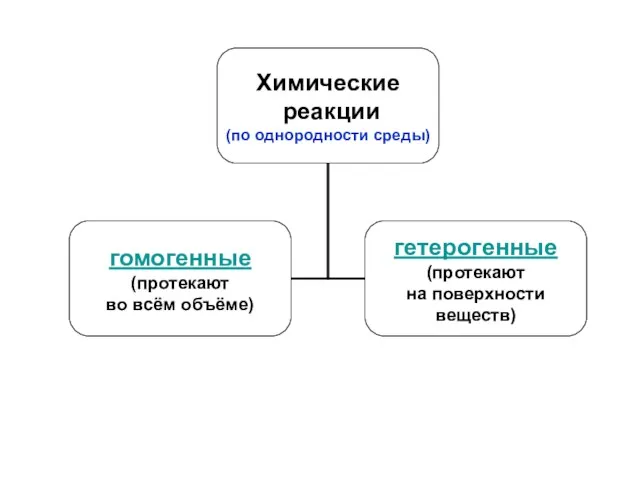
Содержание
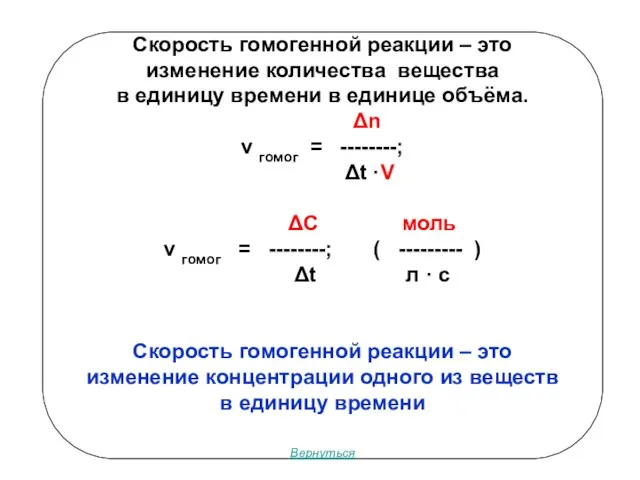
- 3. Скорость гомогенной реакции – это изменение количества вещества в единицу времени в единице объёма. Δn v
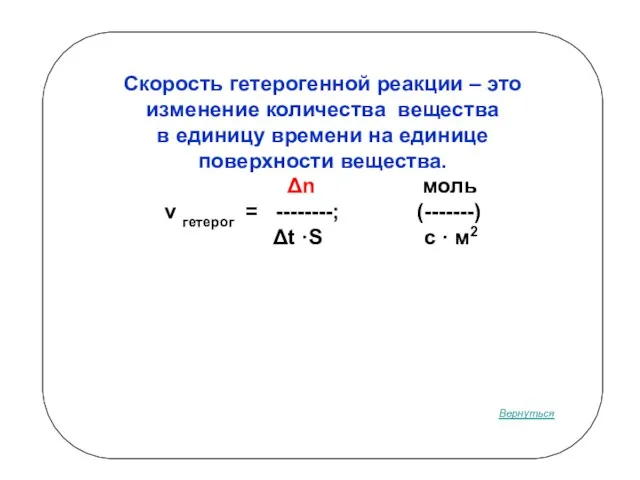
- 4. Скорость гетерогенной реакции – это изменение количества вещества в единицу времени на единице поверхности вещества. Δn
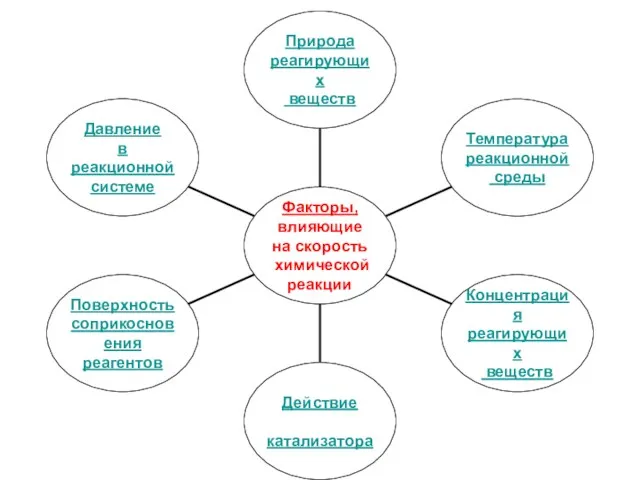
- 6. Природа реагирующих веществ (строение атома, тип химической связи, вид частиц вещества) Быстро! 2Li +H20 = 2LiOH
- 7. Температура реакционной среды Скорость большинства химических реакций при повышении температуры увеличивается.
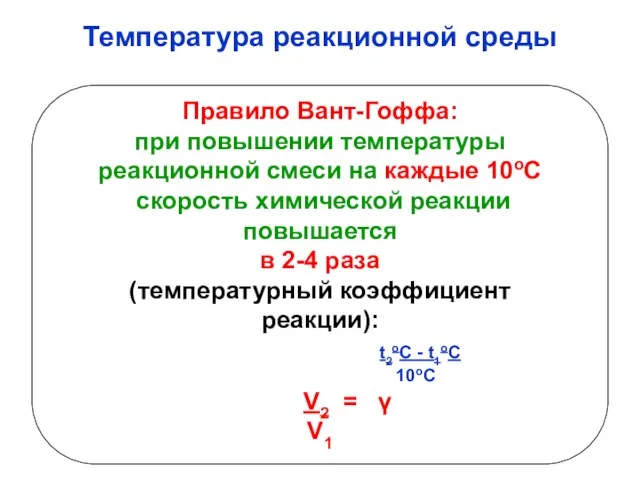
- 8. Температура реакционной среды Правило Вант-Гоффа: при повышении температуры реакционной смеси на каждые 10оС скорость химической реакции
- 9. Упражнение по решению задач Во сколько раз увеличится скорость химической реакции, если температура реакционной среды возрастёт
- 10. Упражнение по решению задач При 142 оС скорость реакции равна 16 моль/л·с. Вычислите скорость реакции при112
- 11. Упражнение по решению задач При 108оС химическая реакция идёт 246 минут. При какой температуре эта же
- 12. Концентрация реагирующих веществ Скорость гомогенной химической реакции пропорциональна произведению концентраций реагирующих веществ, возведённых в степени, равные
- 13. Концентрация реагирующих веществ 2A+B=D+3E (гомогенная) V=k·C2A·CB 3A+2B=3D+E (гомогенная) V=k·C3A·C2B 3Aгаз+2Bтв=3D+E (гетерогенная) V=k·C3A Закон действующих масс не
- 14. Упражнение по решению задач Во сколько раз изменится скорость реакции 2 H2 (г) + O2 (г)
- 15. Упражнение по решению задач Во сколько раз изменится скорость реакции СH4 (г) + СO2 (г) =
- 16. Упражнение по решению задач Во сколько раз изменится скорость реакции 2 NO2 (г) = N2O4 (г)
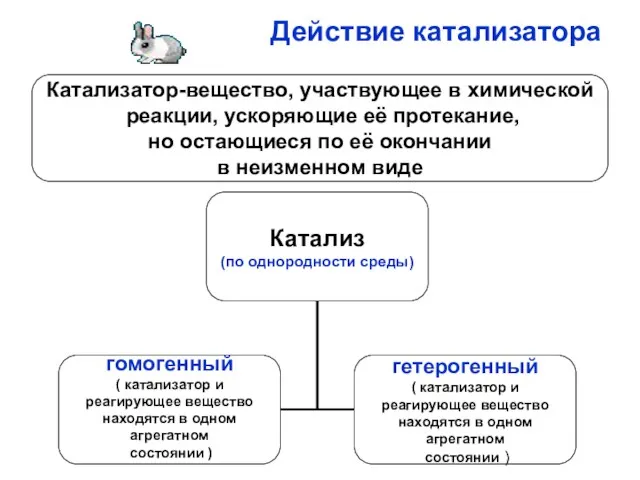
- 17. Действие катализатора Катализатор-вещество, участвующее в химической реакции, ускоряющие её протекание, но остающиеся по её окончании в
- 18. Действие катализатора Гомогенный катализ: NO 2SO2 + O2 = 2SO3 (газовая среда) MnSO4 2KMnO2+5K2SO3+3H2SO4 = 2MnSO4+K2SO4
- 19. Поверхность соприкосновения реагентов Фактор играет важную роль при протекании гетерогенных реакций. Для увеличения поверхности соприкосновения исходные
- 20. Давление в реакционной системе Изменение давления влияет на скорость только тех химических реакций, в которых участвует
- 21. Упражнение по решению задач Во сколько раз изменится скорость реакции FeO (т) + CO (г) =
- 29. Скачать презентацию




















 Биогенді (s.p.d) элементтермен олардың қосылыстарының медициналық және биологиялық маңызы
Биогенді (s.p.d) элементтермен олардың қосылыстарының медициналық және биологиялық маңызы Кислоты, их состав и названия
Кислоты, их состав и названия Карбоновые кислоты и их функциональные производные
Карбоновые кислоты и их функциональные производные Ароматические углеводороды
Ароматические углеводороды Гетерофазный катализ. (Лекция 20)
Гетерофазный катализ. (Лекция 20) Горение топлива
Горение топлива Використання радіоактивних ізотопів, як індикаторів у тваринництві і археології
Використання радіоактивних ізотопів, як індикаторів у тваринництві і археології Основные классы неорганических соединений
Основные классы неорганических соединений Соли, их классификация и свойства
Соли, их классификация и свойства Органічна хімія
Органічна хімія Розв’язування задач за рівняннями реакцій з використанням розчинів із певною масовою часткою розчиненої речовини. Урок 13-14
Розв’язування задач за рівняннями реакцій з використанням розчинів із певною масовою часткою розчиненої речовини. Урок 13-14 Жёсткость воды
Жёсткость воды Полисахариды: крахмал и целлюлоза
Полисахариды: крахмал и целлюлоза Растворы. Часть 2. Лекция №7
Растворы. Часть 2. Лекция №7 Химия атмосферы. Химические процессы в тропосфере
Химия атмосферы. Химические процессы в тропосфере Буферные системы
Буферные системы Белки. Строение
Белки. Строение Классификация химических элементов. Составитель. 8 класс
Классификация химических элементов. Составитель. 8 класс Минералы для ИЗБ
Минералы для ИЗБ Концентрация растворов. Массовая доля растворенного вещества. Урок 1
Концентрация растворов. Массовая доля растворенного вещества. Урок 1 Химический элемент медь
Химический элемент медь Кинетика химических реакций
Кинетика химических реакций Кремний и его соединения
Кремний и его соединения Галогены. Расположите галогены в порядке их открытия
Галогены. Расположите галогены в порядке их открытия Важнейшие реакции в органической химии
Важнейшие реакции в органической химии Технология производства аминоальдегидных смол
Технология производства аминоальдегидных смол Углерод. Физические и химические свойства
Углерод. Физические и химические свойства Гидролиз солей
Гидролиз солей