Содержание
- 2. Классификация реакций Протекающие без изменения степени окисления Ag +1Cl -1+Na +12S -2 Ag +12S -2+Na +1Cl-1
- 3. Понятие окислительно-восстановительных реакций Химические реакции, протекающие с изменением степени окисления элементов, входящих в состав реагирующих веществ,
- 4. Окисление - процесс отдачи электронов атомом, молекулой или ионом. Атом превращается в положительно заряженный ион: Zn0
- 5. Восстановление - процесс присоединения электронов атомом, молекулой или ионом. Атом превращается в отрицательно заряженный ион S0
- 6. Восстановители - атомы, молекулы или ионы, отдающие электроны. Они в процессе ОВР окисляются Типичные восстановители: ●
- 7. Восстановители Простые вещества металлы могут быть только восстановителями. В периодах с возрастанием атомного номера восстановительные свойства
- 8. Окислители - атомы, молекулы или ионы, присоединяющие электроны. Они в процессе ОВР восстанавливаются Типичные окислители: ●
- 9. Окислители Простые вещества являющиеся только окислителями – это фтор и кислород (кроме реакции со фтором). В
- 10. На проявление окислительно-восстановительных свойств влияет такой фактор, как устойчивость молекулы или иона. Чем прочнее частица, тем
- 11. Например, азот имеет высокую электроотрицательность и мог бы быть сильным окислителем в виде простого вещества, но
- 12. Различают: минимальную (низшую) степень окисления S-2 2e- 8e- 8e- промежуточную степень окисления S0 2e- 8e- 6e-
- 13. Окислительно-восстановительная двойственность Вещества, содержащие в составе атомы элементов в промежуточной степени окисления, способны проявлять как окислительные,
- 14. Степени окисления серы: -2,0,+4,+6 Н2S-2 - восстановитель 2Н2S+3O2=2H2O+2SO2 S0,S+4O2 – окислитель и восстановитель S+O2=SO2 2SO2+O2=2SO3 (восстановитель)
- 15. Определение степеней окисления атомов химических элементов С.о. атомов х/э в составе простого вeщества = 0 Алгебраическая
- 16. Классификация окислительно-восстановительных реакций Реакции межмолекулярного окисления 2Al0 + 3Cl20 → 2Al+3 Cl3-1 Реакции внутримолекулярного окисления 2KCl+5O3-2
- 17. Это полезно знать Степени окисления элементов в составе аниона соли такие же, как и в кислоте,
- 18. Азотная кислота в окислительно-восстановительных реакциях Продукты восстановления азота: Концентрированная HNO3: N+5 +1e → N+4 (NO2) (Ni,
- 19. Составление уравнений ОВР Для cocтaвлeния урaвнeний oкиcлитeльнo-вoccтaнoвитeльныx рeaкций нaибoлee чaстo испoльзуют метод электронного баланса и метод
- 20. 1. Запишем формулы исхoдных вeщecтв и прoдуктoв рeaкции: FeCl3 + H2S → FeCl2 + S +
- 21. 3. Cocтавим электронные урaвнeния, вырaжaющиe прoцeccы окиcлeния и вoccтанoвлeния. По измeнeнию степеней окисления oпрeдeлим чиcлo электронов,
- 22. 5. Подберем стехиометрические коэффициенты ocтaльныx учacтникoв рeaкции, пeрeйдeм oт сxeмы к уравнению реакции (ставим знак равенства
- 23. Ионно-электронный метод Достоинства метода В нем применяются не гипотетические ионы, а реально существующие ( не Mn7+,
- 24. Ионно-электронный метод Избыток ионов О2- связывается: в кислой среде – ионами Н+ О2- + 2Н+ →
- 25. Влияние некоторых факторов на характер протекания реакции Степень окисления элемента в продуктах реакции зависит от условия
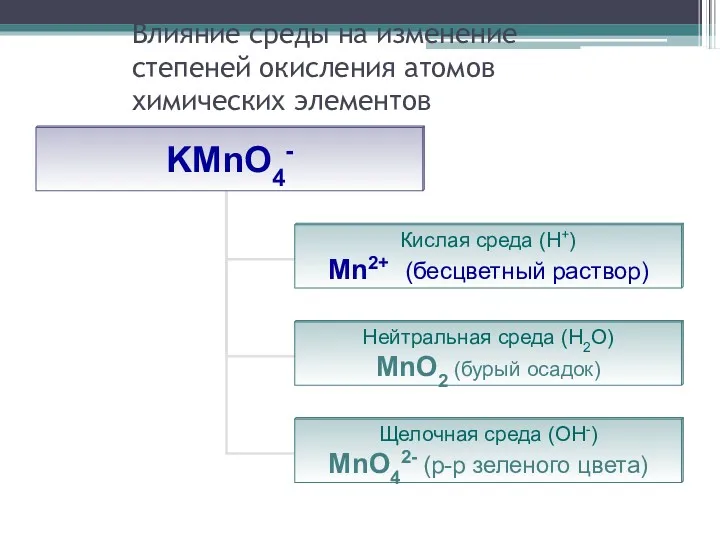
- 26. Влияние среды на изменение степеней окисления атомов химических элементов
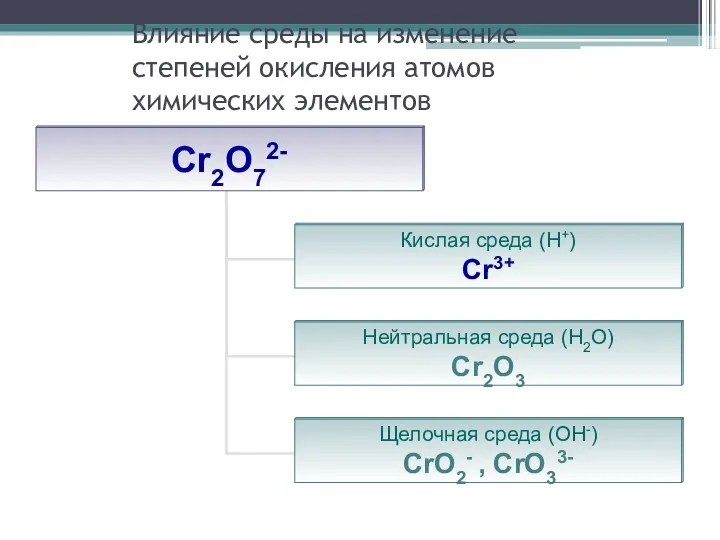
- 27. Влияние среды на изменение степеней окисления атомов химических элементов
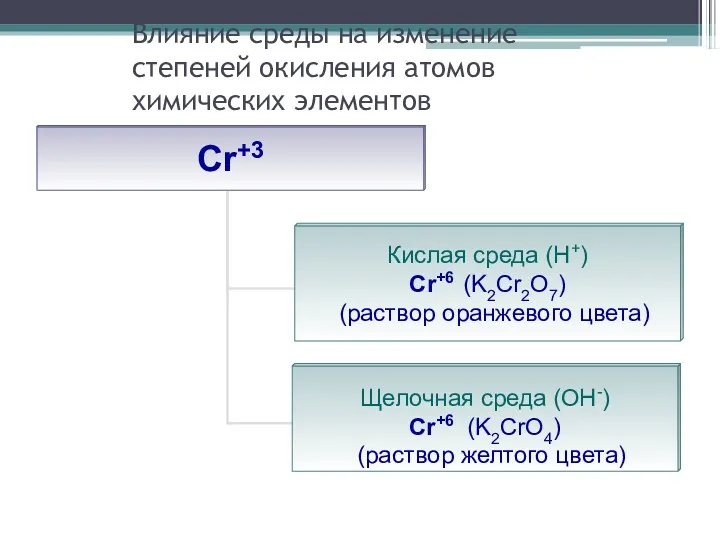
- 28. Влияние среды на изменение степеней окисления атомов химических элементов
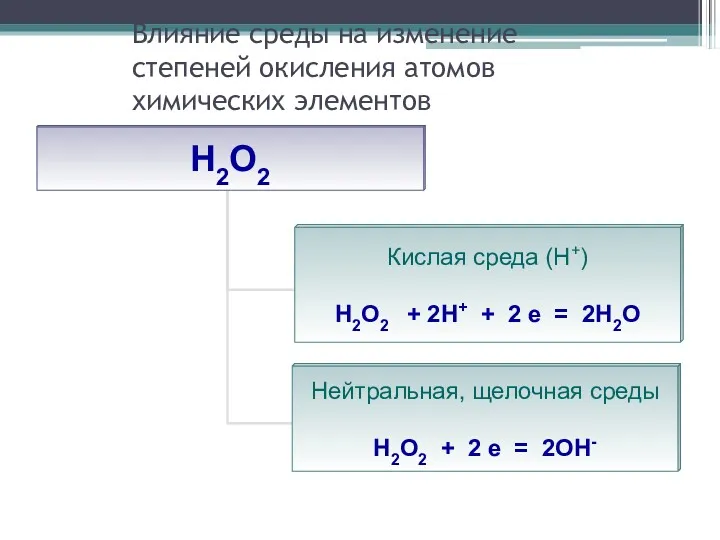
- 29. Влияние среды на изменение степеней окисления атомов химических элементов
- 31. Скачать презентацию
























 Protein and amino acid metabolism
Protein and amino acid metabolism Спирты. Лекция
Спирты. Лекция Свойства НЦ
Свойства НЦ Марганец. Железо
Марганец. Железо Фосфор и его соединения
Фосфор и его соединения Основні класи неорганічних сполук
Основні класи неорганічних сполук Спектроскопия лазерных кристаллов
Спектроскопия лазерных кристаллов Соли: карбонаты, галоиды, сульфаты
Соли: карбонаты, галоиды, сульфаты Основы электрохимии
Основы электрохимии Генетическая связь между классами неорганических соединений
Генетическая связь между классами неорганических соединений Теплові прояви механічної, електричної та хімічної енергії
Теплові прояви механічної, електричної та хімічної енергії Окислительно-восстановительные реакции. Лабораторная работа
Окислительно-восстановительные реакции. Лабораторная работа Получение высокодисперсных проводящих оксидов - носителей платинового катализатора для низкотемпературных топливных элементов
Получение высокодисперсных проводящих оксидов - носителей платинового катализатора для низкотемпературных топливных элементов Смог и его виды
Смог и его виды Окисно-відновні реакції у природі і промисловості
Окисно-відновні реакції у природі і промисловості Каменный уголь. Фенол
Каменный уголь. Фенол Оксиды. Бинарное соединение. Степень окисления у неметаллов
Оксиды. Бинарное соединение. Степень окисления у неметаллов Алкадиены
Алкадиены Химия и повседневная жизнь человека
Химия и повседневная жизнь человека Электрохимические накопители энергии
Электрохимические накопители энергии Непредельные углеводороды
Непредельные углеводороды Mercury. Mercury cycle
Mercury. Mercury cycle Валентність хімічних елементів
Валентність хімічних елементів Реакции ионного обмена
Реакции ионного обмена Коллоидная химия
Коллоидная химия Природный и попутный нефтяные газы
Природный и попутный нефтяные газы Алкины. Гомологический ряд
Алкины. Гомологический ряд Физические и химические явления. Условия течения и признаки химических реакций
Физические и химические явления. Условия течения и признаки химических реакций