Содержание
- 2. Когда-нибудь настанет время – и это время не за горами, – когда мерилом ценности станет не
- 3. Начало всех начал – водород! Водород — основная составная часть звёзд и межзвёздного газа. В условиях
- 4. Водород в космосе
- 5. Ближайшая к нам звезда Галактики, которую мы знаем под именем «Солнце», на 70 % своей массы
- 6. Водород на Земле Вода Нефть Природный газ
- 7. В 1766 году известный английский ученый Генри Кавендиш получил «искусственный воздух» (так часто называли в то
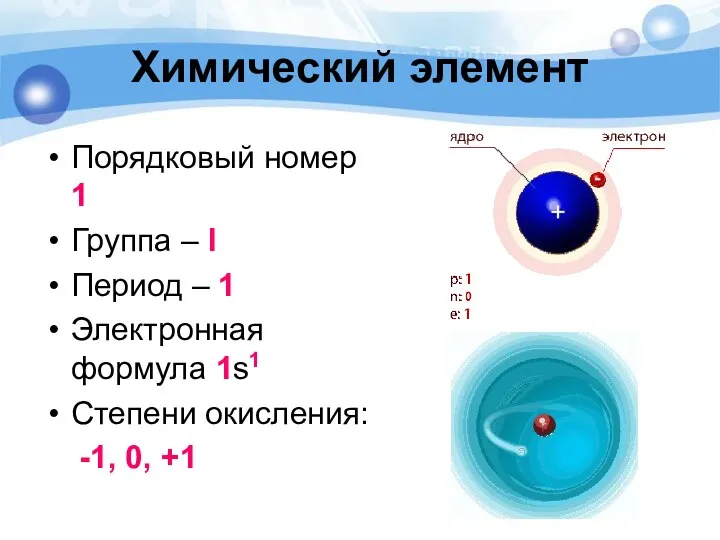
- 8. Химический элемент Порядковый номер 1 Группа – I Период – 1 Электронная формула 1s1 Степени окисления:
- 9. Физические свойства Водород — легчайшее из всех известных веществ (в 14,4 раза легче воздуха), это бесцветный
- 10. Опыт Пилатра де Розьера Как-то он решил проверить, что будет, если вдохнуть водород; до него никто
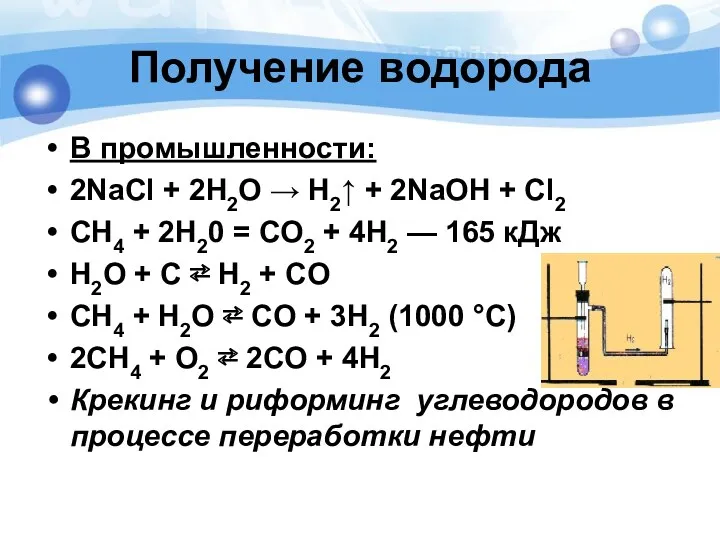
- 11. В промышленности: 2NaCl + 2H2O → H2↑ + 2NaOH + Cl2 СН4 + 2Н20 = CO2
- 12. В лаборатории: Zn + 2HCl → ZnCl2 + H2↑ Ca + 2H2O → Ca(OH)2 + H2↑
- 13. 1. Взаимодействие с активными металлами – окислительные свойства При комнатной температуре 2K + H2→2KH (гидрид калия)
- 14. Вывод: В соединениях с металлами,водород образует гидриды – бинарные соединения, твердые солеподобные вещества. (KH, CaH2, AlH3)
- 15. 2. Взаимодействие с неметаллами – восстановительные свойства При комнатной температуре водород реагирует с фтором F2+H2→2HF↑ (фтороводород),
- 16. при нагревании водород взаимодействует с серой: Н2 + S→Н2S↑ (сероводород) при высокой температуре, давлении и в
- 17. Вывод: В результате реакций с неметаллами образуются газообразные вещества ( HF↑ , HCl ↑, Н2S↑, NH3↑
- 18. 3. Реакция горения При взаимодействии водорода с кислородом образуется вода. Водород без примесей сгорает спокойно. 2
- 19. Гремучая смесь Наиболее взрывчата смесь, состоящая из двух объёмов водорода и одного объёма кислорода – «гремучий
- 20. 4.Взаимодействие с оксидами не активных металлов ОксидыОксиды восстанавливаются до металлов: СuO + H2 = H2O +
- 21. Вывод: Водород восстанавливает металлы из их оксидов, поэтому водород является восстановителем. H2 восстановитель
- 22. Выводы: 1). В обычных условиях молекулярный водород взаимодействует лишь с наиболее активными веществами - фтором, натрием
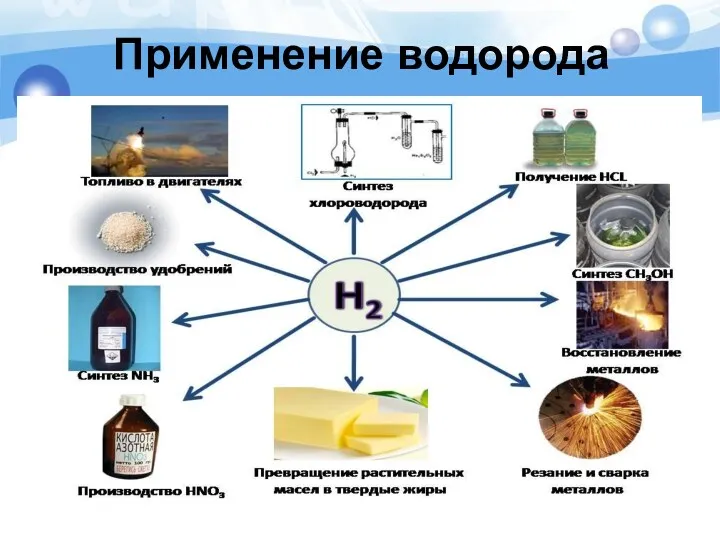
- 23. Применение водорода в промышленности
- 24. Использование водорода в качестве топлива автомобилей При сгорании водорода в кислороде образуется экологически чистый продукт –
- 25. Использование водорода в ракетных двигателях Жидкий водород является распространенным компонентом ракетного топлива
- 26. Использование водорода в металлургической промышленности Водород как восстановитель, для получения металлов и неметаллов (кремния, вольфрама)
- 27. Сварка металла Смесь кислорода с водородом используют при сварке и резке металлов.
- 28. Производство стекла Водород является активным газом и в соединениях с азотом может использоваться в производстве листового,
- 29. В пищевой промышленности Превращение жидких растительных масел в твердые жиры – маргарин.
- 30. В продажу водород поступает в баллонах под давлением свыше 150 атм. Они окрашены в тёмно-зелёный цвет
- 31. Применение водорода
- 32. Задачи: Какая масса водорода потребуется для его взаимодействия с 64г серы. Какой объём водорода израсходуется на
- 34. Скачать презентацию




























 Щелочные металлы IА группы. Литий
Щелочные металлы IА группы. Литий Натуральный каучук
Натуральный каучук Получение и применение спиртов
Получение и применение спиртов Сложные эфиры. Жиры
Сложные эфиры. Жиры Розрахунки за хімічними рівняннями
Розрахунки за хімічними рівняннями Свойства кислот
Свойства кислот Методы разделения и концентрирования. Хроматографические методы
Методы разделения и концентрирования. Хроматографические методы Теория электролитической диссоциации (ТЭД)
Теория электролитической диссоциации (ТЭД) Электронное строение атома. Периодический закон
Электронное строение атома. Периодический закон Азотная кислота и ее свойства
Азотная кислота и ее свойства Історія відкриття періодичної системи хімічних елементів
Історія відкриття періодичної системи хімічних елементів Химия p-элементов. VI и VII группы главные подгруппы
Химия p-элементов. VI и VII группы главные подгруппы Общая характеристика и классификация топлива
Общая характеристика и классификация топлива Подготовка к ГИА. А9. Химические свойства простых веществ: металлов и неметаллов
Подготовка к ГИА. А9. Химические свойства простых веществ: металлов и неметаллов Минералы. Свойства минералов
Минералы. Свойства минералов Глицерин. Свойства и применение
Глицерин. Свойства и применение топ през
топ през Алканы. Состав, строение, свойства и химические превращения. Экологические последствия. Синтезы генетическая связь
Алканы. Состав, строение, свойства и химические превращения. Экологические последствия. Синтезы генетическая связь Алгоритм определения вида связи по формуле вещества
Алгоритм определения вида связи по формуле вещества III А – топтың элементтері
III А – топтың элементтері Алюминий и его соединения. Строение атома
Алюминий и его соединения. Строение атома Молекулярные и немолекулярные вещества
Молекулярные и немолекулярные вещества Обезвреживающая функция печени
Обезвреживающая функция печени Химическая связь
Химическая связь Происхождение нефти
Происхождение нефти Генетическая связь между классами неорганических веществ
Генетическая связь между классами неорганических веществ Контрольная работа по дисциплине: химия
Контрольная работа по дисциплине: химия Почва. Интегрированный урок по химии и географии
Почва. Интегрированный урок по химии и географии