Содержание
- 2. План Определение Общая формула Гомологический ряд Номенклатура Гибридизация Физические свойства Изомерия Получение
- 3. Цели Ознакомить с гомологическим рядом этилена. Рассмотреть строение молекул алкенов, виды изомерии, характерные для непредельных УВ,
- 4. Оборудование и реактивы Шаростержневые и объемные модели молекул алкенов
- 5. Алкены-ациклические углеводороды,содержащие в молекуле,помимо одинарных связей,одну двойную связь между атомами углерода и соответствующие общей формуле CnH2n.
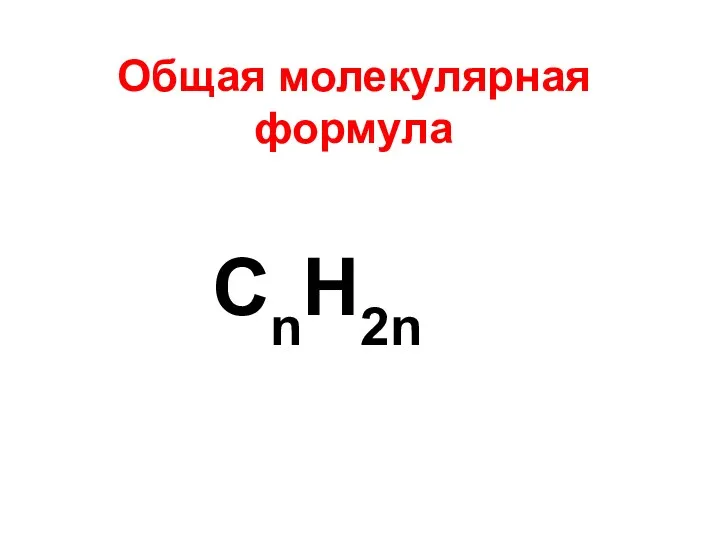
- 6. Общая молекулярная формула CnH2n
- 7. Задание Определить формулы алкенов с числом углеродных атомов равным 5,9,20
- 8. Важнейшие представители C2H4-этен C5H10-пентен С3H6-пропен С6H12-гексен C4H8-бутен C7H14-гептен С8H16-октен С9H18-нонен С10H20-децен
- 9. Номенклатура 1) Родоначальная структура должна обязательно содержать двойную связь 2) Нумерацию начинают с конца к которому
- 10. Задание Напишите структурные формулы следующих веществ: 2-этилбутен-1 2,2-диметилпентен-3 2-метил 3-этилгептен – 3 Гексен -2 3-пропилбутен-1
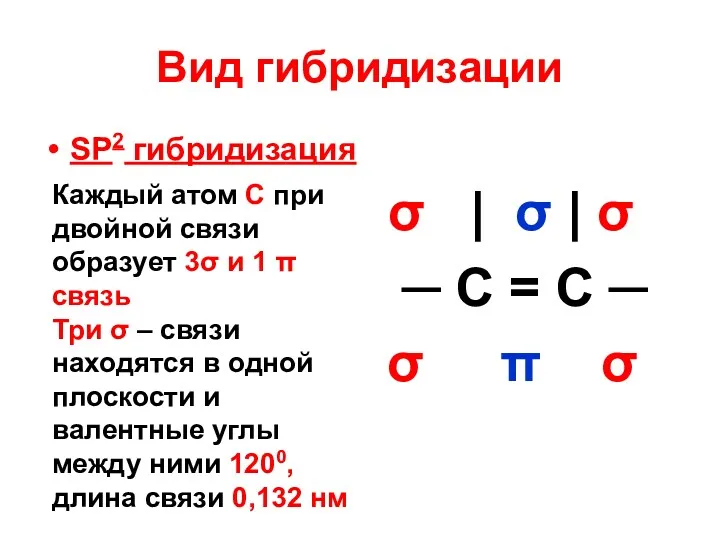
- 11. Вид гибридизации SP2 гибридизация | σ | ─ C = C ─ π Двойная связь между
- 12. Вид гибридизации SP2 гибридизация σ | σ | σ ─ C = C ─ σ π
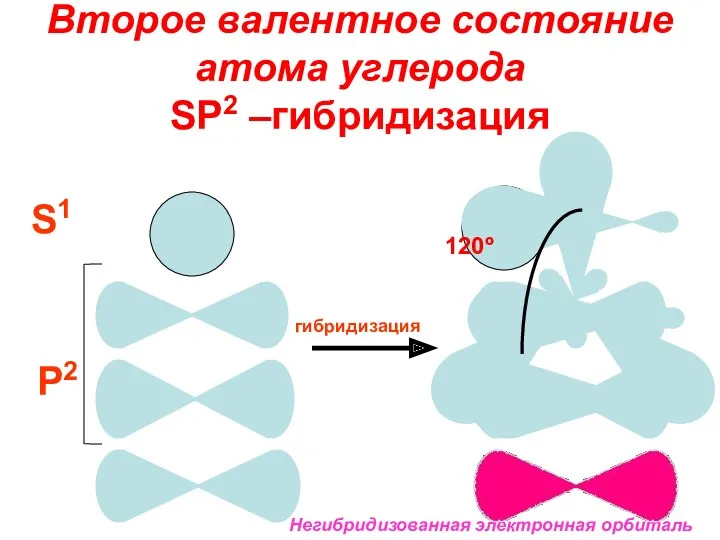
- 13. S1 P2 гибридизация Негибридизованная электронная орбиталь Второе валентное состояние атома углерода SP2 –гибридизация 120º
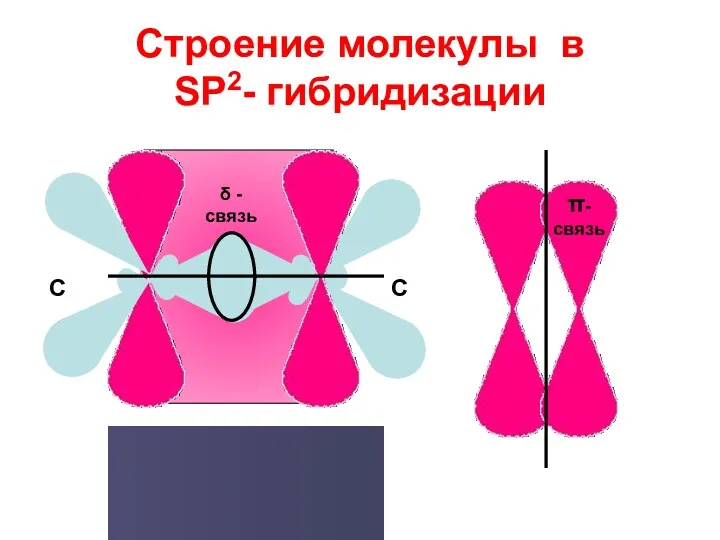
- 14. Строение молекулы в SP2- гибридизации δ -связь π-связь С С С = С δ π С
- 15. Характеристика π - связи π – связь одинаково распределена над и под плоскостью молекулы этилена π
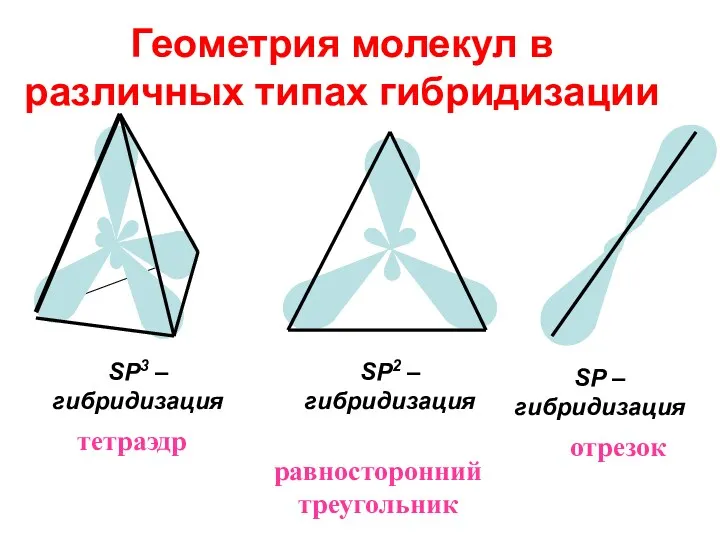
- 16. Геометрия молекул в различных типах гибридизации SP3 – гибридизация тетраэдр SP2 – гибридизация равносторонний треугольник SP
- 17. Л/р «Построение моделей молекул алкенов» 1. Сколько электронных орбиталей участвуют в SP2- гибридизации? 2.Сколько орбиталей не
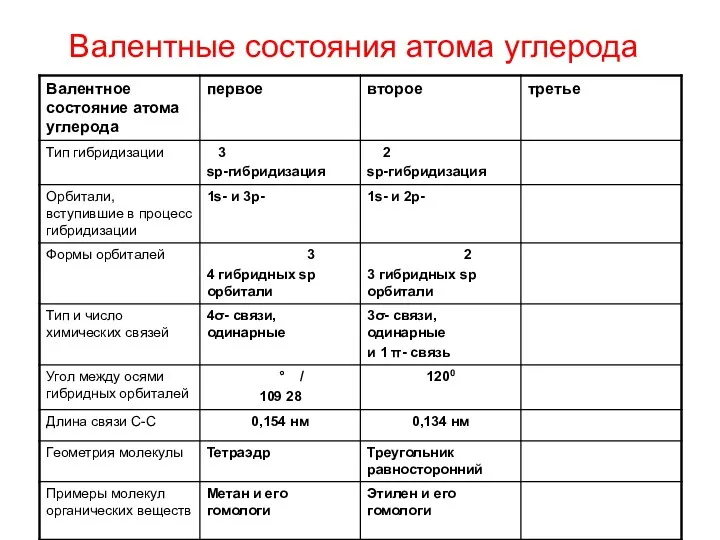
- 18. Валентные состояния атома углерода
- 19. ВЫВОД: Наличие двойной связи обуславливает высокую химическую активность олефинов (алкенов)
- 20. Физические свойства Первые три представителя C2H4, C3H6 C4H8- гомологического ряда алкенов- газы вещества состава C5H10- C16H32-
- 21. Физические свойства Алкены нерастворимы в воде Хорошо растворяются в неполярных органических растворителях
- 22. Изомерия I Структурная: 1. Углеродного скелета СH3- CH2- CH =CH2 бутен-1 СН3 – С = СН2
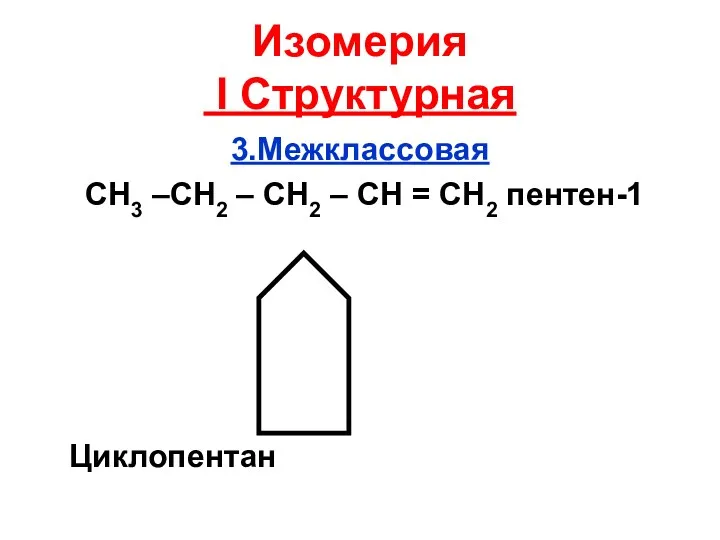
- 23. Изомерия I Структурная 3.Межклассовая СН3 –СН2 – СН2 – СН = СН2 пентен-1 Циклопентан
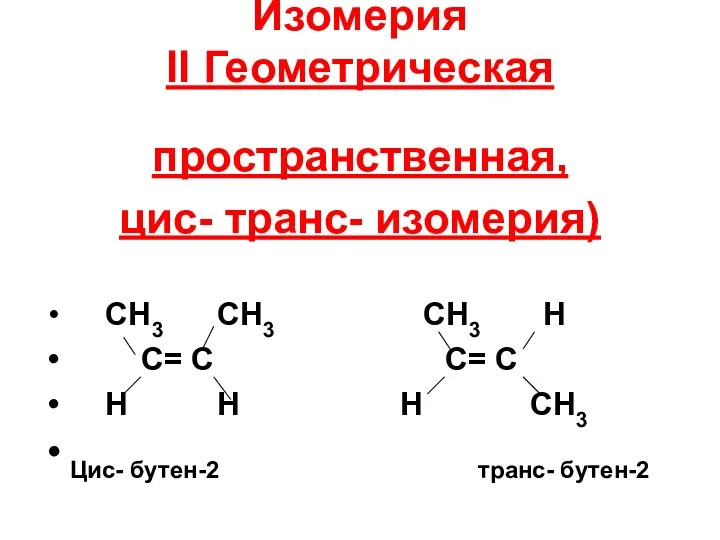
- 24. Изомерия II Геометрическая пространственная, цис- транс- изомерия) CH3 CH3 CH3 H C= C С= С H
- 25. Причина появления геометрической изомерии у алкенов Отсутствие свободного вращения вокруг двойной связи и как следствие различное
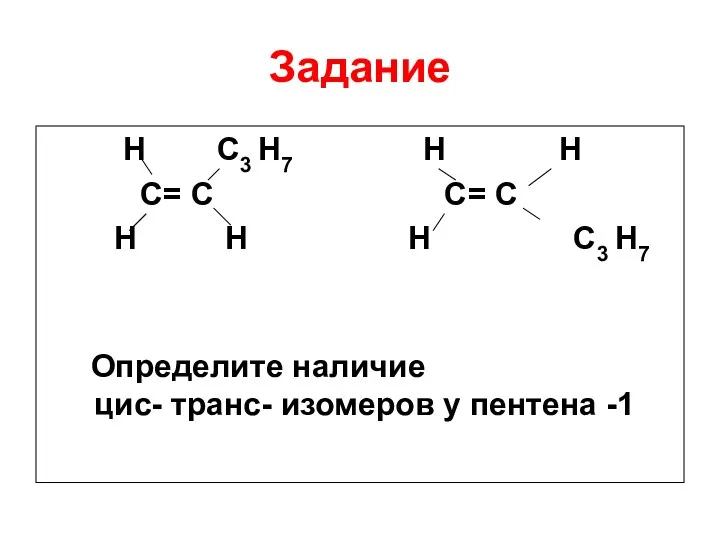
- 26. Задание H C3 H7 H H C= C С= С H H H C3 H7 Определите
- 27. Ответ В данном случае цис- транс – изомерия невозможна, так как один из атомов С при
- 28. Высокая химическая активность Высокая химическая активность алкенов, поэтому они отсутствуют в природных месторождениях, в отличие от
- 29. ПОЛУЧЕНИЕ АЛКЕНОВ Дегидрирование алканов: СН3- СН3 СH2= СH2+H2 Этан Этен Кt (Pt, Ni, Al2O3, Cr2O3) t
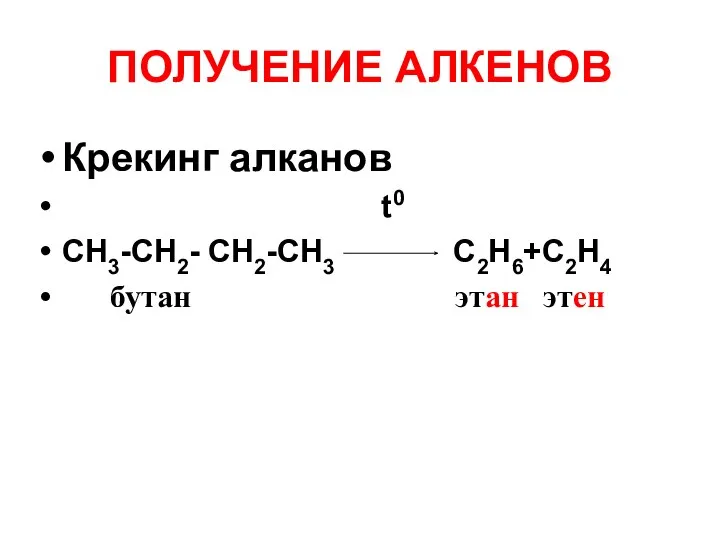
- 30. ПОЛУЧЕНИЕ АЛКЕНОВ Крекинг алканов t0 СН3-СH2- СH2-СН3 C2H6+C2H4 бутан этан этен
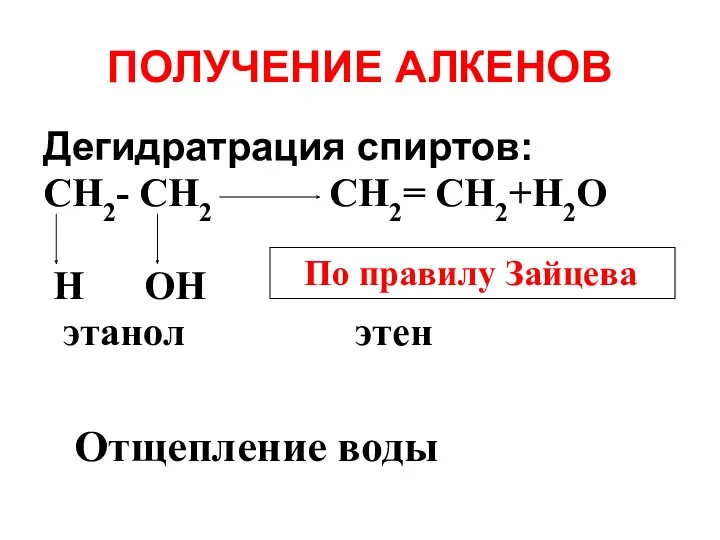
- 31. ПОЛУЧЕНИЕ АЛКЕНОВ Дегидратрация спиртов: СH2- СH2 СH2= СH2+H2О Н ОН этанол этен Отщепление воды По правилу
- 32. ПОЛУЧЕНИЕ АЛКЕНОВ Дегидрогалогенирование галогеналканов: t СH2- СH2+ NaOH(спирт) СH2= СH2+NaCl+ H2О H Cl Хлорэтан этен Отщепление
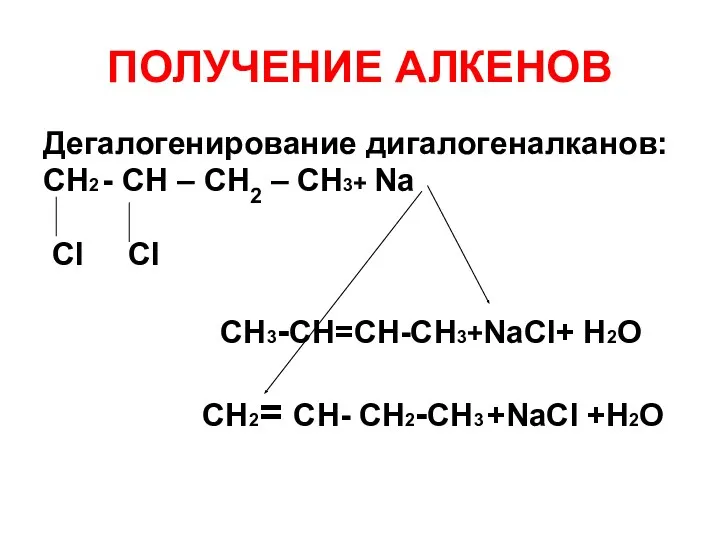
- 33. ПОЛУЧЕНИЕ АЛКЕНОВ Дегалогенирование дигалогеналканов: СH2 - СH – СH2 – СH3+ Na Cl Cl СН3-СН=СН-СН3+NaCl+ H2О
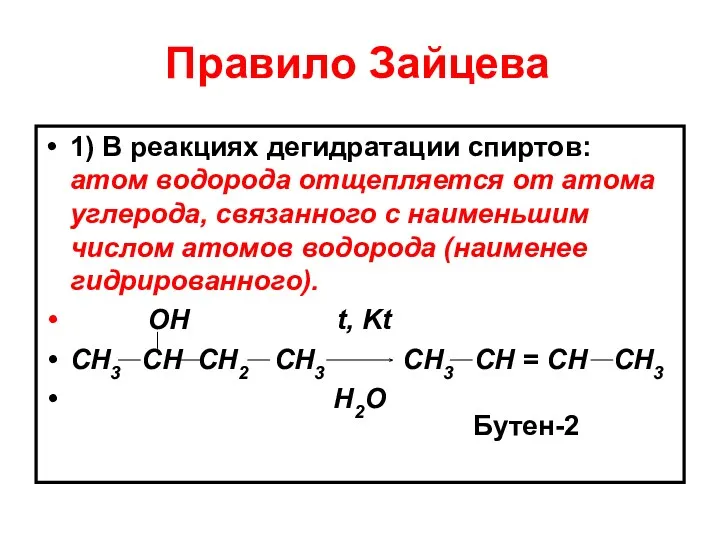
- 34. Правило Зайцева 1) В реакциях дегидратации спиртов: атом водорода отщепляется от атома углерода, связанного с наименьшим
- 35. Правило Зайцева 2) В реакциях дегидрогалогенирования: атом водорода отщепляется от соседнего наименее гидрированного атома углерода. Поэтому
- 37. Скачать презентацию





















 Витаминдер. Витаминдердің классификациясы. Алиментарлы және екіншілік авитаминоздар. Гипервитаминоздар
Витаминдер. Витаминдердің классификациясы. Алиментарлы және екіншілік авитаминоздар. Гипервитаминоздар Генетическая связь между классами неорганических соединений. Урок 1
Генетическая связь между классами неорганических соединений. Урок 1 Электролитическая диссоциация. Протолитическая теория кислот и оснований. Лекция №5
Электролитическая диссоциация. Протолитическая теория кислот и оснований. Лекция №5 Кремний и его соединения
Кремний и его соединения Основные понятия и законы химии. Тема 1
Основные понятия и законы химии. Тема 1 Типы химических реакций. Тепловой эффект (11 класс)
Типы химических реакций. Тепловой эффект (11 класс) 20231104_prezentatsiya_teoriya_elektroliticheskoy_dissotsiatsii
20231104_prezentatsiya_teoriya_elektroliticheskoy_dissotsiatsii Икаит Ca[CO3]·6 (H2O)
Икаит Ca[CO3]·6 (H2O) Фосфаты и фосфонаты в стиральном порошке
Фосфаты и фосфонаты в стиральном порошке Электоролиз заңы
Электоролиз заңы Dimethyl ether. Prification test result
Dimethyl ether. Prification test result Классификация органических веществ
Классификация органических веществ Одноатомные спирты. Глицерин
Одноатомные спирты. Глицерин 20230204_ekzo_i_endo2_0
20230204_ekzo_i_endo2_0 Горение жидкого топлива
Горение жидкого топлива Равновесие в реакциях гидролиза. Лекция 6
Равновесие в реакциях гидролиза. Лекция 6 Аналитическая химия
Аналитическая химия Химические свойства алкенов
Химические свойства алкенов Вещества в твоей жизни
Вещества в твоей жизни Алкани
Алкани Коллоидные ПАВ. Мицеллообрaзование в растворах коллоидных ПАВ. Солюбилизация
Коллоидные ПАВ. Мицеллообрaзование в растворах коллоидных ПАВ. Солюбилизация Карбоновые кислоты и их гетерофункциональные производные
Карбоновые кислоты и их гетерофункциональные производные Чистые вещества и смеси
Чистые вещества и смеси Алкадиены: строение, номенклатура, гомологи, изомерия
Алкадиены: строение, номенклатура, гомологи, изомерия Алкины. Самостоятельная работа
Алкины. Самостоятельная работа Современные методы физико-химической биологии
Современные методы физико-химической биологии Альдегиды, свойства, получение, применение
Альдегиды, свойства, получение, применение Техника безопасности для учащихся в кабинете химии
Техника безопасности для учащихся в кабинете химии