Содержание
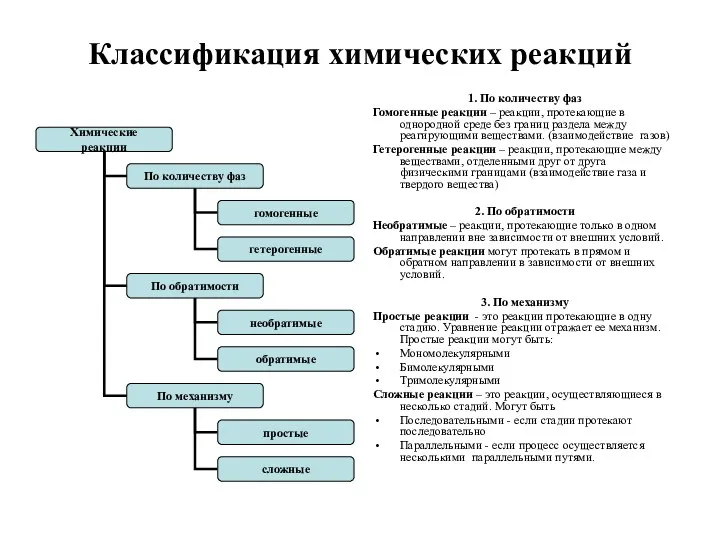
- 2. Классификация химических реакций 1. По количеству фаз Гомогенные реакции – реакции, протекающие в однородной среде без
- 3. Понятие скорости реакции Скорость химической реакции - это количество вещества, вступающего в реакцию или образующегося в
- 4. Факторы, влияющие на скорость химических реакций природа реагирующих веществ условия проведения процесса: концентрация веществ или давление
- 5. Зависимость скорости реакции от концентрации реагирующих веществ Закон действия масс (Гульдберга и Ваге) 1867г. При постоянной
- 6. Бекетов Н.Н Като Максимилиан Гульдберг и Петер Вааге (справа)
- 7. Зависимость скорости реакции от температуры Привило Вант Гоффа: При повышении температуры на каждые 10 градусов, скорость
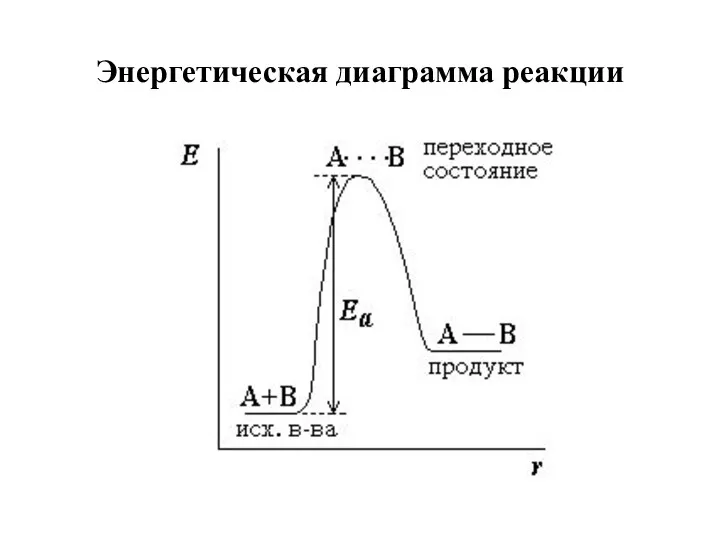
- 8. Теория активированных комплексов (АК) Химическое превращение исходных веществ в продукты происходит через образование неустойчивого промежуточного состояния
- 9. Энергетическая диаграмма реакции
- 10. Уравнение Аррениуса Здесь k – константа скорости, А – «предэкспоненциальный множитель» - учитывает влияние ориентации молекул
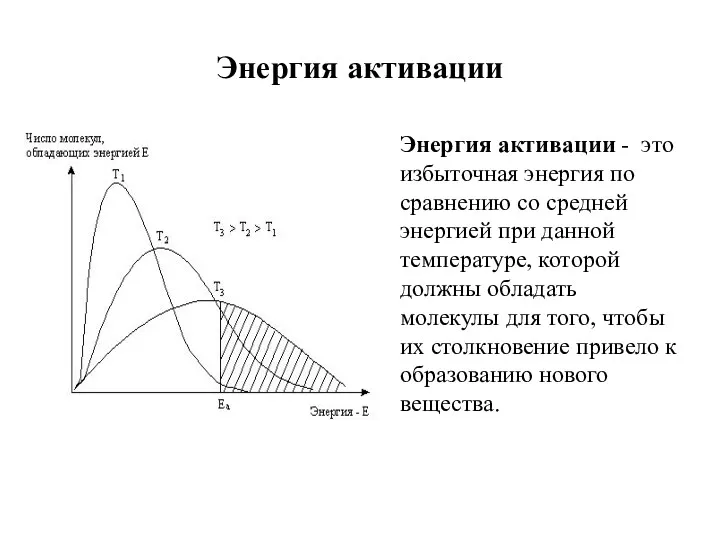
- 11. Энергия активации Энергия активации - это избыточная энергия по сравнению со средней энергией при данной температуре,
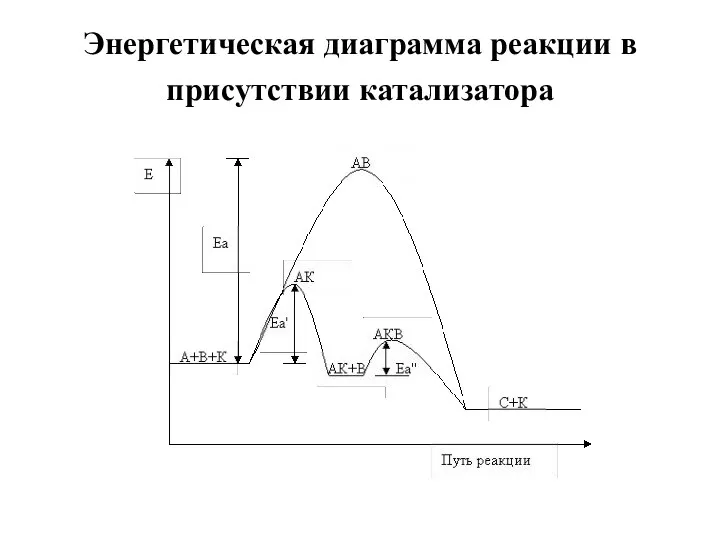
- 12. Зависимость скорости реакции от катализатора Катализатор – это вещество, увеличивающее скорость реакции, но не расходующееся в
- 13. Энергетическая диаграмма реакции в присутствии катализатора
- 15. Скачать презентацию








 Чисті речовини і суміші
Чисті речовини і суміші Oxygen, O2
Oxygen, O2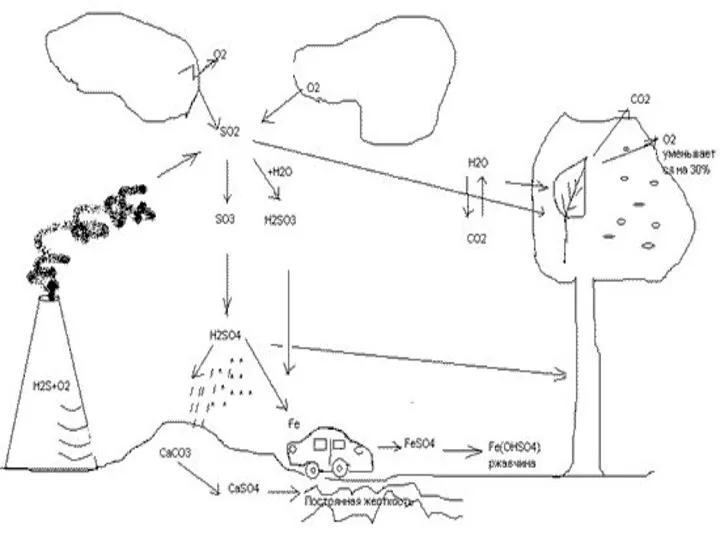 Сандық есептер (металдар мен оның қосылыстарындағы генетикалық байланысты көрсететін)
Сандық есептер (металдар мен оның қосылыстарындағы генетикалық байланысты көрсететін) В мире криссталлов
В мире криссталлов Д. И. Менделеев человек - загадка
Д. И. Менделеев человек - загадка Классификация органических соединений
Классификация органических соединений Классификация дисперсных систем
Классификация дисперсных систем Ароматические азотсодержащие соединения
Ароматические азотсодержащие соединения Железо и его соединения
Железо и его соединения Аминокислоты, их строение, изомерия, свойства, применение
Аминокислоты, их строение, изомерия, свойства, применение Галогены
Галогены Природные источники углеводородов
Природные источники углеводородов Виды химической связи
Виды химической связи Методы окислительно-восстановительного титрования (Редоксиметрия)
Методы окислительно-восстановительного титрования (Редоксиметрия) Закон сохранения массы веществ
Закон сохранения массы веществ Электрофизические свойства GaAs, зонная структура, полупроводящий и полуизолирующий GaAs, способы создания p-n перехода
Электрофизические свойства GaAs, зонная структура, полупроводящий и полуизолирующий GaAs, способы создания p-n перехода Электрохимическая защита
Электрохимическая защита Соединения кремния
Соединения кремния Катионная полимеризация (Лекция 6)
Катионная полимеризация (Лекция 6) Алкалоидтар. Алкалоидтар туралы түсінік. Жіктелуі
Алкалоидтар. Алкалоидтар туралы түсінік. Жіктелуі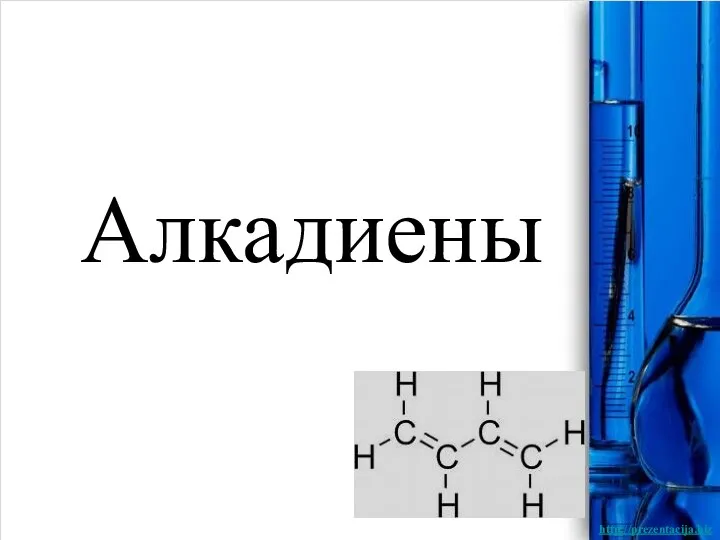 Алкадиены
Алкадиены Геометрическая кристаллография
Геометрическая кристаллография Закономерности управления каталитическими процессами
Закономерности управления каталитическими процессами Бензин. Физико-химические свойства бензина
Бензин. Физико-химические свойства бензина Ионные уравнения
Ионные уравнения Йод в нашей жизни
Йод в нашей жизни Кислородные соединения серы. Серная кислота
Кислородные соединения серы. Серная кислота Понятие биогенности химических элементов
Понятие биогенности химических элементов