Содержание
- 2. Вспомним! Степень окисления – это условный заряд, который приобрел бы атом в молекуле, если бы все
- 3. 1. Степень окисления атомов в простых веществах равна нулю: 0 0 0 H2, Cl2, Na .
- 4. Алгебраическая сумма степеней окисления всех атомов в соединении всегда равна нулю: +1 -2 H2SO4 (+1)·2 +
- 5. В реакциях ионного обмена составные части веществ переходили в состав других веществ без изменений, степени окисления
- 6. Однако существует огромное множество реакций, в ходе которых меняются степени окисления элементов: 0 0 +2 -2
- 7. Химические реакции, в результате которых происходит изменение степеней окисления атомов химических элементов или ионов, образующих реагирующие
- 8. Элемент, отдающий электроны, называется восстановителем, а принимающий электроны - окислителем. Процесс отдачи электронов называется окислением, а
- 9. Эти процессы неразрывно связаны между собой, число принятых окислителем электронов должно быть равно числу отданных восстановителем
- 10. Чтобы составить схему о-в процесса, необходимо: 1. Определить степень окисления элементов. 2. Определить элементы, изменившие степень
- 11. 0 0 +3 -2 Al + S = Al2S3 Al0 - 3ē → Al+3 окисление S0
- 12. Mg + O2 = MgO 0 0 +2 -2 Mg0 - 2ē → Mg+2 окисление O20
- 13. Окислительно-восстановительные реакции в природе и технике:
- 14. Задание 1. Определите степени окисления всех химических элементов, входящих в состав веществ: NaOH, MgCl2, K2CO3, AlCl3,
- 15. Задание 2. Расставьте коэффициенты методом электронного баланса в следующих уравнениях реакций: 1) HgO = Hg +
- 17. Скачать презентацию










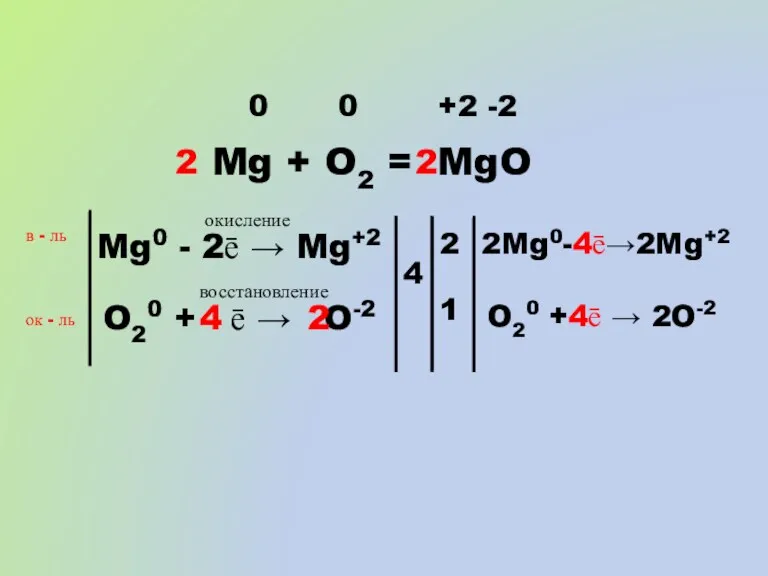



 Особенности строения соединений органической химии. 10 класс
Особенности строения соединений органической химии. 10 класс Соли, как производные кислот и оснований
Соли, как производные кислот и оснований Гидролиз органических и неорганических веществ
Гидролиз органических и неорганических веществ Периодический закон и периодическая система Д.И. Менделеева
Периодический закон и периодическая система Д.И. Менделеева 20231110_zakon_avogadro
20231110_zakon_avogadro Спирты. Понятия о предельных одноатомных спиртах. Химические свойства этанола и его применение
Спирты. Понятия о предельных одноатомных спиртах. Химические свойства этанола и его применение Химический элемент кремний
Химический элемент кремний Степень окисления. Бинарные соединения
Степень окисления. Бинарные соединения Основные классы неорганических соединений
Основные классы неорганических соединений Алкины
Алкины Классы органических соединений
Классы органических соединений Периодический закон Д.И. Менделеева
Периодический закон Д.И. Менделеева Непредельные углеводороды
Непредельные углеводороды Нитросоединения
Нитросоединения Металлы. Общие свойства и получение
Металлы. Общие свойства и получение Закон действующих масс и его применение в аналитической химии
Закон действующих масс и его применение в аналитической химии Гидролиз солей
Гидролиз солей Степени окисления атомов и формулы веществ
Степени окисления атомов и формулы веществ Неравновесные явления в сложных химических процессах. Часть 1: электрохимия
Неравновесные явления в сложных химических процессах. Часть 1: электрохимия Закон сохранения массы веществ
Закон сохранения массы веществ Дисахаридтер. Сахароза
Дисахаридтер. Сахароза Функціональні матеріали для високоенергетичної електроніки. (Лекція 2)
Функціональні матеріали для високоенергетичної електроніки. (Лекція 2) Защита от коррозии каменных и бетонных строительных материалов и конструкций
Защита от коррозии каменных и бетонных строительных материалов и конструкций Гидролиз органических и неорганических соединений
Гидролиз органических и неорганических соединений Общая химия
Общая химия Марганец и хром
Марганец и хром Теория электролитической диссоциации
Теория электролитической диссоциации Лекция 5. Нуклеофильное замещение при насыщенном атоме углерода
Лекция 5. Нуклеофильное замещение при насыщенном атоме углерода