Содержание
- 2. Вещества по отношению к электрическому току : их растворы или расплавы ПРОВОДЯТ электрический ток их растворы
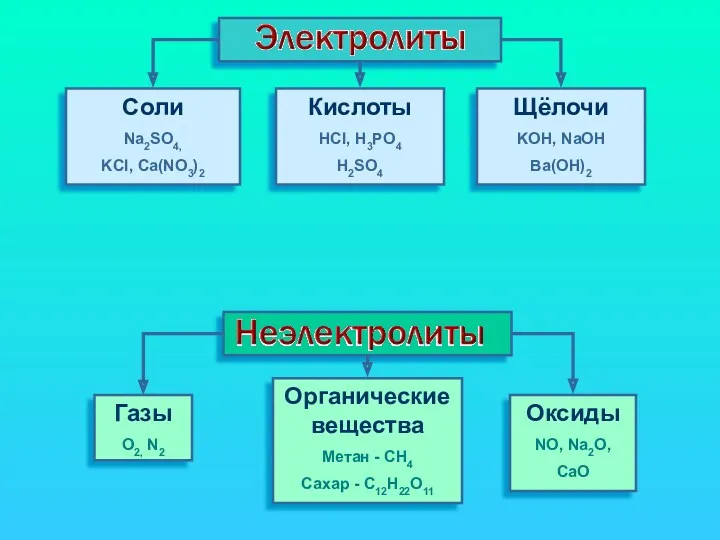
- 3. Cоли Na2SO4, KCl, Ca(NO3)2 Кислоты HCl, H3PO4 H2SO4 Щёлочи KOH, NaOH Ba(OH)2 Газы O2, N2 Органические
- 7. - степень электролитической диссоциации n – число молекул, которые распались на ионы в растворе N –
- 12. Все вещества по их способности проводить электрический ток в растворах или расплавах делятся на электролиты и
- 13. В растворах электролиты диссоциируют (распадаются) на положительно заряженные ионы (катионы ) и отрицательно заряженные ионы (анионы)
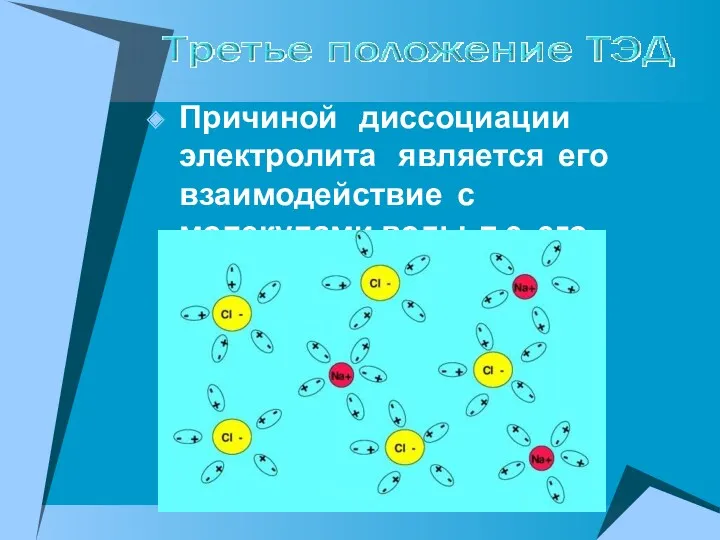
- 14. Причиной диссоциации электролита является его взаимодействие с молекулами воды, т.е. его гидратация
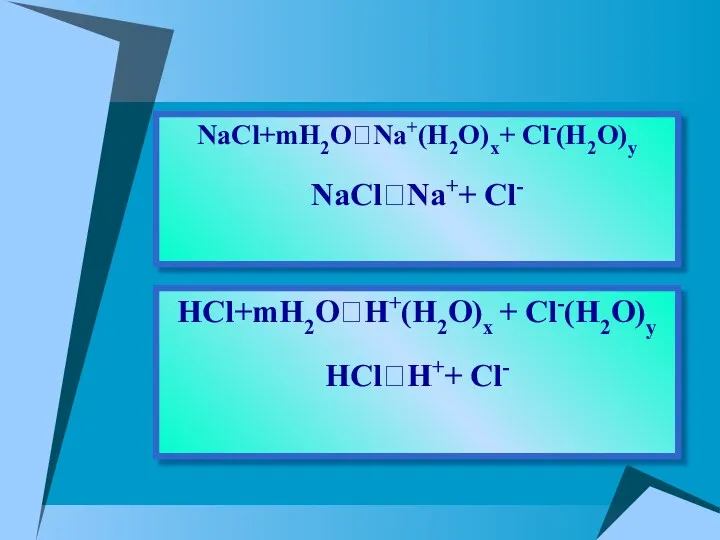
- 15. HCl+mH2O⮀H+(H2O)x + Cl-(H2O)y HCl⮀H++ Cl- NaCl+mH2O⮀Na+(H2O)x+ Cl-(H2O)y NaCl⮀Na++ Cl-
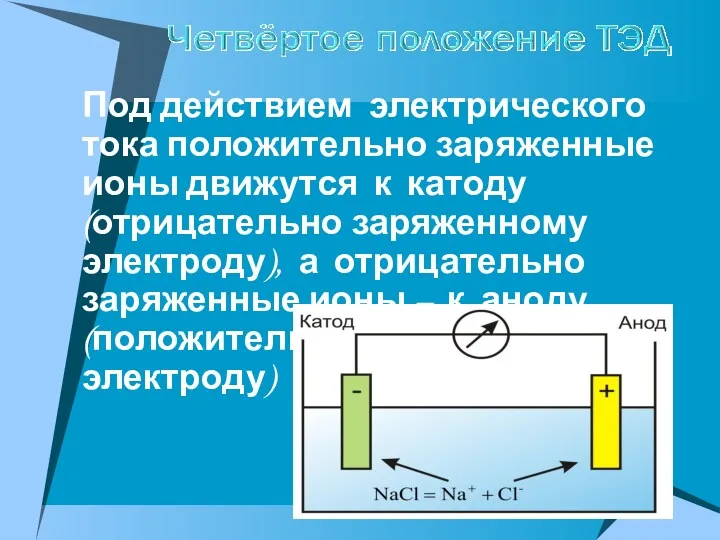
- 16. Под действием электрического тока положительно заряженные ионы движутся к катоду (отрицательно заряженному электроду), а отрицательно заряженные
- 17. Не все электролиты в одинаковой мере диссоциируют на ионы КЛАССИФИКАЦИЯ ЭЛЕКТРОЛИТОВ
- 19. Сильные электролиты α > 30% Средние водорастворимые соли NaCl, K2SO4, Ba(NO3)2 и т.д. Гидроксиды щелочных и
- 20. Электролиты средней силы 3% ≤ α ≤ 30% H3PO3 (фосфористая) H3PO4 H4P2O7 (дифосфорная) H2SO3 HF HClO2
- 21. Слабые электролиты α Органические кислоты: HCOOH (муравьиная), CH3COOH (уксусная), C2H5COOH (пропановая, пропионовая) Минеральные кислоты: HNO2, HClO
- 22. Свойства растворов электролитов определяются свойствами тех ионов, которые они образуют при диссоциации
- 23. Классы неорганических веществ с точки зрения ТЭД
- 24. С точки зрения ТЭД , кислоты – это электролиты, которые диссоциируют на катионы водорода и анионы
- 25. HCl = H+ + Cl- HNO3 = H+ + NO3- HClO4 = H+ + ClO4- Диссоциация
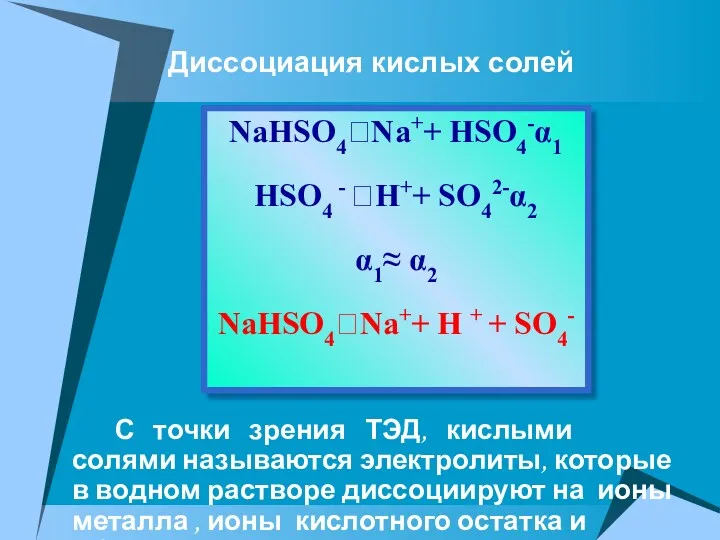
- 26. Многоосновные кислоты диссоциируют ступенчато. Каждая последующая ступень диссоциации протекает хуже предыдущей Сильный электролит H2SO4⮀H++ HSO4-α1 HSO4
- 27. С точки зрения ТЭД, основаниями называются электролиты, которые в водном растворе диссоциируют на ионы металла и
- 28. NaOH = Na+ + OH- Ba(OH)2 = BaOH+ + OH- → Ba2+ + 2OH- KOH =
- 29. С точки зрения ТЭД, соли – это электролиты, которые диссоциируют на катионы металла или аммония NH4+
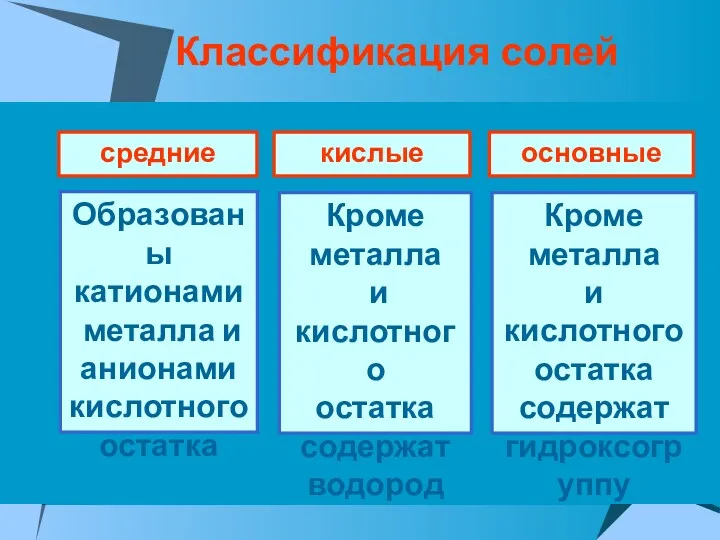
- 30. Классификация солей средние кислые основные Образованы катионами металла и анионами кислотного остатка Кроме металла и кислотного
- 31. Na2SO4 = 2Na+ + SO42- AlCl3 = Al3+ + 3Cl- Fe2(SO4)3 = 2Fe3+ + 3SO42- С
- 32. С точки зрения ТЭД, кислыми солями называются электролиты, которые в водном растворе диссоциируют на ионы металла
- 34. Скачать презентацию

























 Кислоты, их состав и названия
Кислоты, их состав и названия Обмен липидов
Обмен липидов Роль воды в химических реакциях
Роль воды в химических реакциях Органикалық қосылыстардың химиялық құрылыс теориясы, органикалық қосылыстардың структурасы және қосылыстары
Органикалық қосылыстардың химиялық құрылыс теориясы, органикалық қосылыстардың структурасы және қосылыстары Непредельные углеводороды. Этилен и его гомологи
Непредельные углеводороды. Этилен и его гомологи Процессы в растворах: электролитическая диссоциация (ЭД)
Процессы в растворах: электролитическая диссоциация (ЭД) IV группа главная подгруппа
IV группа главная подгруппа Хімічні явища в побуті. 7 клас
Хімічні явища в побуті. 7 клас Виды химических связей и типы кристаллических решеток
Виды химических связей и типы кристаллических решеток Углерод и его соединения
Углерод и его соединения Химическая кинетика. Часть II. Скорость химической реакции - развитие реакции во времени
Химическая кинетика. Часть II. Скорость химической реакции - развитие реакции во времени Неметаллические материалы
Неметаллические материалы Чистые вещества и смеси. 8 класс
Чистые вещества и смеси. 8 класс Кількість речовини. Моль - одиниця кількості речовини. Число Авогадро
Кількість речовини. Моль - одиниця кількості речовини. Число Авогадро Производство полимеров
Производство полимеров Основания. Неорганические соединения
Основания. Неорганические соединения Полиэтилен — термопластичный полимер этилена
Полиэтилен — термопластичный полимер этилена Кислотно-основное титрование
Кислотно-основное титрование Состояние радионуклидов в различных фазах и методы его изучения
Состояние радионуклидов в различных фазах и методы его изучения Поверхностные явления. Адсорбция
Поверхностные явления. Адсорбция Обучение в сотрудничестве на уроках химии
Обучение в сотрудничестве на уроках химии Ароматические азотсодержащие соединения
Ароматические азотсодержащие соединения Основания, их классификация и свойства в свете теории электролитической диссоциации
Основания, их классификация и свойства в свете теории электролитической диссоциации Кристаллы. Выращивание кристалла
Кристаллы. Выращивание кристалла Строение и свойства аминокислот и белков
Строение и свойства аминокислот и белков Автомобильные пластичные смазки
Автомобильные пластичные смазки Игра Химические элементы (формулы и названия)
Игра Химические элементы (формулы и названия) Окислительновосстановительное титрование
Окислительновосстановительное титрование