Содержание
- 2. Вещества Электролиты - вещества, растворы и расплавы которых проводят электрический ток. Неэлектролиты - вещества, растворы и
- 3. Неэлектролиты вещества, которые содержат ковалентные неполярные или малополярные связи. Эти связи не распадаются на ионы. газы,
- 4. Электролиты Вещества, которые содержат ионные и ковалентные полярные связи. Эти связи легко распадаются на ионы. Неорганические
- 5. Электролитическая диссоциация – процесс распада электролита на ионы при растворении его в воде или расплавлении
- 6. Вещества с ионной связью Кристаллическая решетка NaCl Кристалл NaCl
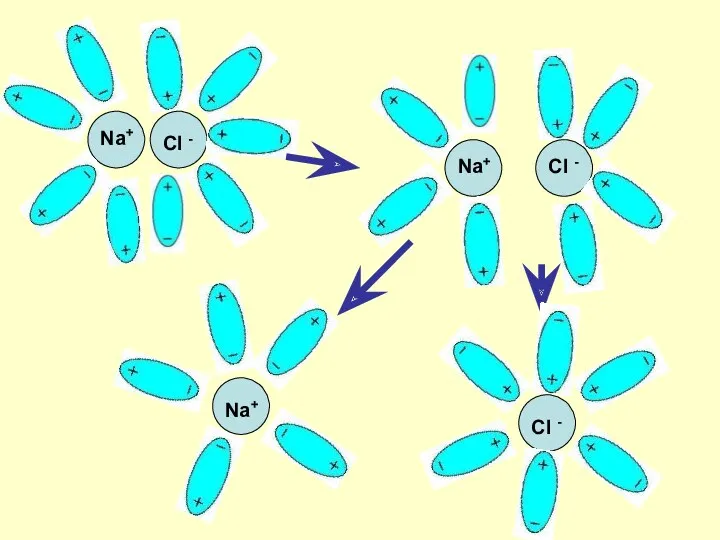
- 7. Механизм ЭД ионных веществ Ориентация диполей воды вокруг кристаллов соли. Образование между молекулами воды и ионами
- 8. Na+ Cl - Na+ Cl - Na+ Cl -
- 9. Механизм ЭД полярных веществ ориентация диполей воды вокруг полярной молекулы. еще большая поляризация полярной молекулы и
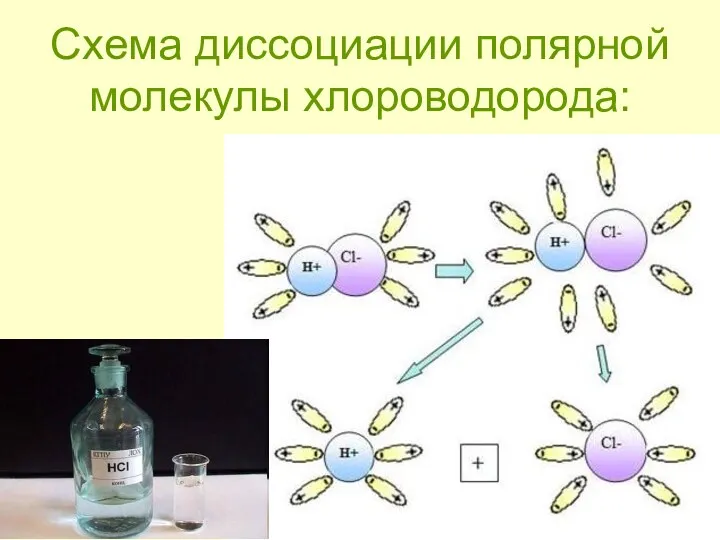
- 10. Схема диссоциации полярной молекулы хлороводорода:
- 11. Электролиты Сильные - при растворении в воде практически полностью распадаются на ионы. Слабые частично распадаются на
- 12. Сильные электролиты вещества с ионными или сильно полярными связями. все хорошо растворимые соли, сильные кислоты (HCl,
- 13. Слабые электролиты вещества с неполярными и малополярными связями: 1) почти все органические кислоты (CH3COOH, C2H5COOH и
- 14. Степень диссоциации Степень диссоциации (α) - отношение числа распавшихся на ионы молекул (n) к общему числу
- 15. Электролитическая диссоциация веществ, идущая с образованием свободных ионов объясняет электрическую проводимость растворов. CaCl2 = Ca2+ +
- 16. Диссоциация кислот осуществляется ступенчато. На каждой ступени отщепляется один ион водорода. H Cl = H+ +
- 17. Диссоциация оснований Ba(OH)2 = Ba2+ + 2OH- Сa(OH)2 = Сa2+ + 2OH- Основания - при диссоциации
- 18. Диссоциация солей Средние соли – соли, состоящие из атомов металла и кислотного остатка, диссоциируют в одну
- 19. Диссоциация солей Кислые соли – соли, в состав молекул которых кроме атомов металла входят атомы водорода,
- 20. Шведский ученый Сванте Аррениус(1859-1927) В 1887 году создал теорию ЭД. В 1903году был удостоен Нобелевской премии
- 21. Каблуков И.А. Кистяковский В.А.
- 22. Русские химики И.А.Каблуков и В.А.Кистяковский применили к объяснению электролитической диссоциации химическую теорию растворов Д.И.Менделеева и доказали,
- 23. Основные положения теории ЭД 1. Электролиты в водной среде (и в расплавленном состоянии) распадаются на положительно
- 25. Основные положения теории ЭД 2. Беспорядочное движение ионов в растворе под действием электрического поля становится направленным:
- 26. Основные положения теории ЭД 3. Диссоциация – обратимый процесс: параллельно с распадом молекул на ионы (диссоциацией)
- 27. 4. Степень электролитической диссоциации (a) зависит от природы электролита и растворителя, температуры и концентрации. Она показывает
- 28. Основные положения теории ЭД 5. Свойства ионов резко отличаются от свойств нейтральных атомов составляющих их элементов.
- 29. Источники информации: http://slovari.yandex.ru/ http://www.lyceum8.ru/himiya/4.htm http://900igr.net/fotografii/khimija/Dissotsiatsija/010-Mekhanizm-dissotsiatsii-veschestv.html http://him.1september.ru/2003/34/7.htm http://900igr.net/kartinki/khimija/Povarennaja-sol/059-K-r-i-s-t-a-l-l-y-g-a-l-i-t-a.html
- 31. Скачать презентацию


























 Предельные одноатомные спирты
Предельные одноатомные спирты Открытие Д.И. Менделеевым периодического закона. Периодическая система химических элементов
Открытие Д.И. Менделеевым периодического закона. Периодическая система химических элементов Химические реакции
Химические реакции Превращения веществ. Роль химии в жизни человека
Превращения веществ. Роль химии в жизни человека Алкиндер. Номенклатурасы, табиғатта кездесуі, физикалық және химиялық қасиеттері, алыну жолдары
Алкиндер. Номенклатурасы, табиғатта кездесуі, физикалық және химиялық қасиеттері, алыну жолдары Композиционные материалы для изоляции электрических машин
Композиционные материалы для изоляции электрических машин Ендотермічні реакції на службі людини
Ендотермічні реакції на службі людини Химиялық өнеркәсіп шикізаты . Шикізат көздері Химиялық өндірістегі энергия және энергия көздері
Химиялық өнеркәсіп шикізаты . Шикізат көздері Химиялық өндірістегі энергия және энергия көздері Твердость минералов и их применение
Твердость минералов и их применение Строение атома
Строение атома Эмульсии. Классификация эмульсий. Механизм образования и стабилизации эмульсий. Эмульгаторы
Эмульсии. Классификация эмульсий. Механизм образования и стабилизации эмульсий. Эмульгаторы Теорія горіння та вибуху
Теорія горіння та вибуху Основы химмотологии моторных топлив. Тема 3
Основы химмотологии моторных топлив. Тема 3 Биологически важные реакции карбонильных соединений. Масс-спектрометрия
Биологически важные реакции карбонильных соединений. Масс-спектрометрия Адсорбция. Раздел III
Адсорбция. Раздел III Кислоты. Определение и классификация
Кислоты. Определение и классификация Неметаллы: общая характеристика. 9 класс
Неметаллы: общая характеристика. 9 класс Благородные металлы
Благородные металлы Альдегиды и кетоны
Альдегиды и кетоны Классификация органических соединений
Классификация органических соединений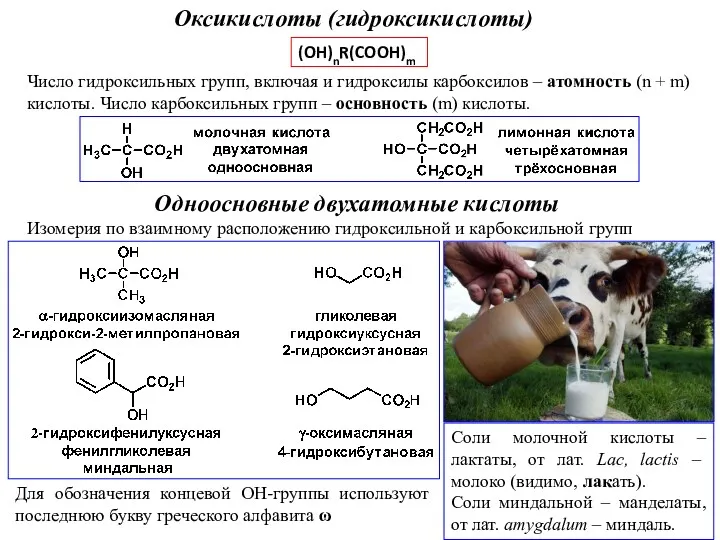 Оксикислоты (гидроксикислоты)
Оксикислоты (гидроксикислоты) Окислительно – восстановительные реакции
Окислительно – восстановительные реакции Химиялық жарыс кеші
Химиялық жарыс кеші Химическая термодинамика
Химическая термодинамика Сложные эфиры. Жиры
Сложные эфиры. Жиры Дефекты в твердых телах
Дефекты в твердых телах Water
Water Элемент цинк
Элемент цинк