Содержание
- 2. ЦЕЛИ УРОКА: 1) сформировать понятие об основаниях как электролитах; 2) рассмотреть классификацию оснований по различным признакам;
- 3. ЗАДАЧИ УРОКА: 1) учиться проводить химические реакции и записывать уравнения химических реакций в молекулярной, полной и
- 4. : Основания - это сложные вещества, в которых атом металла связан с одной или несколькими гидроксогруппами
- 5. Составить формулы оснований, образованных следующими металлами, и назвать их: 1) Cu (II) 2) Na 3) Cr
- 6. NaOH ↔ Na+ + OH– Ca(OH)2 ↔ Ca2+ +2OH– Ba(OH)2 ↔ Ba2+ +2OH– Диссоциация оснований
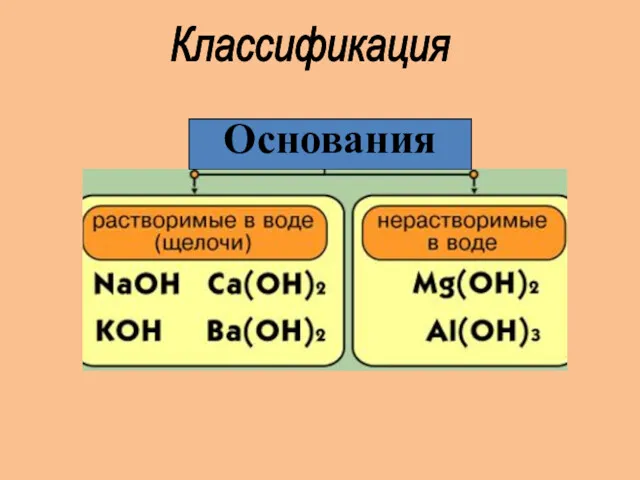
- 7. Классификация Основания
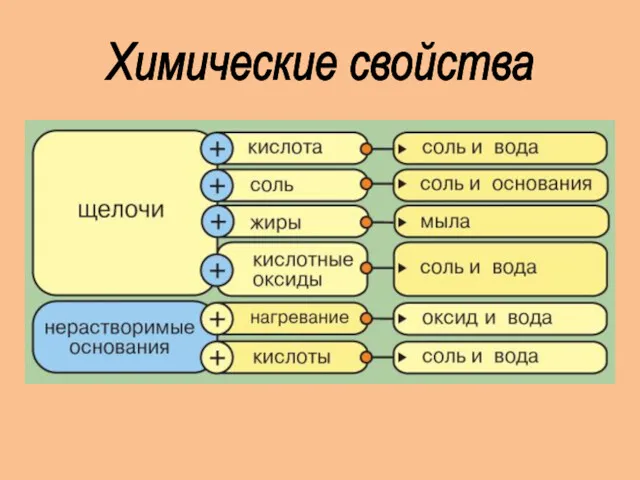
- 9. Химические свойства
- 10. ЗАПОМНИТЕ Основания ─ сложные вещества, состоящие из атома металла и одной или нескольких гидроксогрупп. Гидроксогруппа ─
- 12. Скачать презентацию






 Особенности применения проблемных моделей обучения на уроках химии
Особенности применения проблемных моделей обучения на уроках химии Кристаллография и основы кристаллохимии. Закон постоянства углов. Методы проецирования кристаллов. Лекция №6
Кристаллография и основы кристаллохимии. Закон постоянства углов. Методы проецирования кристаллов. Лекция №6 Алюминий и его соединения
Алюминий и его соединения Расчет материального и теплового баланса процесса пиролиза гексана
Расчет материального и теплового баланса процесса пиролиза гексана Неоднородные системы (процессы и аппараты химической технологии, 8 лекция)
Неоднородные системы (процессы и аппараты химической технологии, 8 лекция) Предмет аналитической химии и ее основные понятия
Предмет аналитической химии и ее основные понятия Алкадиены. Диеновые углеводороды
Алкадиены. Диеновые углеводороды Изомерия. Типы изомерии
Изомерия. Типы изомерии Химические уравнения
Химические уравнения α-Аминокислоты и белки
α-Аминокислоты и белки Відносна густина газів
Відносна густина газів Циклоалканы
Циклоалканы Окислительно-восстановительные реакции
Окислительно-восстановительные реакции Щелочной металл натрий
Щелочной металл натрий Гидролиз. Необратимый гидролиз
Гидролиз. Необратимый гидролиз Химическая промышленность
Химическая промышленность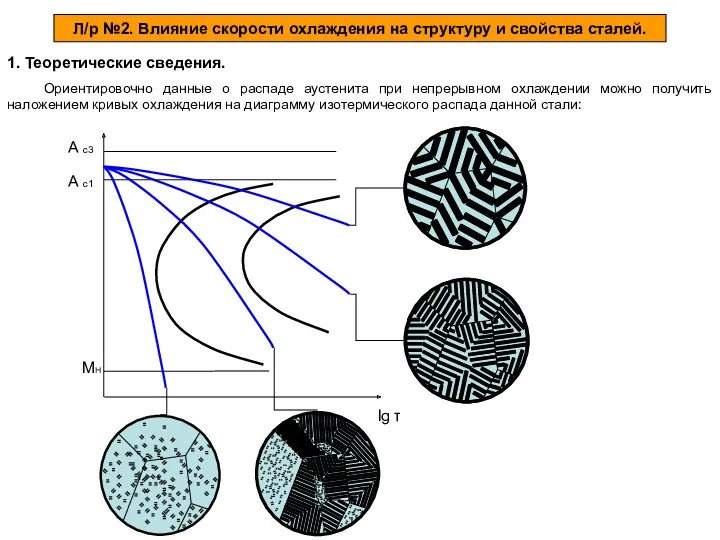 Влияние скорости охлаждения на структуру и свойства сталей
Влияние скорости охлаждения на структуру и свойства сталей Органический полимер полиэфирэфиркетон (PEEK). Использование PEEK в 3D-печати
Органический полимер полиэфирэфиркетон (PEEK). Использование PEEK в 3D-печати Высокомолекулярные соединения и супрамолекулярные структуры. (Лекция 3)
Высокомолекулярные соединения и супрамолекулярные структуры. (Лекция 3) Алотропні форми Карбону
Алотропні форми Карбону Анализ галогенидов щелочных металлов
Анализ галогенидов щелочных металлов Классификация и номенклатура липидов. Жирные кислоты, их классификация и номенклатура
Классификация и номенклатура липидов. Жирные кислоты, их классификация и номенклатура Окислительно-восстановительные реакции. 11 класс
Окислительно-восстановительные реакции. 11 класс Химический элемент водород
Химический элемент водород СВОЙСТВА ЧЕРНЫХ И ЦВЕТНЫХ МЕТАЛЛОВ.
СВОЙСТВА ЧЕРНЫХ И ЦВЕТНЫХ МЕТАЛЛОВ. Общие понятия неорганической химии. Химические свойства основных классов неорганических веществ. Лекция 3
Общие понятия неорганической химии. Химические свойства основных классов неорганических веществ. Лекция 3 Хром. Строение атома
Хром. Строение атома Особенности химического состава клетки
Особенности химического состава клетки