Содержание
- 2. Доказательство подлинности хлорид-иона Реакция осаждения с раствором серебра нитрата Методика. К 2 мл раствора хлорида (0,002-0,01
- 3. Доказательство подлинности хлорид-иона Реакция осаждения с раствором серебра нитрата Подлинность Белый творожистый осадок
- 4. осадок серебра хлорида не растворился осадок серебра хлорида растворился + HNO3 разв. +NH4OH
- 5. Доказательство подлинности бромид-иона Реакция осаждения с раствором серебра нитрата Методика. К 2 мл раствора бромида (0,002-0,01
- 6. Доказательство подлинности бромид-иона Реакция осаждения с раствором серебра нитрата Желтоватый творожистый осадок серебра бромида Подлинность
- 7. желтоватый творожистый осадок серебра бромида осадок серебра бромида трудно растворим в растворе аммиака + NH4OH
- 8. Доказательство подлинности бромид-иона Реакция окисления бромид-иона Методика. К 1 мл раствора бромида (0,002-0,03 г иона бромида)
- 9. Реакция окисления бромид-иона окрашивание хлороформного слоя в желто-бурый цвет.
- 10. Доказательство подлинности йодид-иона Реакция осаждения с раствором серебра нитрата Методика. К 2 мл раствора йодида (0,002-0,01
- 11. желтый творожистый осадок Доказательство подлинности йодид-иона Реакция осаждения с раствором серебра нитрата
- 12. Доказательство подлинности йодид-иона Реакция осаждения с раствором серебра нитрата Желтый творожистый осадок осадок серебра йодида не
- 13. Доказательство подлинности йодид-иона Реакция окисления йодид-иона Методика. К 2 мл раствора йодида (0,003-0,02 г иона йодида)
- 14. Реакция окисления йодид-иона окрашивание хлороформного слоя в фиолетовый цвет
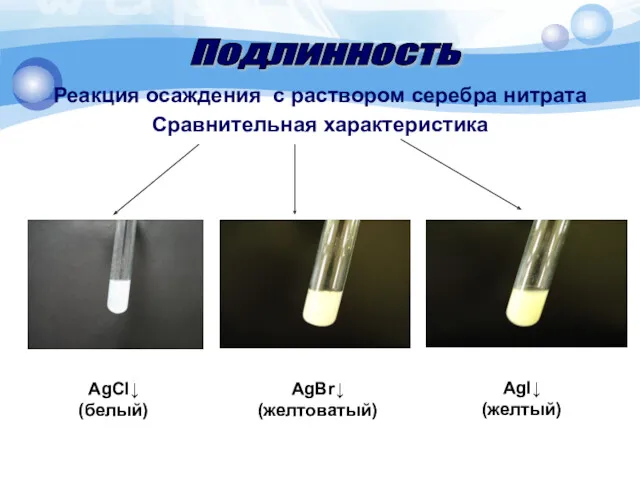
- 15. Реакция осаждения с раствором серебра нитрата Сравнительная характеристика Подлинность AgCl↓ (белый) AgBr↓ (желтоватый) AgI↓ (желтый)
- 16. Реакция окисления Сравнительная характеристика ион йодида (фиолетовый) ион бромида (желто-бурый) Подлинность
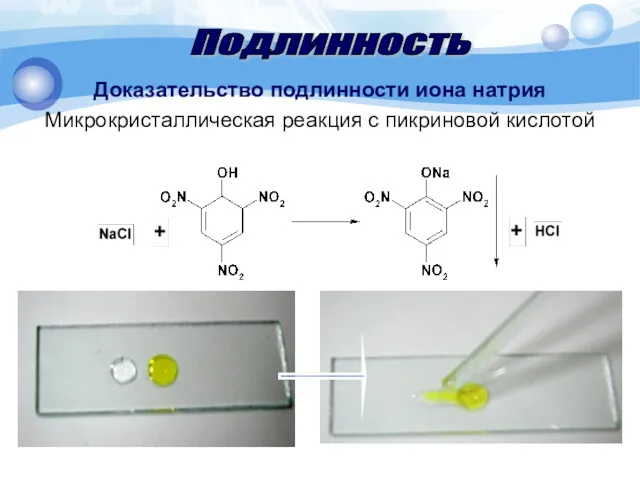
- 17. Доказательство подлинности иона натрия Микрокристаллическая реакция с пикриновой кислотой Методика. 1 каплю раствора соли натрия (0,01-0,03
- 18. Доказательство подлинности иона натрия Микрокристаллическая реакция с пикриновой кислотой Подлинность
- 19. Доказательство подлинности иона натрия Микрокристаллическая реакция с пикриновой кислотой Под микроскопом наблюдают по краям капли жёлтые
- 20. Доказательство подлинности иона калия Реакция образования осадка с винной кислотой Методика. К 2 мл раствора соли
- 21. Доказательство подлинности иона калия Реакция образования осадка с винной кислотой Условия проведения реакции: при охлаждении раствора
- 22. Доказательство подлинности иона калия Реакция образования осадка с винной кислотой белый кристаллический осадок, растворимый в разведенных
- 23. Доказательство подлинности иона калия Реакция с винной кислотой Растворение осадка + HCl +NaOH
- 24. Аргентометрический метод (вариант Фаянса, прямое титрование) Титрант: раствор серебра нитрата. Индикатор: адсорбционный - натрия эозинат. Среда:
- 25. Аргентометрический метод (вариант Фаянса, прямое титрование) Методика. Около 0,05 г (точная навеска) субстанции помещают в колбу
- 26. Взвешивают навеску субстанции на ручных весах
- 27. Переносят навеску на часовое стекло
- 28. Взвешивают стекло с навеской на аналитических весах
- 29. Переносят навеску субстанции в колбу для титрования
- 30. Взвешивают стекло на аналитических весах
- 31. Смывают остатки субстанции со стенок воронки водой очищенной
- 32. Растворяют навеску субстанции в воде
- 33. Прибавляют индикатор эозинат натрия
- 34. Прибавляют кислоту уксусную разведенную
- 35. Окраска раствора до начала титрования
- 36. Титруют 0,1 М раствором серебра нитрата до перехода окраски осадка от желтой до розовой
- 37. Окраска в конце титрования
- 38. Аргентометрический метод (вариант Мора, прямое титрование) Титрант: раствор серебра нитрата. Индикатор: калия хромат. Реакция среды: нейтральная.
- 39. Методика. 1 мл препарата помещают в колбу для титрования, прибавляют 10 мл воды, 0,1 мл 5%
- 40. Отмеривают пипеткой навеску препарата
- 41. Прибавляют 10 мл воды очищенной
- 42. Прибавляют индикатор калия хромат
- 43. Окраска раствора до начала титрования
- 44. Титруют 0,05 М раствором серебра нитрата до появления оранжево-желтого окрашивания осадка
- 45. Окраска в конце титрования
- 46. Список литературы Беликов, В.Г. Фармацевтическая химия / 4-е изд., перераб. и доп. – М., МЕДпрессинформ", 2008.
- 48. Скачать презентацию











































 Процессы проявления и фиксирования
Процессы проявления и фиксирования Периодическая система химических элементов. Периоды
Периодическая система химических элементов. Периоды Непредельные углеводороды: общая характеристика
Непредельные углеводороды: общая характеристика Көмірсутектерді пиролиздеу арқылы қарапайым олефиндерді алу
Көмірсутектерді пиролиздеу арқылы қарапайым олефиндерді алу Скорость химических реакций. Факторы, влияющие на скорость химической реакции
Скорость химических реакций. Факторы, влияющие на скорость химической реакции Растворимость веществ в воде. Растворы. 8 класс
Растворимость веществ в воде. Растворы. 8 класс Валентность химических элементов
Валентность химических элементов Химическое равновесие. Принцип Ле Шателье
Химическое равновесие. Принцип Ле Шателье Закономірності протікання хімічних реакцій
Закономірності протікання хімічних реакцій Атомы, молекулы и ионы
Атомы, молекулы и ионы Химия нефти и газа
Химия нефти и газа Кислород
Кислород Відкриття та походження хімічних елементів
Відкриття та походження хімічних елементів Чистые вещества и смеси (продолжение)
Чистые вещества и смеси (продолжение) Кондуктометрия. Кондуктометрия әдісі. Электрохимиялық әдістер
Кондуктометрия. Кондуктометрия әдісі. Электрохимиялық әдістер Поліметилметакрилат
Поліметилметакрилат Скорость химических реакций. Факторы, влияющие на скорость химической реакции
Скорость химических реакций. Факторы, влияющие на скорость химической реакции Хімія у побуті
Хімія у побуті Алкадиены
Алкадиены Коррозия металлов и способы защиты от неё
Коррозия металлов и способы защиты от неё Алкадиены
Алкадиены Закон сохранения массы веществ
Закон сохранения массы веществ Полимеры. Пластмассы. Волокна
Полимеры. Пластмассы. Волокна Методы количественного определения. Химические методы анализа
Методы количественного определения. Химические методы анализа Техники ювелирного дела. Введение в предмет. Общие сведения
Техники ювелирного дела. Введение в предмет. Общие сведения Vitaminele
Vitaminele Пробоотбор других ООС. Лекция 3
Пробоотбор других ООС. Лекция 3 Химический состав клетки. Неорганические вещества клетки. Урок 1
Химический состав клетки. Неорганические вещества клетки. Урок 1