Содержание
- 2. Изменение свойств в группе С Si Ge Sn Pb Металлические свойства увеличиваются
- 3. УГЛЕРОД И ЕГО СОЕДИНЕНИЯ
- 4. 1.Положение В ПС. 2.Заряд ядра и состав атома 3.Электронная формула 4.Возможные степени окисления 5.Простое вещество 6.Тип
- 5. План характеристики 1.Положение В ПС – 2 период IVА группа № 6 2.Заряд ядра и состав
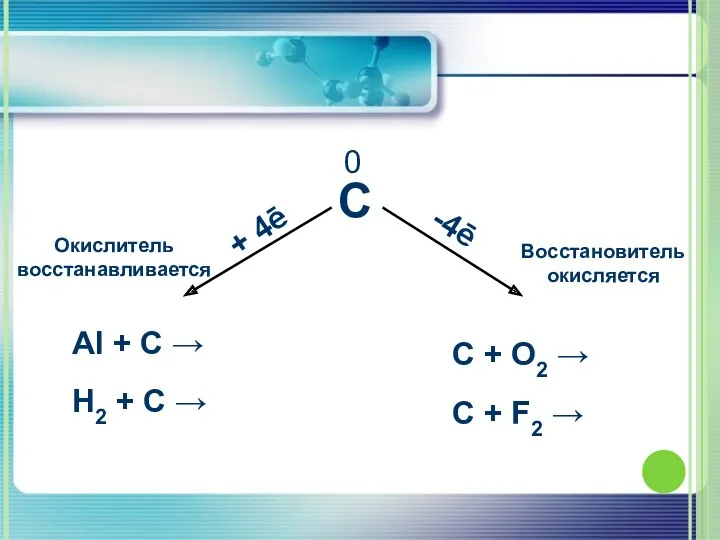
- 6. 0
- 7. Аллотропные модификации углерода Простые вещества Ковалентная неполярная
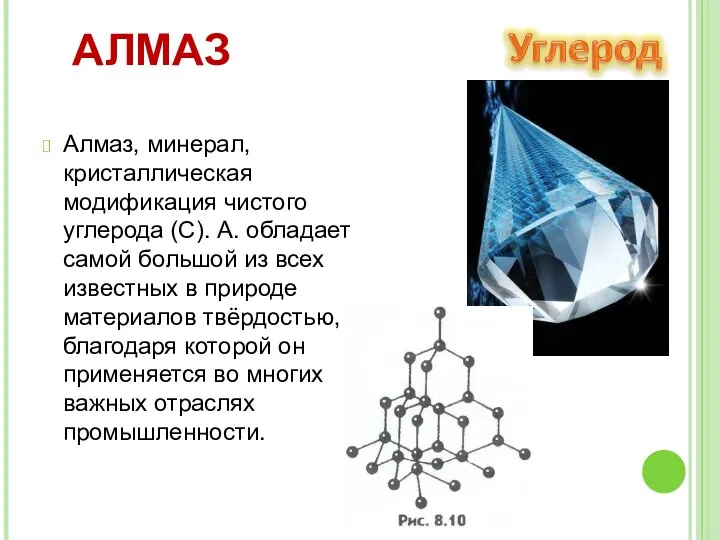
- 8. АЛМАЗ Алмаз, минерал, кристаллическая модификация чистого углерода (С). А. обладает самой большой из всех известных в
- 9. «ШАХ» Происхождение - Южная Африка.Размер – 3025 каратов Вес 605 г Самый крупный из найденных АЛМАЗ
- 10. МАЛАЯ ИМПЕРАТОРСКАЯ КОРОНА Корона создана из бриллиантовых кружев в серебряной оправе; при взгляде на нее трудно
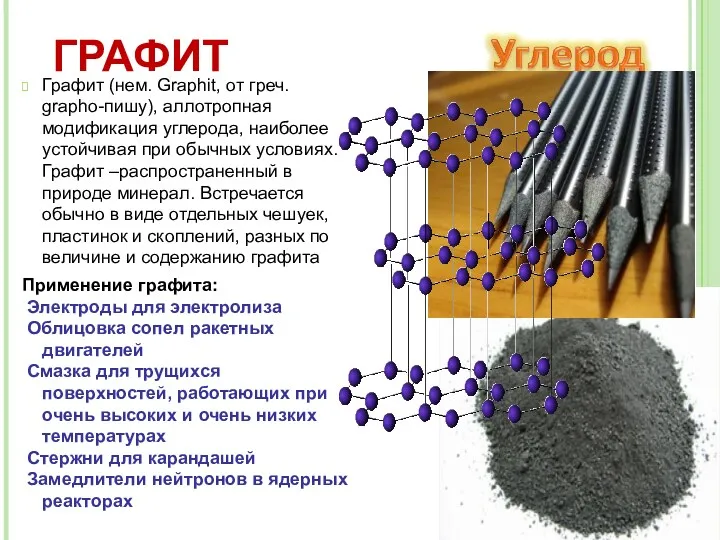
- 11. Графит (нем. Graphit, от греч. grapho-пишу), аллотропная модификация углерода, наиболее устойчивая при обычных условиях. Графит –распространенный
- 12. Фуллере́ны— молекулярные соединения, принадлежащие классу аллотропных форм углерода и представляющие собой выпуклые замкнутые многогранники, составленные из
- 13. Г Р А Ф И Т Сходное с графитом строение имеют: Сажа Древесный уголь Кокс типографская
- 14. Н.Д.Зелинский
- 15. Карбин представляет собой мелкокристаллический порошок чёрного цвета (плотность 1,9-2 г/см³), обладает полупроводниковыми свойствами. Получен в искусственных
- 16. Кристаллы толщиной в один атом или одну молекулу - графен, созданный Геймом и его коллегами, "тверже
- 17. 1. Взаимодействует с кислородом C + O2 =CO2. 2C + O2 = 2CO. 2.Взаимодействует с неметаллами
- 18. Получение Напишите 5 способов
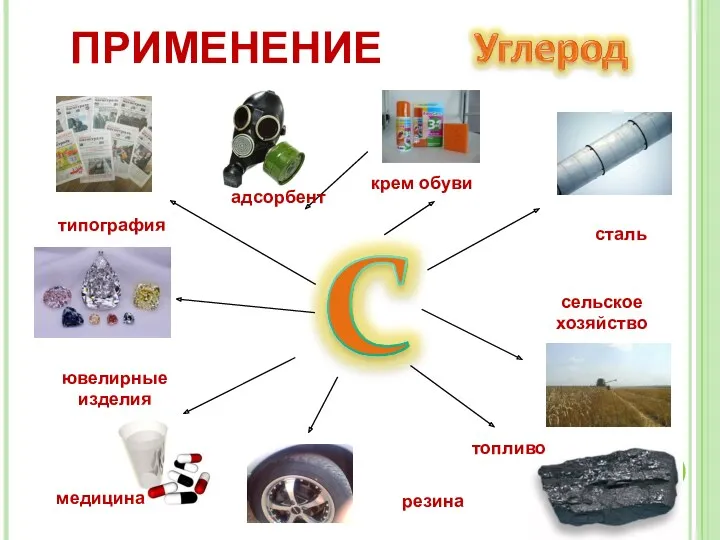
- 19. сталь сельское хозяйство топливо медицина типография ювелирные изделия адсорбент резина крем обуви ПРИМЕНЕНИЕ
- 20. 2CO + O2 = 2CO2 + Q. CO + Cl2 = COCl2. (на свету фосген) CO
- 21. CO2 + H2O = H2CO3 Na2O + CO2 = Na2CO3, Ca(OH)2 + CO2 = CaCO3 +
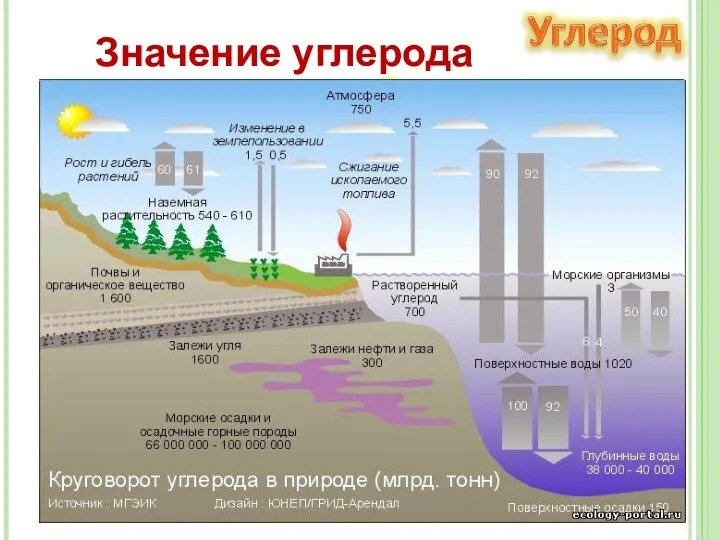
- 22. Значение углерода В процессе фотосинтеза происходит превращение солнечной энергии в химическую. Преобразование неорганических веществ в органические
- 24. Скачать презентацию
















 Относительные атомные и молекулярные массы
Относительные атомные и молекулярные массы Прикладные аспекты химии поверхностно-активных веществ
Прикладные аспекты химии поверхностно-активных веществ Липиды. Классификация липидов
Липиды. Классификация липидов Золото. История открытия
Золото. История открытия Химическая кинетика
Химическая кинетика Квантово-механический подход к описанию строения атомов
Квантово-механический подход к описанию строения атомов Органическая химия
Органическая химия Химические свойства основных оксидов
Химические свойства основных оксидов Гідроліз солей
Гідроліз солей Водород. Изотопы водорода. Свойства, получение и применение водорода. Топливные элементы
Водород. Изотопы водорода. Свойства, получение и применение водорода. Топливные элементы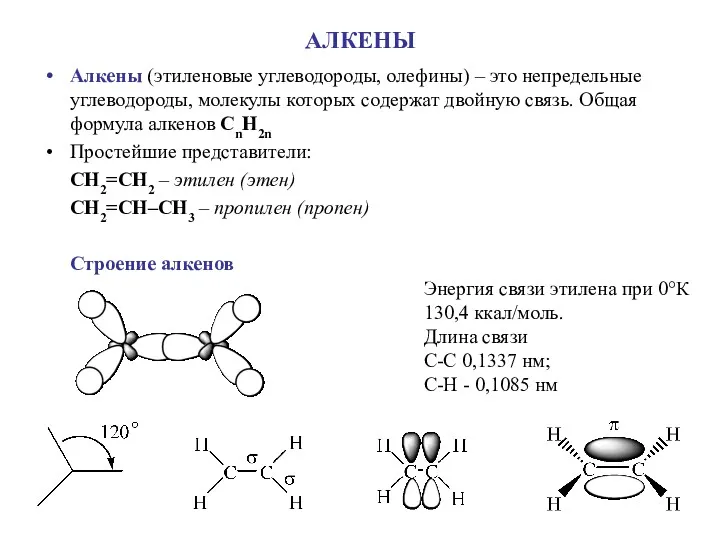 Алкены (этиленовые углеводороды, олефины)
Алкены (этиленовые углеводороды, олефины) Периодический закон Д.И. Менделеева
Периодический закон Д.И. Менделеева Тіршілік процесіне қатысатын гетерофункционалды қосылыстар
Тіршілік процесіне қатысатын гетерофункционалды қосылыстар Алкины. Тема 4
Алкины. Тема 4 Оксиды. 9 класс
Оксиды. 9 класс Понятие об алкинах
Понятие об алкинах Никель – тяжелый металл
Никель – тяжелый металл Синтетичні волокна
Синтетичні волокна Предмет и задачи химии. Вещества и их свойства (продолжение)
Предмет и задачи химии. Вещества и их свойства (продолжение)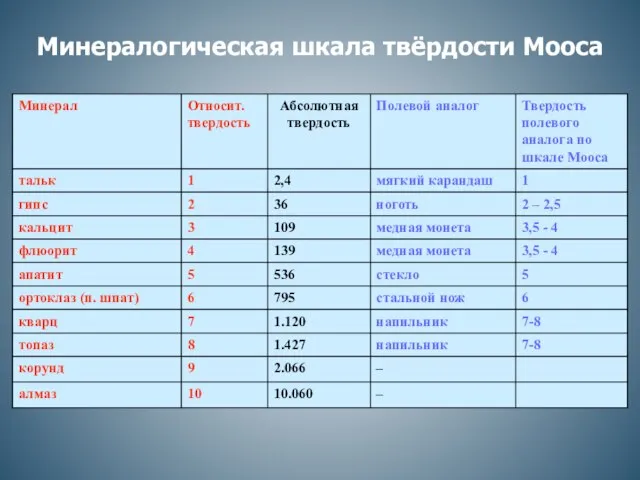 Минералогическая шкала твёрдости Мооса
Минералогическая шкала твёрдости Мооса Фотолабораторный процесс. Основные этапы фото обработки. Рентгеновского изображения
Фотолабораторный процесс. Основные этапы фото обработки. Рентгеновского изображения Гидроксикислоты (оксикислоты)
Гидроксикислоты (оксикислоты) Фосфор и его соединения. Электронные формулы атома фосфора
Фосфор и его соединения. Электронные формулы атома фосфора Химия и современный быт человека
Химия и современный быт человека Свойства воды
Свойства воды Введение в органическую химию
Введение в органическую химию Соляная кислота (HCI)
Соляная кислота (HCI) Алкены. Состав, строение, свойства и химические превращения
Алкены. Состав, строение, свойства и химические превращения