Содержание
- 2. АЛКЕНЫ Алкены (олефины, этиленовые углеводороды) - ациклические непредельные углеводороды, содержащие одну двойную связь между атомами углерода,
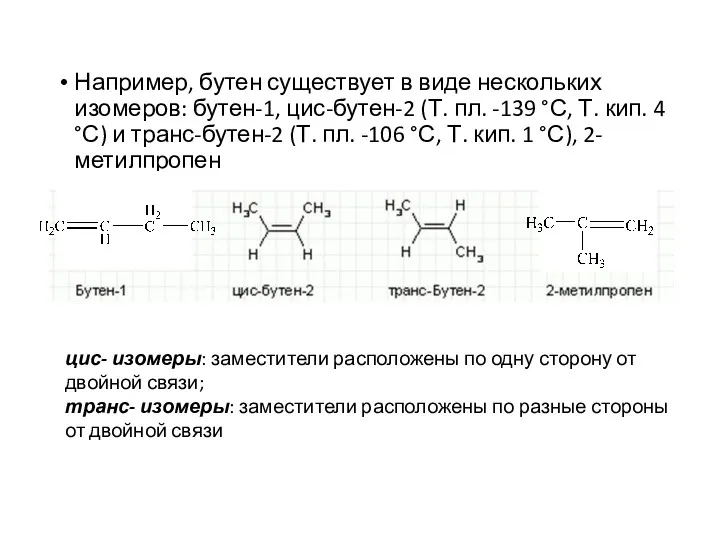
- 3. Например, бутен существует в виде нескольких изомеров: бутен-1, цис-бутен-2 (Т. пл. -139 °С, Т. кип. 4
- 4. История открытия Впервые этилен был получен в 1669 году немецким химиком и врачом Бехером действием серной
- 5. Физические свойства Температуры плавления и кипения алкенов увеличиваются с молекулярной массой и длиной главной углеродной цепи
- 6. Способы получения алкенов 1. Крекинг алканов. Используется катализатор, температура зависит от длинны цепочки
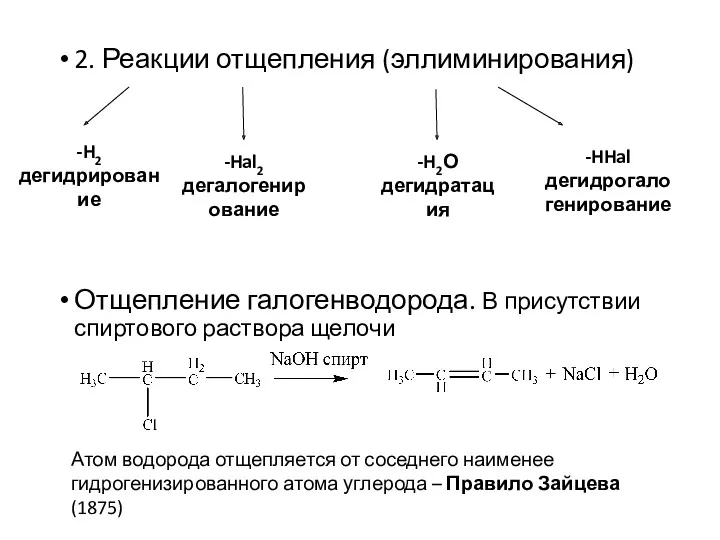
- 7. 2. Реакции отщепления (эллиминирования) Отщепление галогенводорода. В присутствии спиртового раствора щелочи -H2 дегидрирование -Hal2 дегалогенирование -H2О
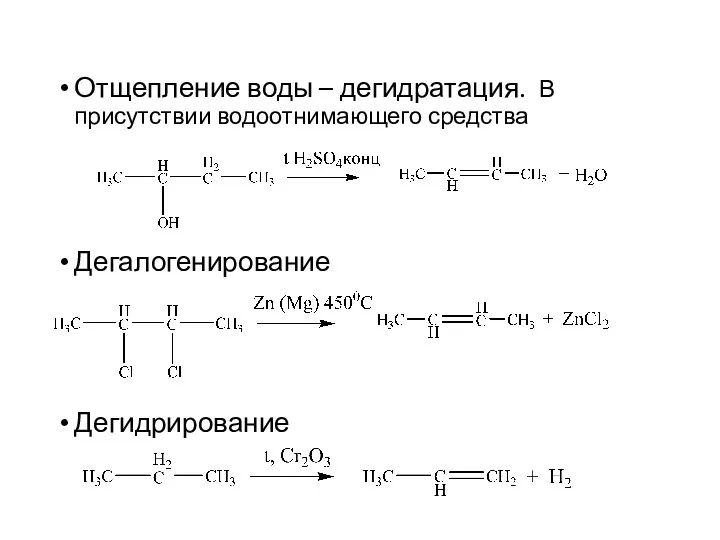
- 8. Отщепление воды – дегидратация. В присутствии водоотнимающего средства Дегалогенирование Дегидрирование
- 9. Особенности строения Молекулы алкенов содержат двойную связь, образованную одной σ- и одной π-связью Атомы углерода находятся
- 10. Реакционная способность алкенов Алкены химически активны. Их химические свойства во многом определяются наличием двойной связи Для
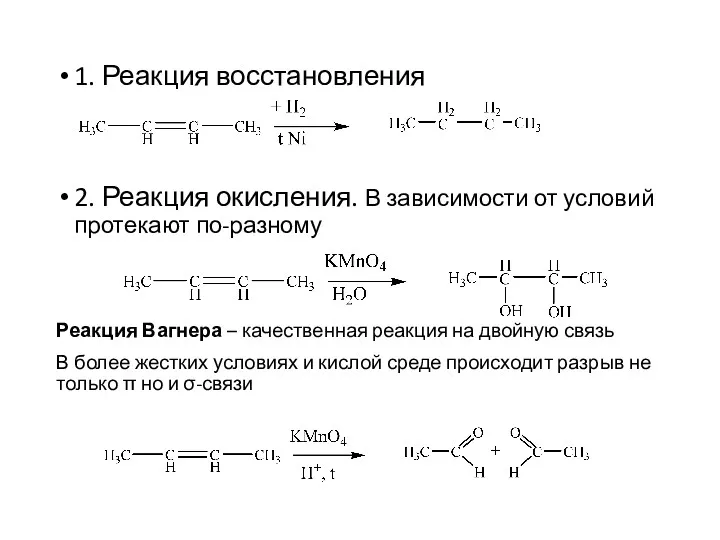
- 11. 1. Реакция восстановления 2. Реакция окисления. В зависимости от условий протекают по-разному Реакция Вагнера – качественная
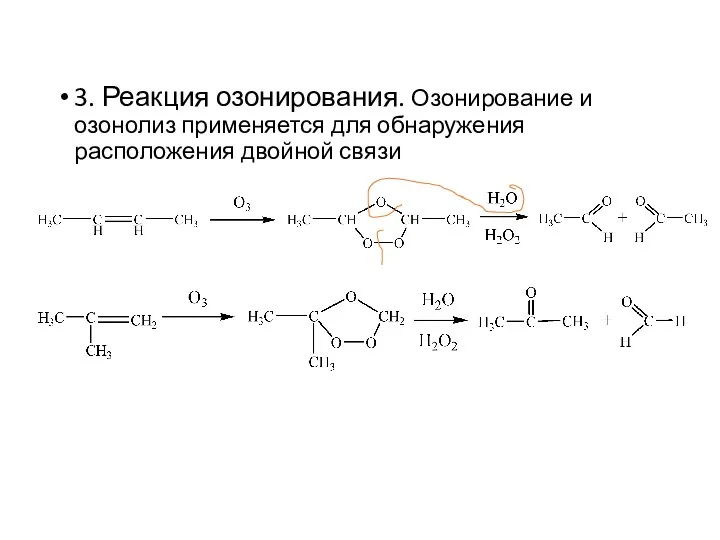
- 12. 3. Реакция озонирования. Озонирование и озонолиз применяется для обнаружения расположения двойной связи
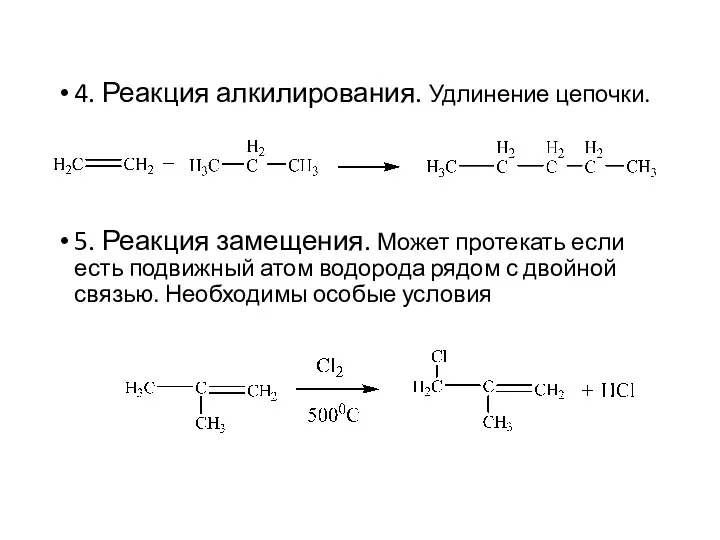
- 13. 4. Реакция алкилирования. Удлинение цепочки. 5. Реакция замещения. Может протекать если есть подвижный атом водорода рядом
- 14. 6. Реакция присоединения (электрофильного) АЕ Самые характерные реакции для алкенов. Галогенирование (присоединение галогена) Реакция с бромной
- 15. Современная трактовка правила: Электроположительная частица реагента присоединяется к атому углерода, содержащее большее число атомов водорода, а
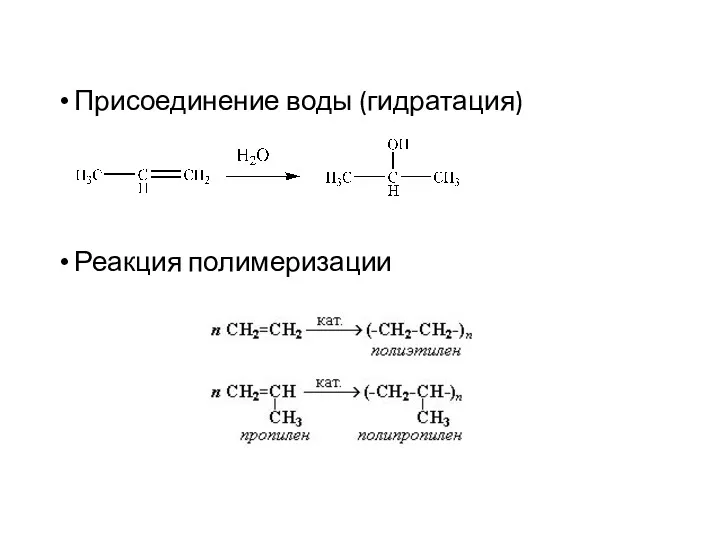
- 16. Присоединение воды (гидратация) Реакция полимеризации
- 17. АЛКИНЫ Алкины (ацетиленовые углеводороды) - углеводороды, содержащие тройную связь между атомами углерода, образующие гомологический ряд с
- 18. История открытия Впервые ацетилен был получен в 1836 году Эдмундом Дэви нагреванием уксуснокислого калия с древесным
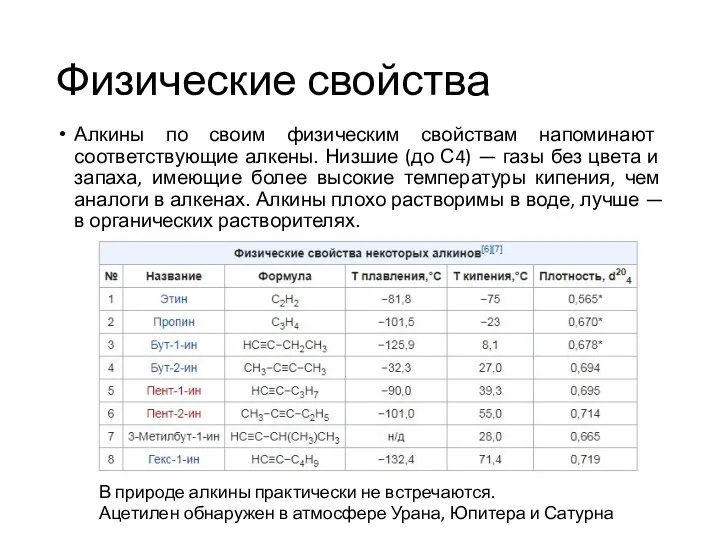
- 19. Физические свойства Алкины по своим физическим свойствам напоминают соответствующие алкены. Низшие (до С4) — газы без
- 20. Способы получения алкинов 1. Прямой синтез. при 3000 °С, используя электрическую дугу между угольными электродами в
- 21. 4. Из карбидов. Реакция сопровождается выделением тепла 5. Реакции отщепления. С использованием спиртовой щелочи при нагревании
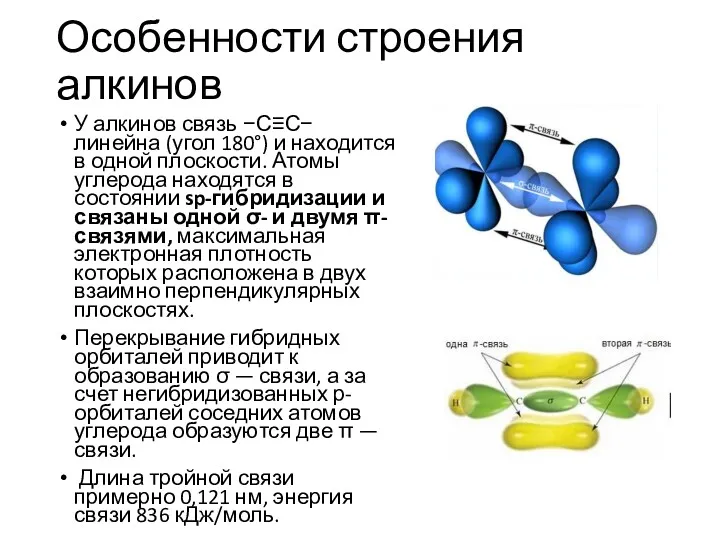
- 22. Особенности строения алкинов У алкинов связь −С≡С− линейна (угол 180°) и находится в одной плоскости. Атомы
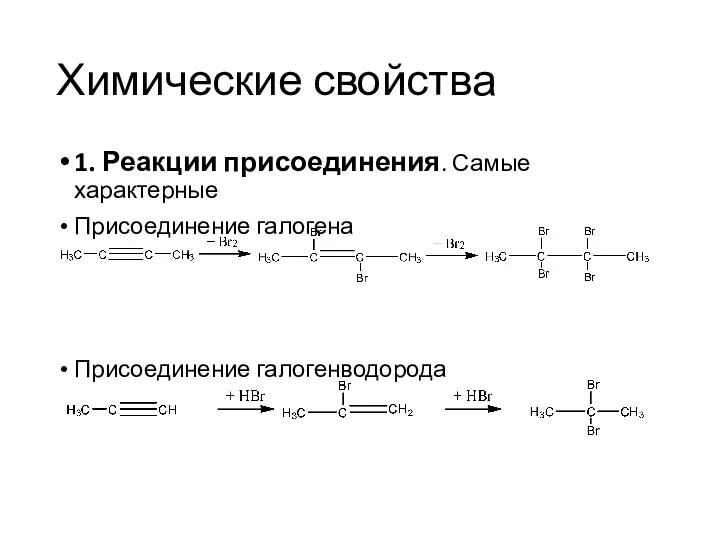
- 23. Химические свойства 1. Реакции присоединения. Самые характерные Присоединение галогена Присоединение галогенводорода
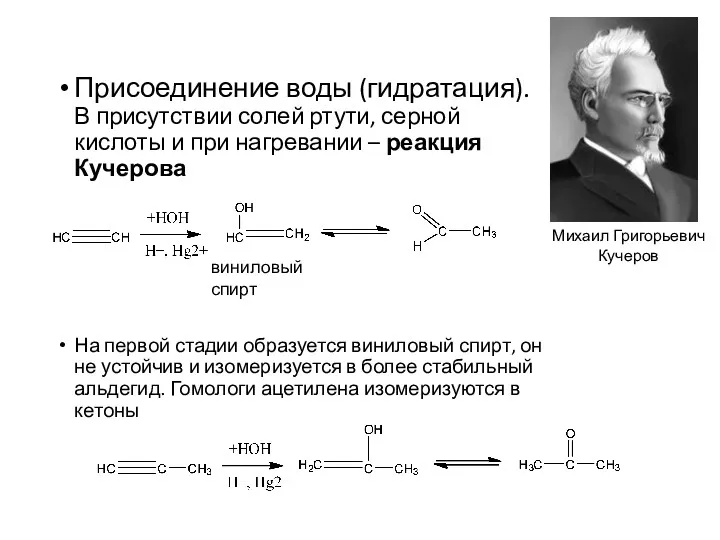
- 24. Присоединение воды (гидратация). В присутствии солей ртути, серной кислоты и при нагревании – реакция Кучерова На
- 25. 2. Реакции замещения водорода Характерны для алкинов имеющих тройную связь на конце молекулы – кислотные свойства
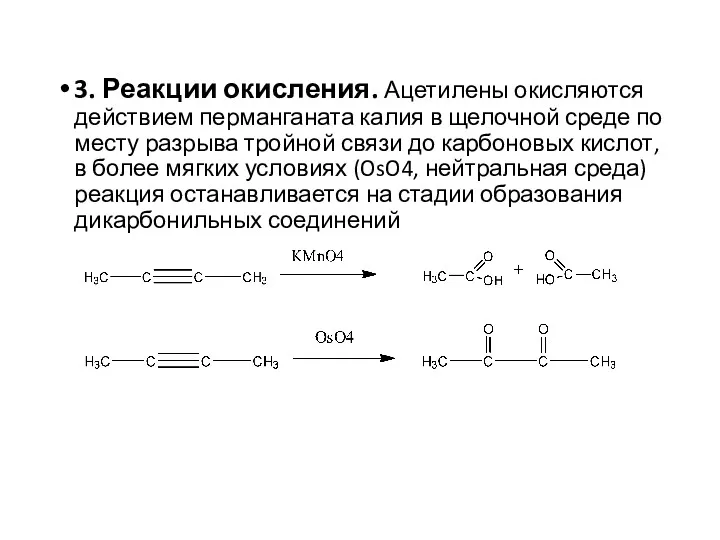
- 26. 3. Реакции окисления. Ацетилены окисляются действием перманганата калия в щелочной среде по месту разрыва тройной связи
- 28. Скачать презентацию













 Особенности строения, реакционной способности и методы синтеза азотсодержащих соединений
Особенности строения, реакционной способности и методы синтеза азотсодержащих соединений Строение атома. Теории строения атома
Строение атома. Теории строения атома Элементы подгруппы углерода
Элементы подгруппы углерода Гетерогенді химиялық реакциялар
Гетерогенді химиялық реакциялар Камни и минералы
Камни и минералы Предельные углеводороды
Предельные углеводороды Обмен простых белков. Дезаминирование и трансаминирование аминокислот
Обмен простых белков. Дезаминирование и трансаминирование аминокислот Гидролиз органических и неорганических веществ
Гидролиз органических и неорганических веществ Методы разделения и концентрирования. Хроматографические методы
Методы разделения и концентрирования. Хроматографические методы 20231116_tipy_himicheskih_reaktsiy
20231116_tipy_himicheskih_reaktsiy Збуджений стан атома. Валентні стани елементів. Можливі ступені окиснення неметалічних елементів 2-го і 3-го періодів
Збуджений стан атома. Валентні стани елементів. Можливі ступені окиснення неметалічних елементів 2-го і 3-го періодів Окисно-відновні реакції. Гальванічні елементи
Окисно-відновні реакції. Гальванічні елементи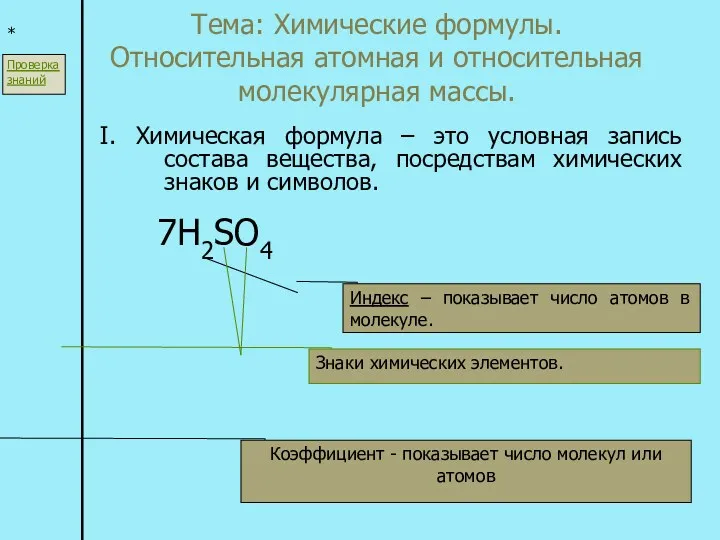 Химические формулы. Относительная атомная и относительная молекулярная массы
Химические формулы. Относительная атомная и относительная молекулярная массы Водород - топливо будущего
Водород - топливо будущего Углеводороды: предельные и непредельные
Углеводороды: предельные и непредельные Как трудно быть особенной…
Как трудно быть особенной… Alkynes
Alkynes Углеводородное сырье: способы переработки
Углеводородное сырье: способы переработки Основные положения теории растворов электролитов, используемых в аналитической химии. (Лекция 3)
Основные положения теории растворов электролитов, используемых в аналитической химии. (Лекция 3) Пластмаси та полімери
Пластмаси та полімери Определение нефтепродуктов в воде с использованием Флюората-02-5М
Определение нефтепродуктов в воде с использованием Флюората-02-5М Элемент 7 группы, побочной подгруппы, d-элемент - Mn (марганец)
Элемент 7 группы, побочной подгруппы, d-элемент - Mn (марганец) Общая и медицинская химия
Общая и медицинская химия Дисперсные системы
Дисперсные системы Получение кислот
Получение кислот Нуклеиновые кислоты. Нуклеотиды
Нуклеиновые кислоты. Нуклеотиды Органическая химия. Пособие
Органическая химия. Пособие Металлы. Свойства металлов
Металлы. Свойства металлов