Содержание
- 2. Тема: Химические формулы. Относительная атомная и относительная молекулярная массы. II. Чтение химических формул. * Примеры: NH3
- 3. Тема: Относительная атомная и относительная молекулярная массы. * I. Ar – относительная атомная масса. 1 а.е.м.
- 4. Тема: Химические формулы. Относительная атомная и относительная молекулярная массы. * II. Нахождение Ar с помощью периодической
- 5. Тема: Химические формулы. Относительная атомная и относительная молекулярная массы. * III. Mr – относительная молекулярная масса
- 6. * Определить относительную молекулярную массу. PbSiO3 AlCl3 AgNO3 ZnMnO4 C8H18 ВЕРНУТЬСЯ К ТЕМЕ УРОКА
- 7. IV. Массовая доля элемента в веществе. * I. Массовая доля - w w(Э) = n Ar(Э)
- 8. * Знаки химических элементов. - название - произношение Al Ba Ca Na K Cl S F
- 10. Скачать презентацию







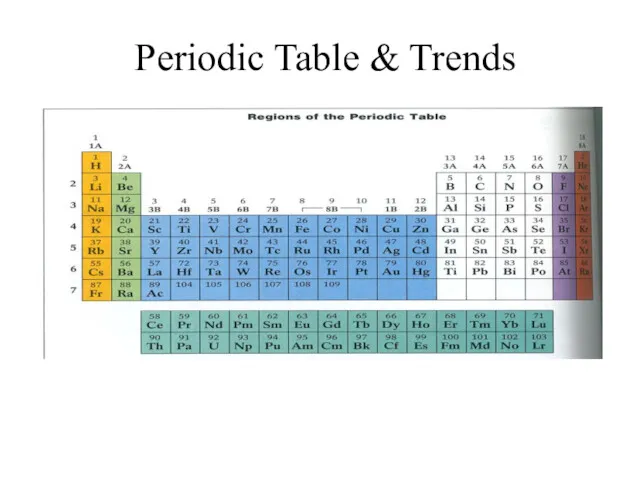 Periodic Table and Trends
Periodic Table and Trends Көмірсу. Көмірсулардың қасиеттері. Көмірсудың метаболизмі
Көмірсу. Көмірсулардың қасиеттері. Көмірсудың метаболизмі Углеводы (особенности строения, реакционной способности и методы синтеза альдегидо- и кетоспиртов)
Углеводы (особенности строения, реакционной способности и методы синтеза альдегидо- и кетоспиртов)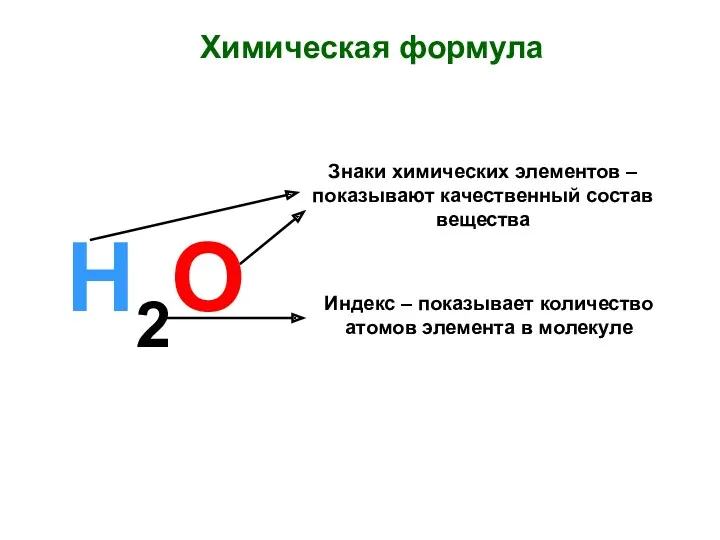 Химическая формула. Знаки химических элементов
Химическая формула. Знаки химических элементов Лихеоиндикация. Экологические аспекты переработки полимеров
Лихеоиндикация. Экологические аспекты переработки полимеров Индикаторы окислительно-восстановительного титрования. Их применение в анализе
Индикаторы окислительно-восстановительного титрования. Их применение в анализе Химические свойства алкенов
Химические свойства алкенов Механизмы реакций органических соединений
Механизмы реакций органических соединений Закономірності протікання хімічних реакцій
Закономірності протікання хімічних реакцій Удивительный мир камня
Удивительный мир камня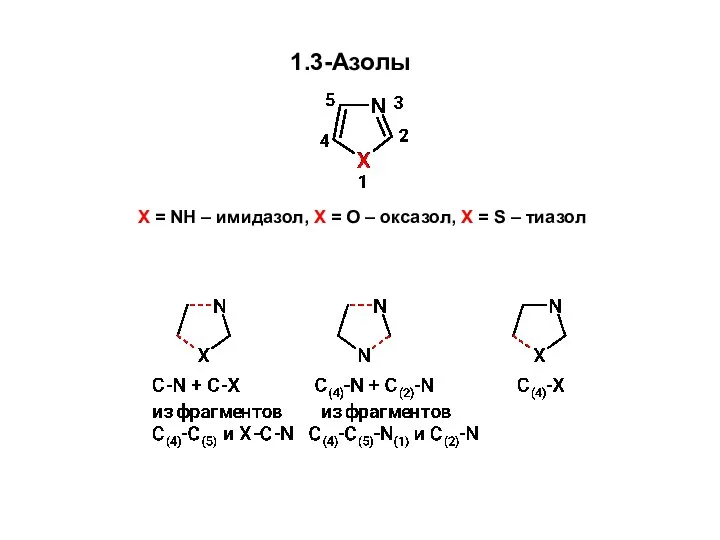 Образование связей C-N и C-X Синтез 1,3-азолов из углеродного фрагмента С(4)-С(5) и фрагмента X-C-N
Образование связей C-N и C-X Синтез 1,3-азолов из углеродного фрагмента С(4)-С(5) и фрагмента X-C-N Амины. Классификация аминов. Характеристика метиламина и анилина
Амины. Классификация аминов. Характеристика метиламина и анилина Гигиена труда при работе с пестицидами и минеральными удобрениями
Гигиена труда при работе с пестицидами и минеральными удобрениями ЕГЭ 2017. Подготовка к вопросу № 26
ЕГЭ 2017. Подготовка к вопросу № 26 Ask the right question to find the best answer
Ask the right question to find the best answer Введение. Теория строения органических соединений А.М.Бутлерова. Лекция № 1
Введение. Теория строения органических соединений А.М.Бутлерова. Лекция № 1 Химический турнир
Химический турнир Коллигативные свойства растворов
Коллигативные свойства растворов Решение заданий по теме Химические свойства основных классов неорганических веществ
Решение заданий по теме Химические свойства основных классов неорганических веществ Granite
Granite Воздух и его состав. 8 класс
Воздух и его состав. 8 класс Классификация минералов
Классификация минералов Нефть и способы ее переработки. (10 класс)
Нефть и способы ее переработки. (10 класс) Горение жидкостей
Горение жидкостей Основания
Основания Железо-углеродистые сплавы
Железо-углеродистые сплавы Алотропні модифікації фосфору
Алотропні модифікації фосфору Готовимся к экзамену по химии. 9 класс
Готовимся к экзамену по химии. 9 класс