Особенности строения, реакционной способности и методы синтеза азотсодержащих соединений презентация
Содержание
- 2. НИТРОСОЕДИНЕНИЯ Нитросоединения R-NO2, Ar-NO2 – очень важный класс азотистых производных. Классификация нитросоединений производится в зависимости от
- 3. НИТРОСОЕДИНЕНИЯ Строение и физические свойства Нитрогруппа сильно полярна В каждой из граничных структур показана семиполярная связь
- 4. НИТРОСОЕДИНЕНИЯ Строение и физические свойства -NO2 электроноакцепторная группа (-I, -M – эффекты)
- 5. НИТРОСОЕДИНЕНИЯ Строение и физические свойства Нитроалканы представляют собой бесцветные жидкости с высокими для их молекулярных масс
- 6. НИТРОСОЕДИНЕНИЯ Химические свойства Термодинамическая неустойчивость нитросоединений Молярная теплота разложения нитрометана около 270 кДж/моль СН3NO2→ 1/2 N2
- 7. НИТРОСОЕДИНЕНИЯ Восстановление нитросоединений до аминов Восстановление нитросоединений до аминов – наиболее важная реакция для синтеза азотсодержащих
- 8. НИТРОСОЕДИНЕНИЯ Восстановление нитросоединений до аминов Реакция восстановления нитроаренов протекает гладко при действии олова или железа в
- 9. НИТРОСОЕДИНЕНИЯ Восстановление нитросоединений до аминов Реакция гидрирования очень экзотермична
- 10. НИТРОСОЕДИНЕНИЯ ЗИНИН Николай Николаевич (25.VIII.1812–18.II.1880) академик, возглавлял кафедру общей химии Медико-хирургической академии в Петербурге, организатор и
- 11. НИТРОСОЕДИНЕНИЯ Восстановление в кислой среде
- 12. НИТРОСОЕДИНЕНИЯ В щелочной среде В зависимости от условий восстановление можно остановить на одной из стадий. Например,
- 13. НИТРОСОЕДИНЕНИЯ Гидразобензол в сильнокислой среде претерпевает необычную перегруппировку, приводящую к образованию бензидина – очень важного промежуточного
- 14. НИТРОСОЕДИНЕНИЯ Реакции с участием α-водородных атомов Механизм Стабилизация промежуточного продукта (II) осуществляется за счет переноса протона
- 15. НИТРОСОЕДИНЕНИЯ Нитрование алканов. Реакция Коновалова Известно несколько способов нитрования алканов. По жидкофазному способу алканы нитруют разбавленной
- 16. НИТРОСОЕДИНЕНИЯ R–X + NaNO2 → R–NO2 + NaX Способы получения Замещение галогена на нитрогруппу в галогеналканах
- 17. НИТРОСОЕДИНЕНИЯ Способы получения Нитроарены можно получить реакцией соли диазония с нитритом натрия и солью одновалентной меди
- 18. АМИНЫ Амины – производные аммиака NH3. В соответствии с числом алкильных или арильных групп, связанных с
- 19. АМИНЫ .В зависимости от природы углеводородных заместителей амины бывают алифатические, ароматические и алкилароматические
- 20. АМИНЫ Строение и физические свойства В молекуле аммиака атом азота находится в sp3-гибридном состоянии. Три гибридные
- 21. АМИНЫ Строение и физические свойства Простейшие алифатические амины – метиламин, диметиламин и триметиламин – газы, хорошо
- 22. АМИНЫ Химические свойства Многие химические свойства аминов обусловлены стремлением аминов обобществить неподеленную пару электронов азота с
- 23. АМИНЫ Основность Образование солей аммония при действии водных растворов минеральных кислот свидетельствует о том, что амины
- 24. АМИНЫ Основность Амины вытесняются из солей аммония при действии гидроксид-иона, т.е. амины более слабые основания, чем
- 25. АМИНЫ Структура и основность Наличие заместителей оказывает сильное влияние на основность. Алифатические амины – более сильные
- 26. АМИНЫ Структура и основность Влияние заместителей на основность ароматических аминов Ароматические амины более слабые основания, чем
- 27. АМИНЫ Реакции с участием аминогруппы Алкилирование Амины могут реагировать с алкилгалогенидами, при этом образуется более алкилированный
- 28. АМИНЫ Реакции с участием аминогруппы Алкилирование Свободный амин выделяется обработкой основанием При аминолизе первичных галогеналканов главный
- 29. АМИНЫ Аммиак реагирует с хлорангидридами карбоновых кислот и сульфокислот с образованием амидов Реакции с участием аминогруппы
- 30. АМИНЫ Реакции с участием аминогруппы Ацилирование аминов Аналогичным образом взаимодействуют первичные и вторичные амины
- 31. АМИНЫ Электрофильное замещение в кольце ароматических аминов При рассмотрении электрофильного замещения в ароматическом ядре амина, амида
- 32. АМИНЫ Реакция бромирования анилина протекает очень быстро, все свободные о-, п-атомы водорода замещаются галогеном Электрофильное замещение
- 33. АМИНЫ Электрофильное замещение в кольце ароматических аминов Галогенирование Однако можно ввести один атом брома, предварительно проацилировав
- 34. АМИНЫ Электрофильное замещение в кольце ароматических аминов Нитрование Нитрование проводят с использованием ацетилированного, а не чистого
- 35. АМИНЫ Электрофильное замещение в кольце ароматических аминов Сульфирование Анилин сульфируется спеканием его соли, гидросульфата анилиния, при
- 36. АМИНЫ Сульфонамиды (амиды сульфокислот) Амиды сульфаниловой кислоты и некоторые родственные амиды представляют значительный интерес для медицины
- 37. АМИНЫ Реакции аминов с азотистой кислотой Первичные амины ароматического ряда реагируют с азотистой кислотой с образованием
- 38. АМИНЫ Реакции аминов с азотистой кислотой Первичные амины На первой стадии при взаимодействии нитрита натрия с
- 39. АМИНЫ Реакции аминов с азотистой кислотой Первичные амины Первичные алифатические амины также дают соли диазония, но
- 40. АМИНЫ Реакции аминов с азотистой кислотой Вторичные амины Вторичные амины как ароматические, так и алифатические образуют
- 41. АМИНЫ Реакции аминов с азотистой кислотой Третичные амины Третичные ароматические амины взаимодействуют с азотистой кислотой с
- 42. АМИНЫ Реакции аминов с азотистой кислотой Третичные амины Третичные алифатические амины в мягких условиях (разбавленные растворы,
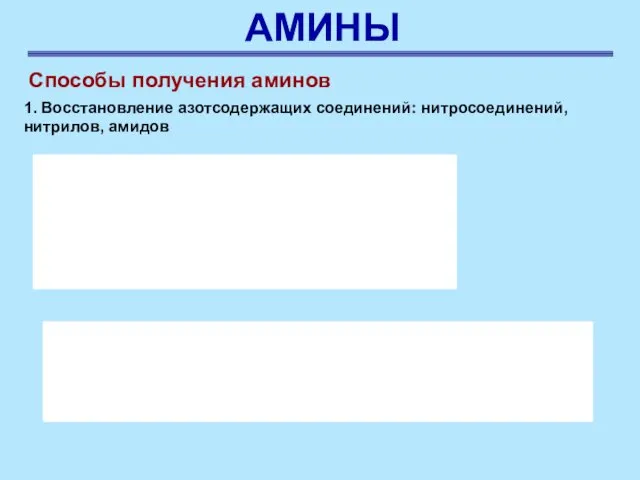
- 43. АМИНЫ Способы получения аминов 1. Восстановление азотсодержащих соединений: нитросоединений, нитрилов, амидов Азотсодержащие соединения можно восстановить каталитическим
- 44. АМИНЫ Способы получения аминов 1. Восстановление азотсодержащих соединений: нитросоединений, нитрилов, амидов
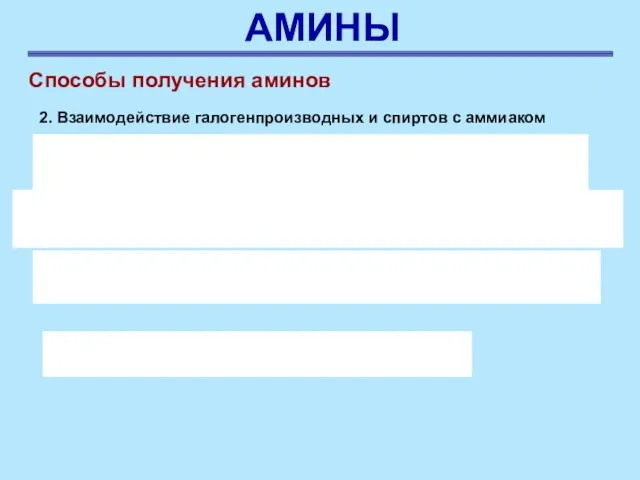
- 45. АМИНЫ Способы получения аминов 2. Взаимодействие галогенпроизводных и спиртов с аммиаком
- 46. АМИНЫ Способы получения аминов 3. Восстановительное аминирование Альдегиды и кетоны при обработке аммиаком или амином и
- 47. ДИАЗОСОЕДИНЕНИЯ. СОЛИ ДИАЗОНИЯ Соединения, в которых группа –N2– связана с углеводородным радикалом и неуглеводородным радикалом Х,
- 48. ДИАЗОСОЕДИНЕНИЯ. СОЛИ ДИАЗОНИЯ Ароматические соли диазония Ароматические диазопроизводные
- 49. ДИАЗОСОЕДИНЕНИЯ. СОЛИ ДИАЗОНИЯ Химические свойства солей диазония Реакции солей диазония с выделением азота
- 50. ДИАЗОСОЕДИНЕНИЯ. СОЛИ ДИАЗОНИЯ Химические свойства солей диазония Реакции солей диазония с выделением азота
- 51. ДИАЗОСОЕДИНЕНИЯ. СОЛИ ДИАЗОНИЯ Химические свойства солей диазония Реакции солей диазония с выделением азота
- 52. ДИАЗОСОЕДИНЕНИЯ. СОЛИ ДИАЗОНИЯ Замещение диазогруппы на хлор и бром осуществляют, смешивая свежеприготовленный раствор соли диазония с
- 53. ДИАЗОСОЕДИНЕНИЯ. СОЛИ ДИАЗОНИЯ Замещение на CN, синтез карбоновых кислот Таким образом, нитросоединения можно превращать в карбоновые
- 54. ДИАЗОСОЕДИНЕНИЯ. СОЛИ ДИАЗОНИЯ Замещение на ОН Эта реакция медленно протекает даже в ледяном растворе, и это
- 55. ДИАЗОСОЕДИНЕНИЯ. СОЛИ ДИАЗОНИЯ Замещение на Н Соль диазония, оставленная стоять в присутствии восстановителя (чаще всего Н3РО2),
- 56. ДИАЗОСОЕДИНЕНИЯ. СОЛИ ДИАЗОНИЯ Реакции солей диазония без выделения азота. Азосочетание Соли диазония в определенных условиях реагируют
- 57. ДИАЗОСОЕДИНЕНИЯ. СОЛИ ДИАЗОНИЯ Реакции солей диазония без выделения азота. Азосочетание Механизм реакции – электрофильное замещение SEAr.
- 58. ДИАЗОСОЕДИНЕНИЯ. СОЛИ ДИАЗОНИЯ Сочетание с аминами Высокая кислотность среды способствует тому, что диазосоединение полностью находится в
- 59. ДИАЗОСОЕДИНЕНИЯ. СОЛИ ДИАЗОНИЯ Реакции солей диазония без выделения азота. Азосочетание Во-вторых, если предположить, что азокомпонент образует
- 61. Скачать презентацию
























































 Неметаллы. Обобщающий урок. 9 класс
Неметаллы. Обобщающий урок. 9 класс Чистые вещества и смеси. 8 класс
Чистые вещества и смеси. 8 класс Періодична система хімічних елементів. Хімія. 8 клас
Періодична система хімічних елементів. Хімія. 8 клас Bioorganic chemistry
Bioorganic chemistry Побочная подгруппа. 8 группы
Побочная подгруппа. 8 группы Железо. Физические свойства
Железо. Физические свойства Introduction to Periodic Table
Introduction to Periodic Table Химия органических соединений. Углеводороды
Химия органических соединений. Углеводороды Важнейшие классы бинарных соединений
Важнейшие классы бинарных соединений Современные конструкционные материалы
Современные конструкционные материалы Алкадиены. Химические свойства алкадиенов
Алкадиены. Химические свойства алкадиенов Пестициды. Применение пестицидов
Пестициды. Применение пестицидов Общая характеристика элементов V-А-группы. Азот
Общая характеристика элементов V-А-группы. Азот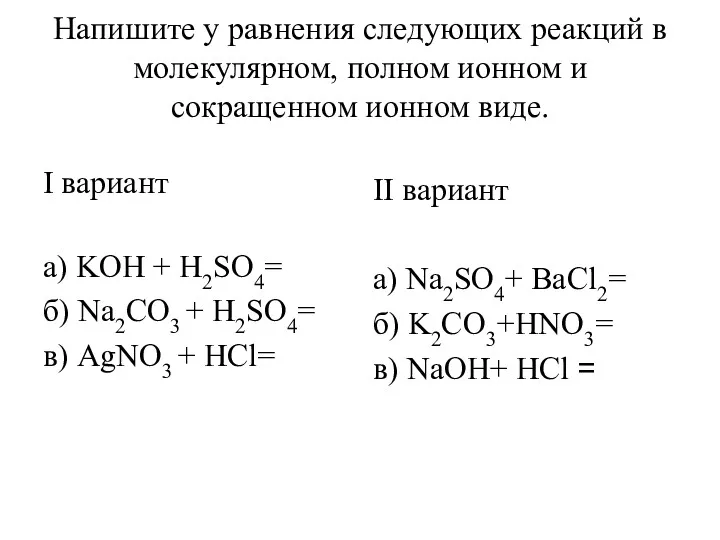 Уравнения реакций в молекулярном, полном ионном и сокращенном ионном виде
Уравнения реакций в молекулярном, полном ионном и сокращенном ионном виде Study of the properties of halogens and the determination of halide ions in aqueous solution
Study of the properties of halogens and the determination of halide ions in aqueous solution Лекция 2. Строение атома и Периодический закон Д.И. Менделеева
Лекция 2. Строение атома и Периодический закон Д.И. Менделеева Высокомолекулярные соединения. Общие понятия
Высокомолекулярные соединения. Общие понятия Комбинированные задачи. 11 класс
Комбинированные задачи. 11 класс Химическая связь. Кристаллические решетки. (Лекция 2.2)
Химическая связь. Кристаллические решетки. (Лекция 2.2) Каталитический риформинг
Каталитический риформинг Смазочные материалы. Моторные масла
Смазочные материалы. Моторные масла Соли. Классификация. Физические и химические свойства. Получение и применение солей
Соли. Классификация. Физические и химические свойства. Получение и применение солей Производство серной кислоты
Производство серной кислоты Выращивание кристаллов в домашних условиях
Выращивание кристаллов в домашних условиях Полимеры в нашей жизни (10 класс)
Полимеры в нашей жизни (10 класс) Химические свойства металлов. Электрохимический ряд напряжения металлов
Химические свойства металлов. Электрохимический ряд напряжения металлов Соли, их классификация и свойства
Соли, их классификация и свойства Углеводороды. Предельные (насыщенные) углеводороды
Углеводороды. Предельные (насыщенные) углеводороды