Содержание
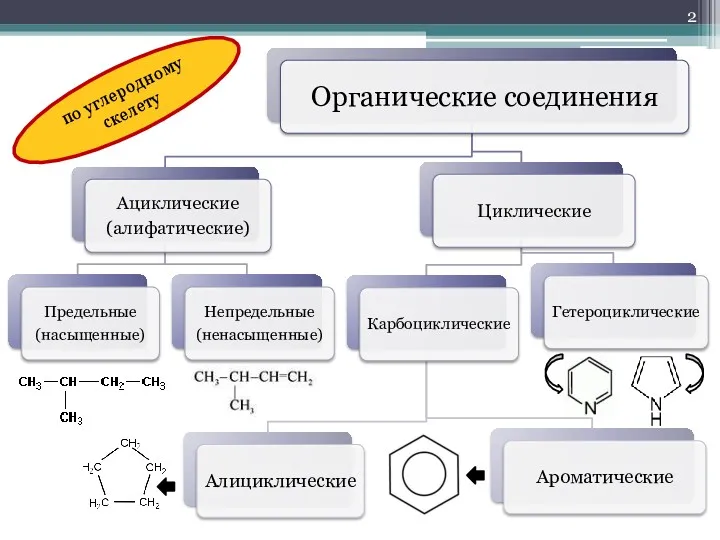
- 2. по углеродному скелету
- 3. по функциональным группам = O
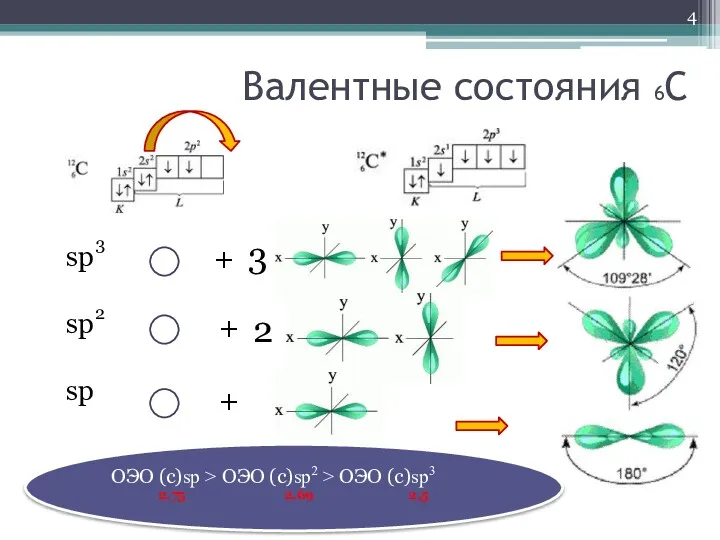
- 4. Валентные состояния 6С sp sp sp 2 3 + + + 3 2 ОЭО (с)sp >
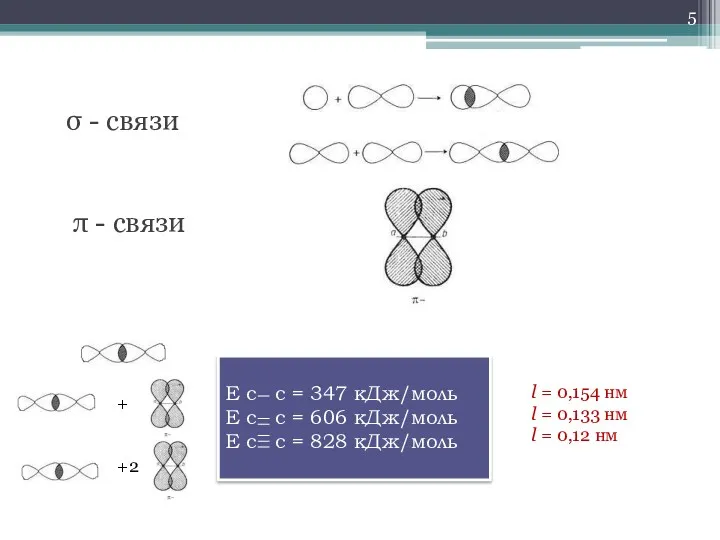
- 5. σ - связи π - связи Е с с = 347 кДж/моль Е с с =
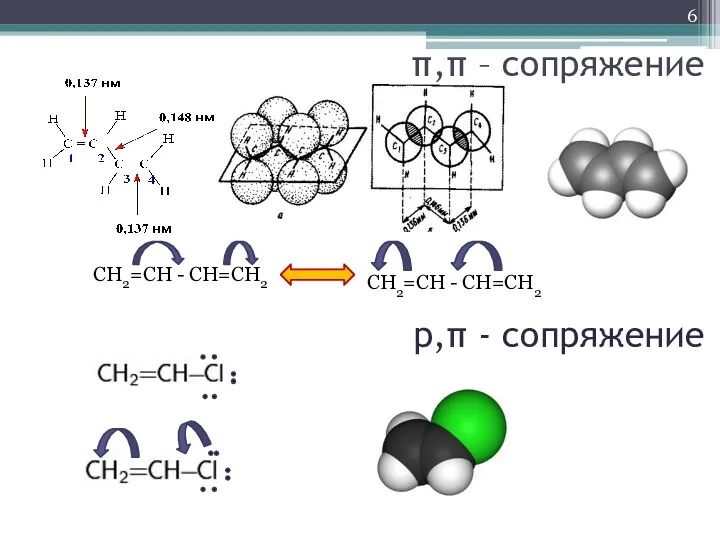
- 6. π,π – сопряжение СН2=СН - СН=СН2 СН2=СН - СН=СН2 р,π - сопряжение
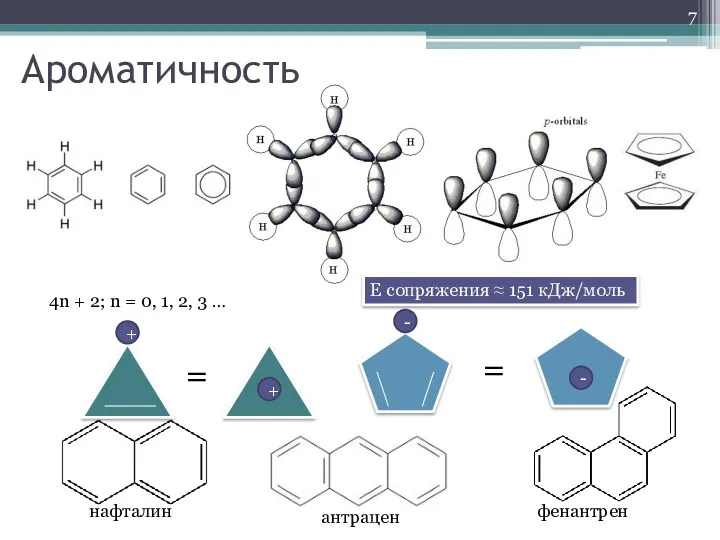
- 7. Ароматичность Е сопряжения ≈ 151 кДж/моль 4n + 2; n = 0, 1, 2, 3 …
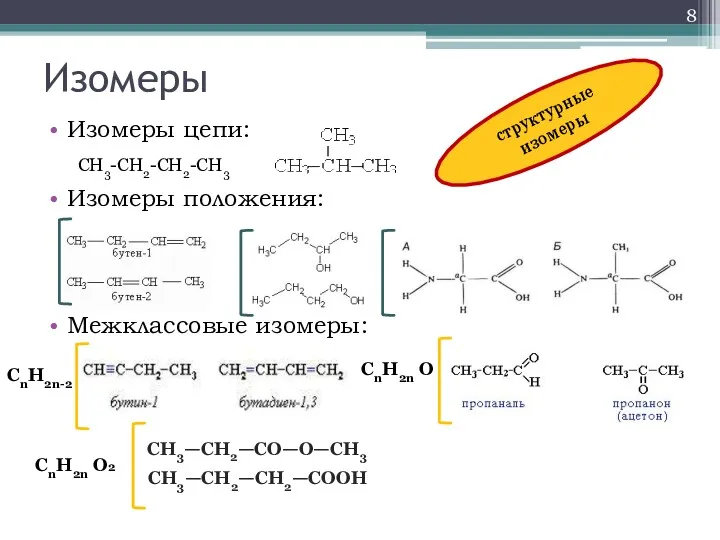
- 8. Изомеры Изомеры цепи: Изомеры положения: Межклассовые изомеры: CH3-CH2-CH2-CH3 СН3—СН2—СН2—СООН СН3—СН2—СО—О—СН3 CnH2n-2 CnH2n О CnH2n О2 структурные
- 9. Конформационные (“поворотные”) Конфигурационные: Энантиомеры (“зеркальные”) Диастереомеры σ—диастереомерия: π—диастереомерия (геометрическая изомерия): стереоизомеры Стереоизомеры
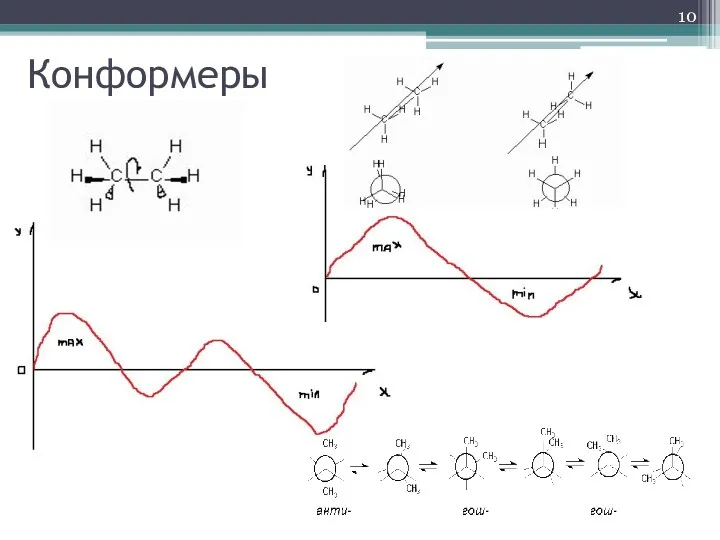
- 10. Конформеры
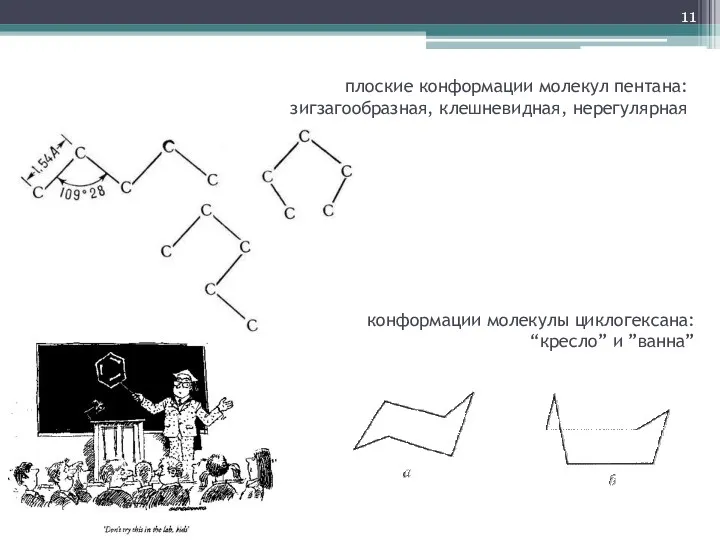
- 11. плоские конформации молекул пентана: зигзагообразная, клешневидная, нерегулярная конформации молекулы циклогексана: “кресло” и ”ванна”
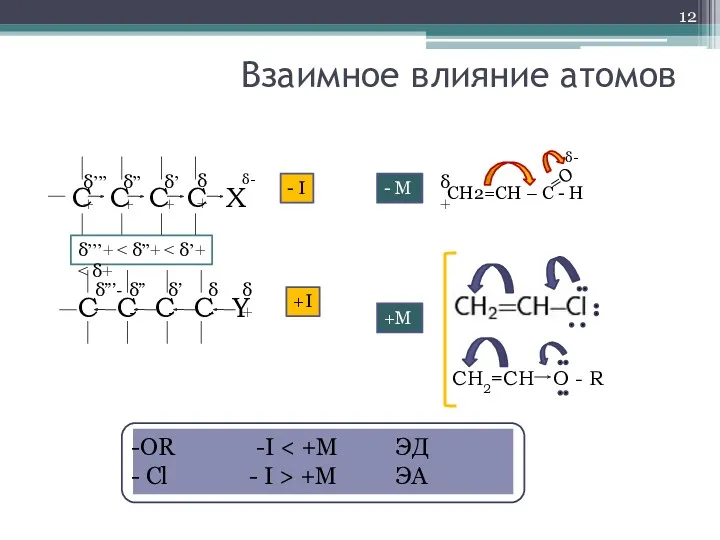
- 12. δ+ Взаимное влияние атомов С C C C X C C C C Y δ’’’+ δ-
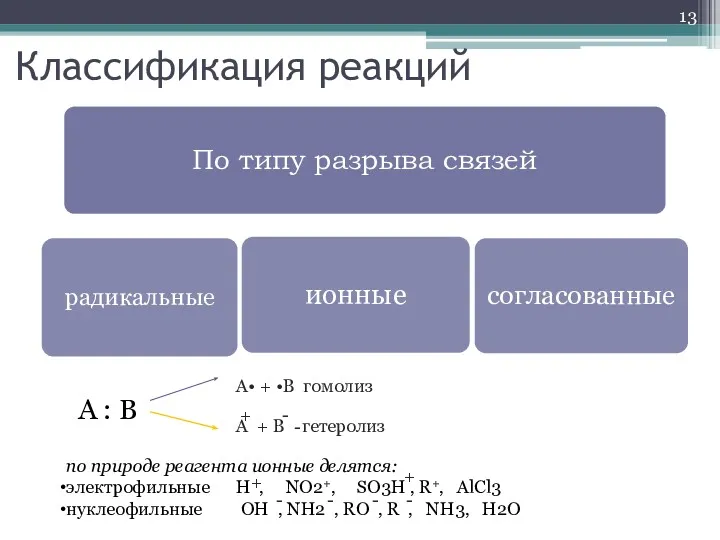
- 13. Классификация реакций A : B A• + •B гомолиз A + B гетеролиз + - по
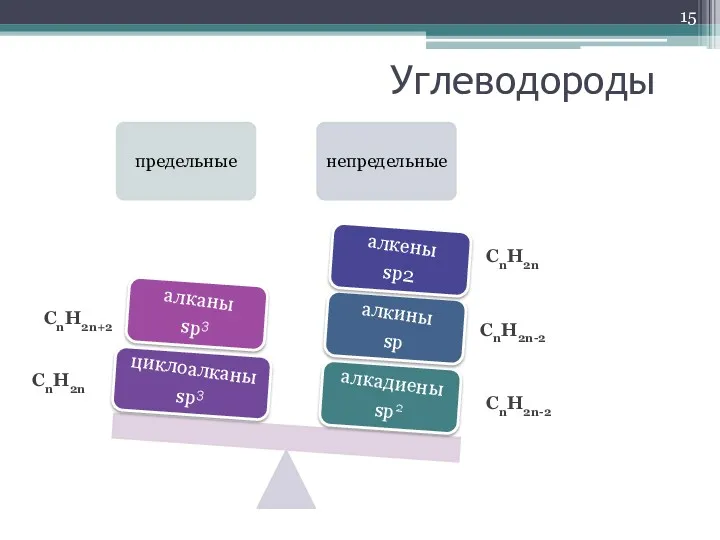
- 15. Углеводороды CnH2n CnH2n-2 CnH2n-2 CnH2n CnH2n+2
- 16. Механизм радикального замещения SR (sp³) инициирование ( T, hν, радиация) рост цепи обрыв цепи
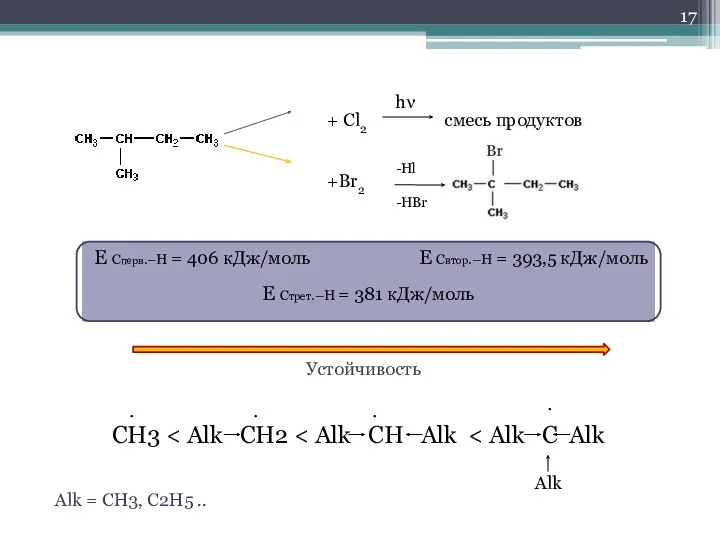
- 17. + Cl2 смесь продуктов hν +Br2 Hl HBr Е Сперв.–Н = 406 кДж/моль E Cвтор.–Н =
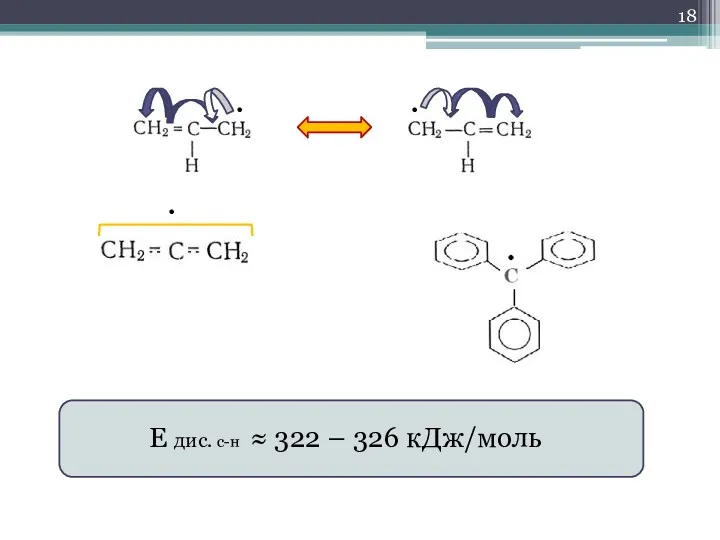
- 18. • • • Е дис. с-н ≈ 322 – 326 кДж/моль
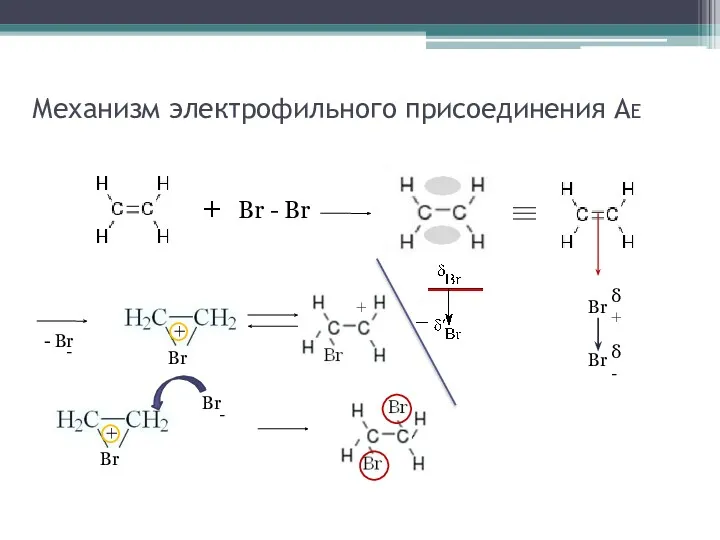
- 19. Механизм электрофильного присоединения АE + Br - Br Br δ+ - Br - Br + +
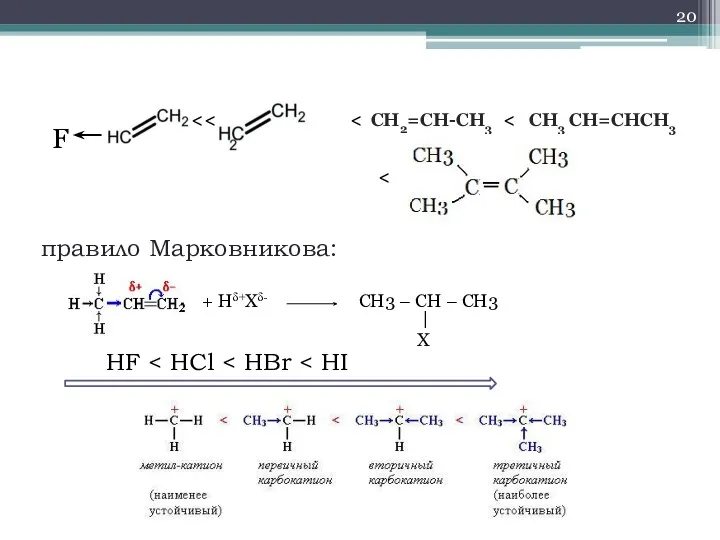
- 20. правило Марковникова: F СН2=СН-СН3 СН3 СН=СНСН3 HF + Hδ+Xδ- CH3 – CH – CH3 | X
- 21. AR (против правила Марковникова)
- 22. AE (кислотный катализ) CH3 – CH = CH2 + H2O CH3 – CH(OH) – CH3 H
- 23. Окисление алкенов “мягкое” окисление “жесткое” окисление
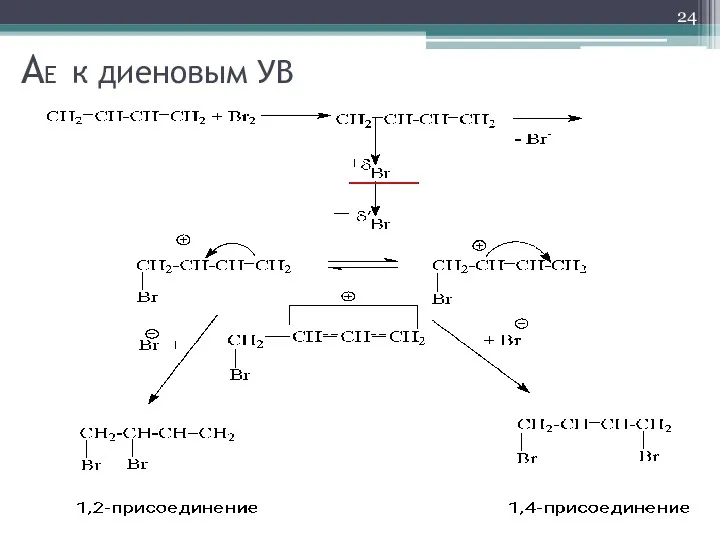
- 24. AE к диеновым УВ
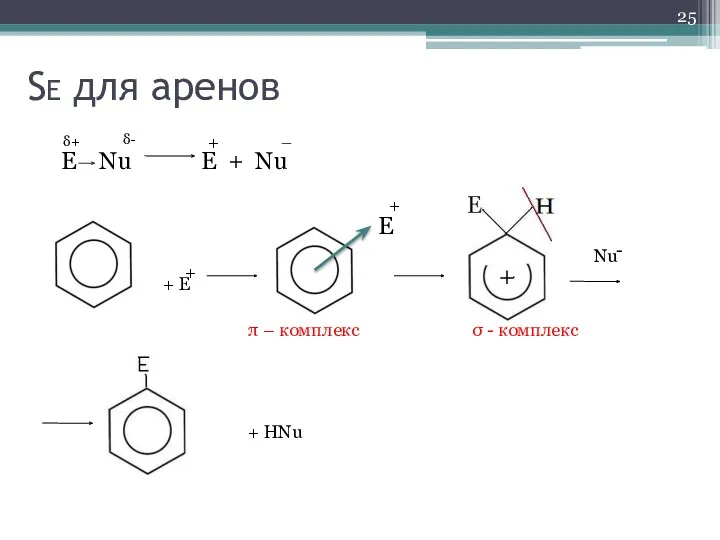
- 25. SE для аренов E Nu E + Nu δ- δ+ – + + E + E
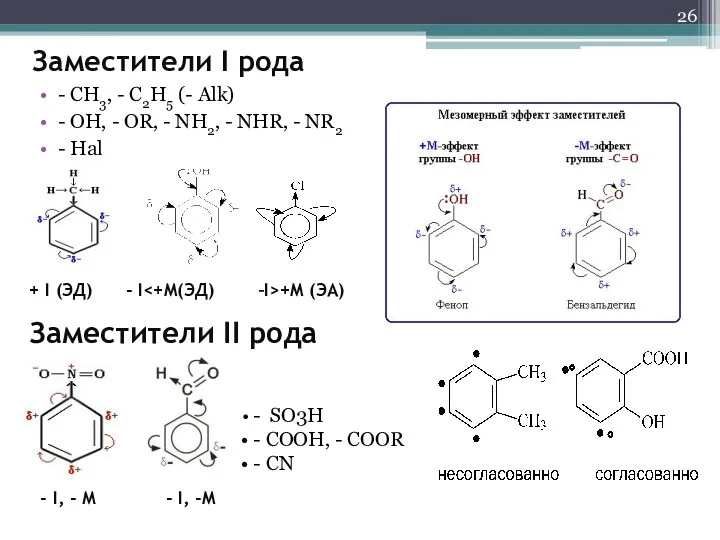
- 26. Заместители I рода - CH3, - C2H5 (- Alk) - OH, - OR, - NH2, -
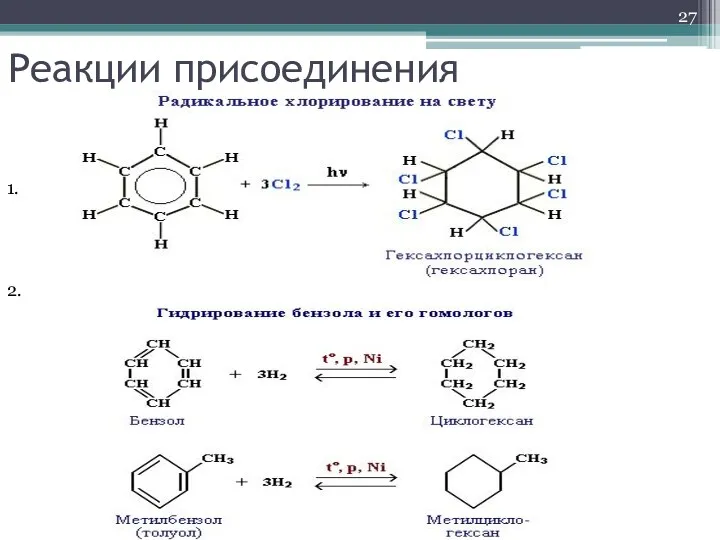
- 27. Реакции присоединения 1. 2.
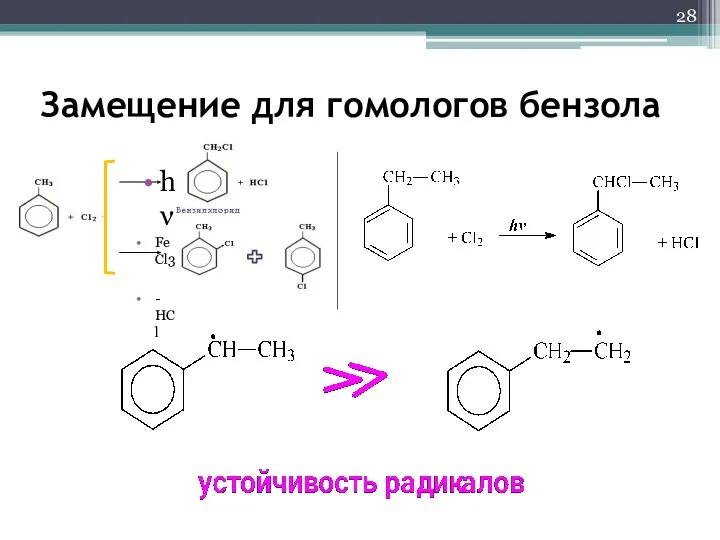
- 28. Замещение для гомологов бензола
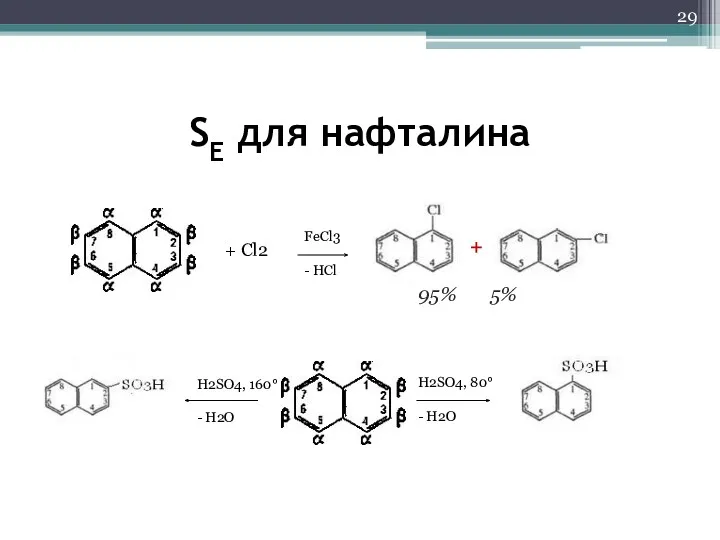
- 29. H2SO4, 80° - H2O H2SO4, 160° - H2O FeCl3 - HCl + Сl2 + 95% 5%
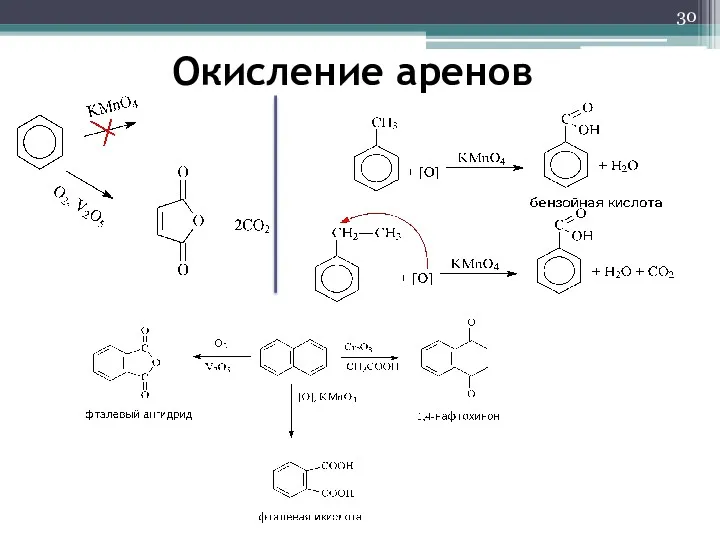
- 30. Окисление аренов
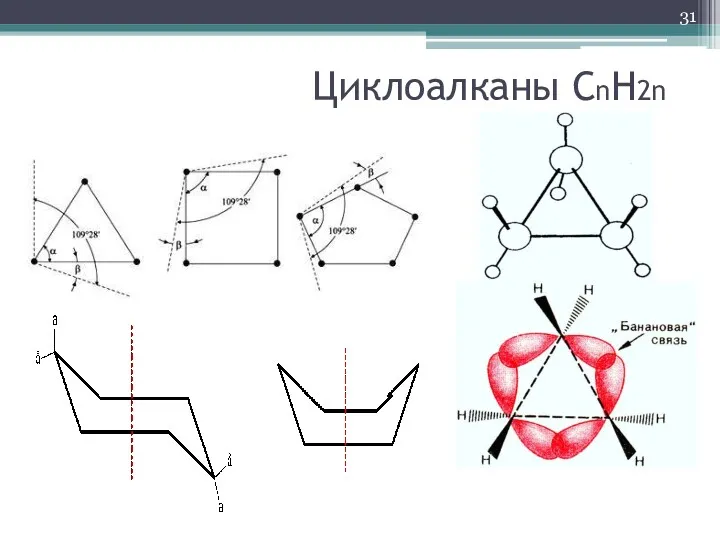
- 31. Циклоалканы СnH2n
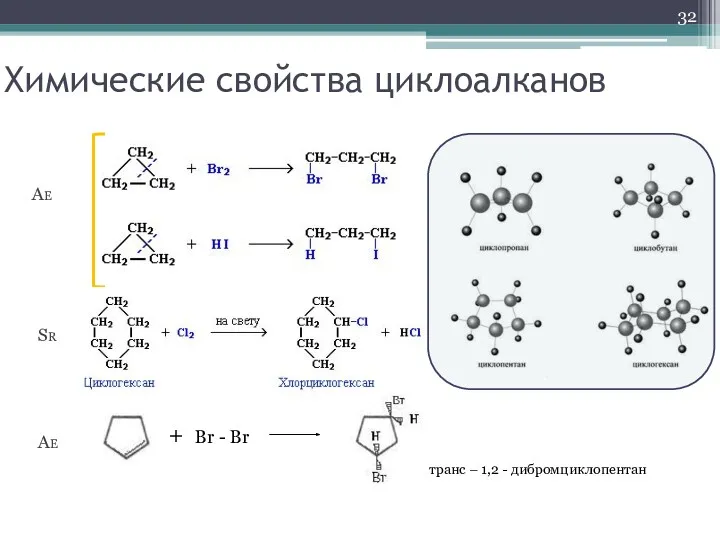
- 32. Химические свойства циклоалканов AE SR AE + Br - Br транс – 1,2 - дибромциклопентан
- 34. Скачать презентацию







 Основания. 8 класс
Основания. 8 класс Контрольная работа по дисциплине Физическая химия. Раздел: Электрохимия
Контрольная работа по дисциплине Физическая химия. Раздел: Электрохимия Поняття про побутові хімікати
Поняття про побутові хімікати Цинковое покрытие
Цинковое покрытие Кремний и его соединения. Аллотропные модификации
Кремний и его соединения. Аллотропные модификации Р-элементы VI A группы. Свойства их соединений
Р-элементы VI A группы. Свойства их соединений Группы сходных химических элементов
Группы сходных химических элементов Кислород
Кислород Кислород. Строение молекулы кислорода. Получение кислорода. Взаимодействие с кислородом простых и сложных веществ
Кислород. Строение молекулы кислорода. Получение кислорода. Взаимодействие с кислородом простых и сложных веществ Свойства фосфора
Свойства фосфора Бытовая химическая грамотность
Бытовая химическая грамотность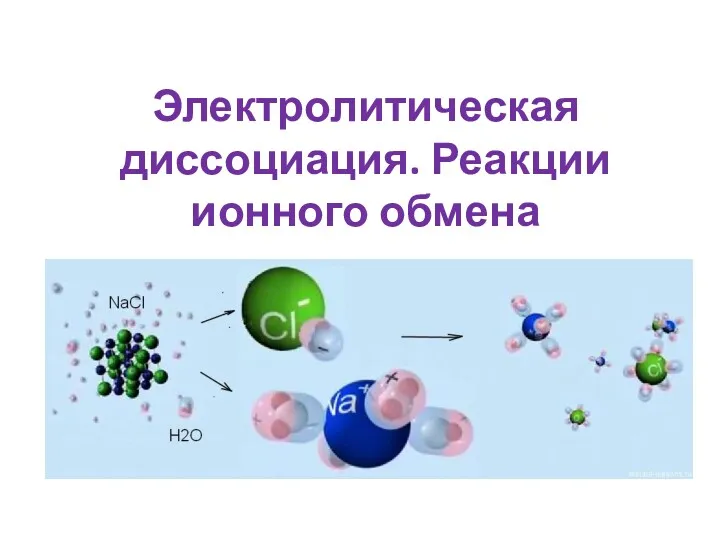 Электролитическая диссоциация. Реакции ионного обмена
Электролитическая диссоциация. Реакции ионного обмена Алмазы. Бриллианты
Алмазы. Бриллианты Пластмаси. Класифікація пластмас
Пластмаси. Класифікація пластмас Арены. Бензол
Арены. Бензол Камни и Скорпион
Камни и Скорпион Наноматериалы. Свойства наноматериалов. Особенности свойств
Наноматериалы. Свойства наноматериалов. Особенности свойств Силикаты. Гранат. Берилл
Силикаты. Гранат. Берилл Reactors for catalytic alkylation
Reactors for catalytic alkylation Электрохимия. Электропроводность растворов. Электродные потенциалы. Гальванические элементы
Электрохимия. Электропроводность растворов. Электродные потенциалы. Гальванические элементы Домашнее задание по теме Химические свойства альдегидов, их получение
Домашнее задание по теме Химические свойства альдегидов, их получение Кинетика процессов твердофазного взаимодействия
Кинетика процессов твердофазного взаимодействия Тяжёлая вода
Тяжёлая вода Fiber-Sludge-Sulfur-Beton (FiSHSB)
Fiber-Sludge-Sulfur-Beton (FiSHSB) Двовимірний ямр. Приклади
Двовимірний ямр. Приклади Чистые вещества и смеси
Чистые вещества и смеси Понятие о спиртах. 9 класс
Понятие о спиртах. 9 класс Методы титрования. Перманганатометрия. (Лекция 24)
Методы титрования. Перманганатометрия. (Лекция 24)