Содержание
- 2. Из всех неорганических соединений соли являются наиболее многочисленным классом веществ. Это твёрдые вещества, они отличаются друг
- 3. Цвет солей
- 4. Цвет солей Нитрат меди (II) Сульфат железа (II) Сульфат железа (III) Хлорид натрия
- 5. Классификация солей по растворимости растворимые малорастворимые нерастворимые Аммиачная селитра NH4NO3 Сульфат кальция CaSO4 Фосфат железа FePO4
- 6. Классификация солей по наличию кислорода кислородсодержащие бескислородные Сульфат натрия Бромид натрия
- 7. Соли – это сложные вещества, состоящие из ионов металла и кислотных остатков Соли – это электролиты,
- 8. Как можно получить соли? Кислота + основание = соль + вода реакция нейтрализации КОН + H2SO4
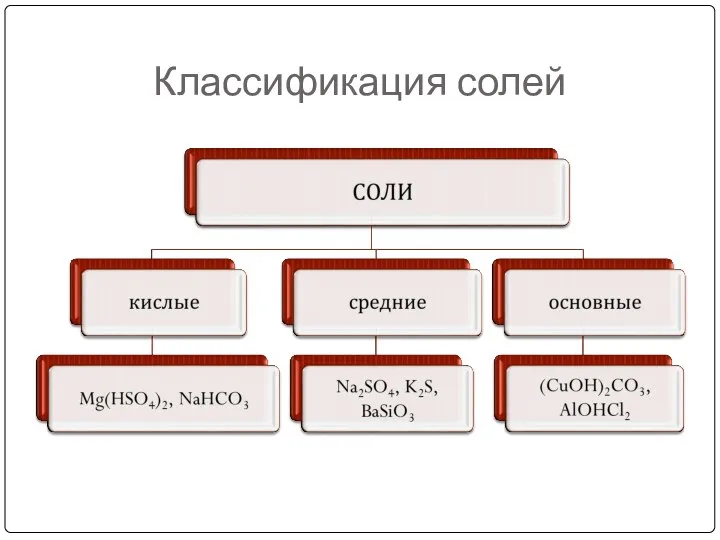
- 9. Классификация солей
- 10. Соли – получаются при замене атомов водорода в кислоте на атомы металла Что получится, если не
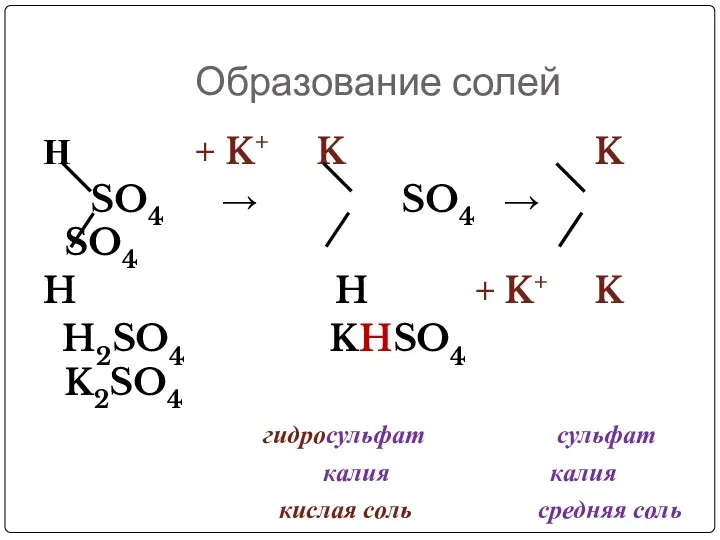
- 11. Образование солей Н + K+ K K SO4 → SO4 → SO4 H H + K+
- 12. Кислые соли – это продукты неполного замещения атомов водорода в кислоте на металл Может ли образовать
- 13. Кислые соли К кислым солям относят, например, питьевую соду NaHCO3, состоящую из катиона металла натрия Na+
- 14. Диссоциация кислых солей KHSO4 = K+ + HSO4- (1 ступень) HSO4- ↔ H+ + SO42- (2
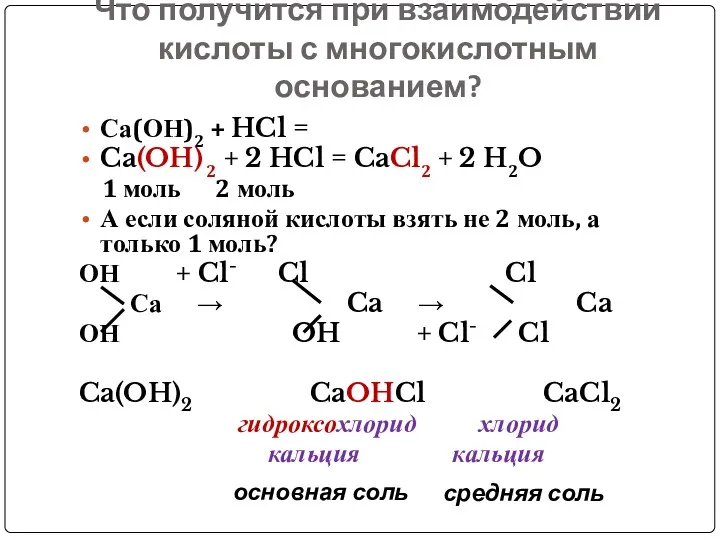
- 15. Что получится при взаимодействии кислоты с многокислотным основанием? Са(ОН)2 + HCl = Ca(OH) 2 + 2
- 16. Основные соли – это продукты неполного замещения гидроксогрупп в основании на кислотный остаток Могут ли образовывать
- 17. Основные соли К основным солям относится, например, малахит (CuOH)2CO3. Он состоит из двух гидроксокатионов CuOH+ и
- 18. Диссоциация основных солей СаОНСl = (CaOH)+ + Cl- (1 ступень) (CaOH)+ ↔ Ca 2+ + OH-
- 19. Средние соли – это продукты полного замещения атомов водорода в кислоте на металл Диссоциируют средние соли
- 20. Составьте уравнения диссоциации солей Сульфата калия Карбоната натрия Нитрата железа (III) Хлорида меди (II) Сульфата железа
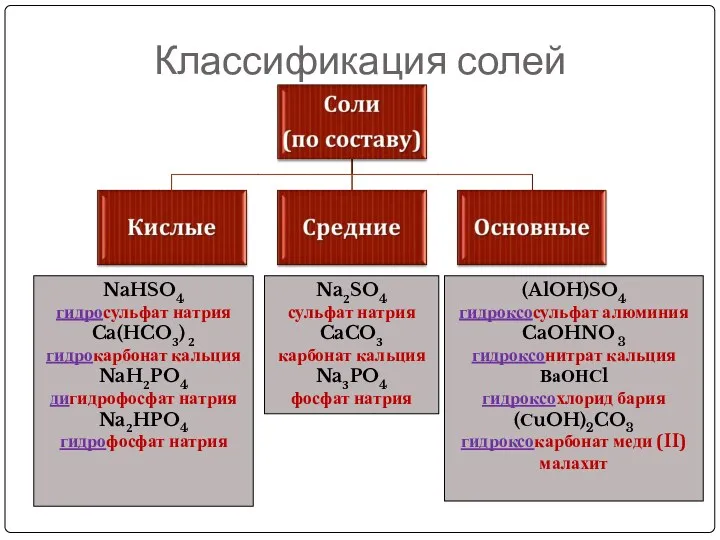
- 21. Классификация солей NaHSO4 гидросульфат натрия Ca(HCO3) 2 гидрокарбонат кальция NaH2PO4 дигидрофосфат натрия Na2HPO4 гидрофосфат натрия (AlOH)SO4
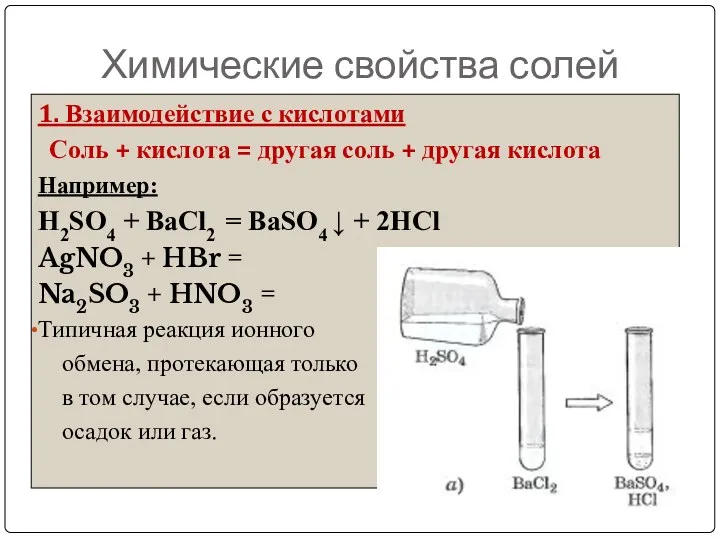
- 22. Химические свойства солей 1. Взаимодействие с кислотами Соль + кислота = другая соль + другая кислота
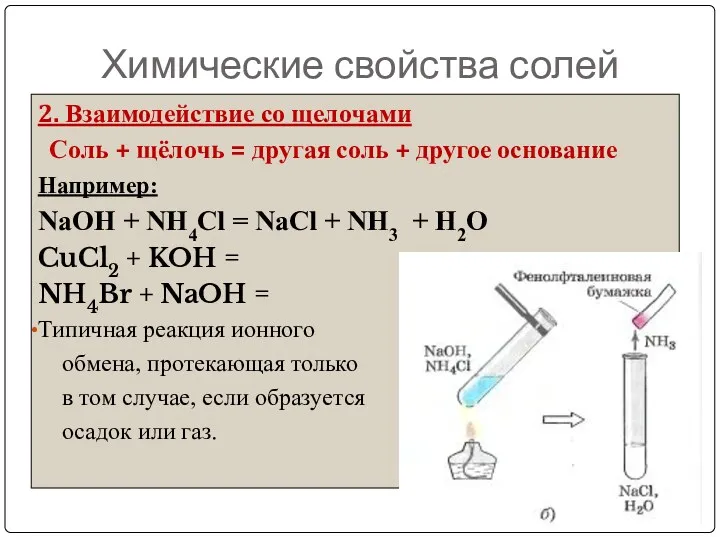
- 23. Химические свойства солей 2. Взаимодействие со щелочами Соль + щёлочь = другая соль + другое основание
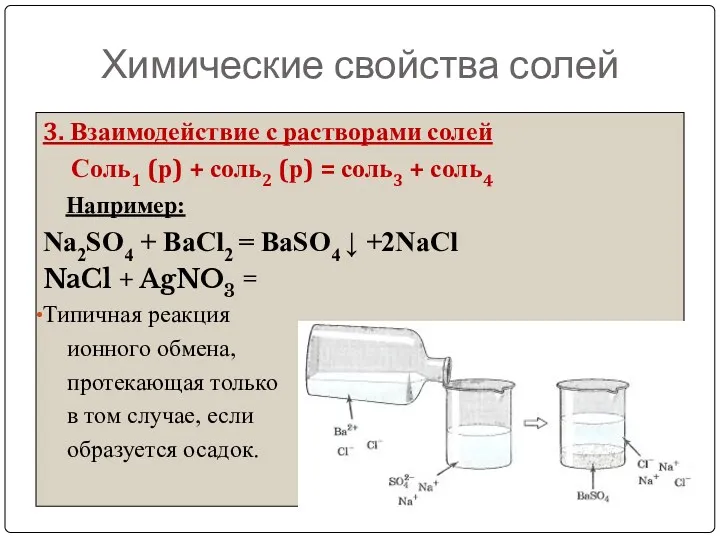
- 24. Химические свойства солей 3. Взаимодействие с растворами солей Соль1 (р) + соль2 (р) = соль3 +
- 25. Химические свойства солей 4. Взаимодействие с металлами соль(р) + металл = другая соль(р) + другой металл
- 26. Химические свойства солей 4. Взаимодействие с металлами 1865 г. –Н.Н. Бекетов (русский химик) изучал способность металлов
- 27. Химические свойства солей 4. Взаимодействие с металлами 1892 г. –В. Нернст (немецкий химик) доказал, что вытеснительный
- 28. Правила ряда напряжений (активности) металлов: Металлы, расположенные левее водорода, вытесняют водород Н2 из растворов кислот Каждый
- 29. Химические свойства солей Условия взаимодействия металлов с растворами солей а) обе соли (и реагирующая, и образующаяся
- 30. Исключение: В расплавах солей (т.е. без воды) щелочные металлы (IA группа) вытесняют все следующие за ними
- 31. Химические свойства солей 5. Некоторые соли могут разлагаться при прокаливании СаСО3 = СаО + СО2
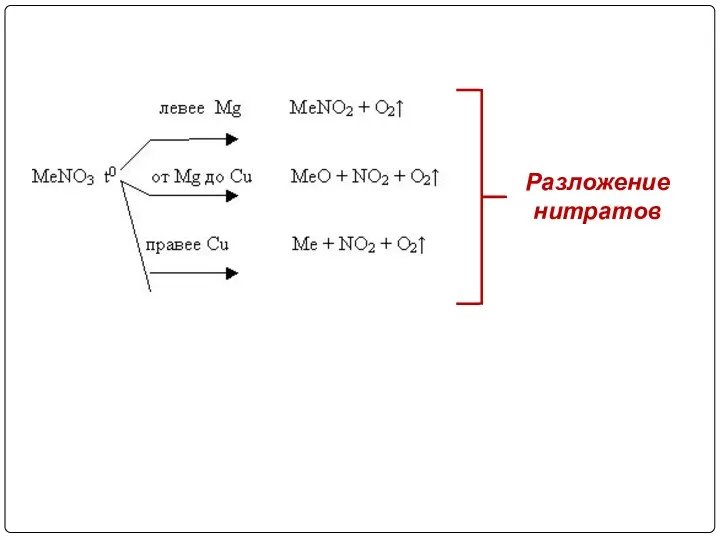
- 32. Разложение нитратов
- 33. Химические свойства солей 6. Некоторые свойства кислых солей а) как правило, растворимы в отличие от средних
- 34. Получение солей 1. Взаимодействие кислоты с Ме: Zn + 2HCI → ZnCI2 + H2 2. Взаимодействие
- 35. Составьте уравнения реакций и укажите их тип: Хлорид цинка + гидроксид натрия → Хлорид железа (II)
- 36. Составьте возможные уравнения реакций: Fe2(SO4)3 + KOH → К KNO3 + NaOH → С (NH4)2SO4 +
- 37. Закончите молекулярные уравнения возможных реакций в растворах, запишите соответствующие им ионные уравнения 1 вариант K2CO3 +
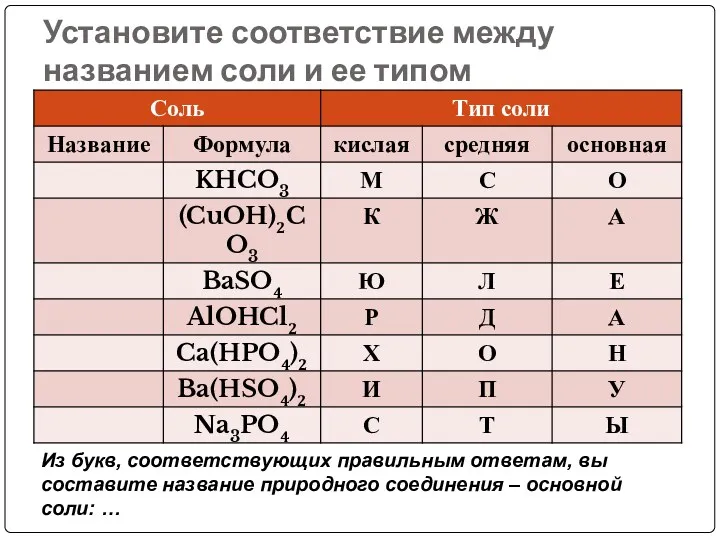
- 38. Установите соответствие между названием соли и ее типом Из букв, соответствующих правильным ответам, вы составите название
- 39. Вычеркните «лишние» формулы Кислоты, которые не образуют кислых солей – это H2SO4, HNO3, H3PO4, H2S, т.к.
- 40. В каком случае возможна реакция и почему? CuCl2 + Al → AlCl3 + Cu → CuSO4
- 41. Составьте возможные уравнения реакций с сульфатом железа (II) и А) LiOH Б) Cu В) Ba(NO3)2 Г)
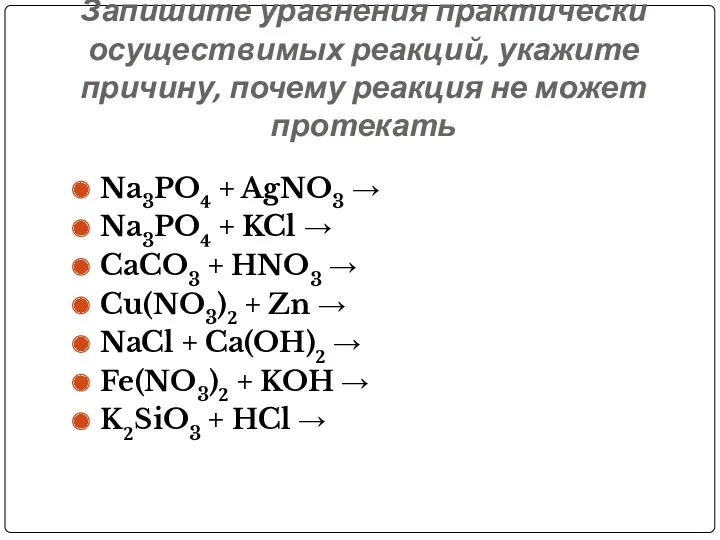
- 42. Запишите уравнения практически осуществимых реакций, укажите причину, почему реакция не может протекать Na3PO4 + AgNO3 →
- 43. Запишите не менее 5 уравнений химических реакций, с помощью которых можно получить: Хлорид меди (II) Сульфат
- 45. Скачать презентацию
































 Что такое хорошо и что такое плохо, Или правила игры от очень строгой химички
Что такое хорошо и что такое плохо, Или правила игры от очень строгой химички Общие представления о фазовых состояниях и фазовых переходах полимеров
Общие представления о фазовых состояниях и фазовых переходах полимеров Катализ в органическом синтезе
Катализ в органическом синтезе Конденсация. Капельная и пленочная конденсация
Конденсация. Капельная и пленочная конденсация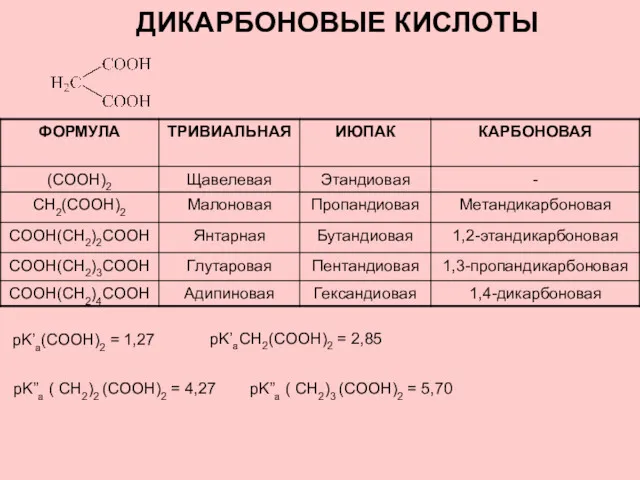 Дикарбоновые кислоты
Дикарбоновые кислоты Классификация химических веществ СГС
Классификация химических веществ СГС Нуклеофильное замещение галогена и других функциональных групп
Нуклеофильное замещение галогена и других функциональных групп Введение в органическую химию
Введение в органическую химию Алканы. Строение, номенклатура, изомерия, химические и физические свойства
Алканы. Строение, номенклатура, изомерия, химические и физические свойства Кислородные соединения серы. 2 часть
Кислородные соединения серы. 2 часть Химические формулы. Относительная молекулярная масса вещества
Химические формулы. Относительная молекулярная масса вещества Методы разделения смесей веществ
Методы разделения смесей веществ Отчет по исследовательской работе Образование АСПО
Отчет по исследовательской работе Образование АСПО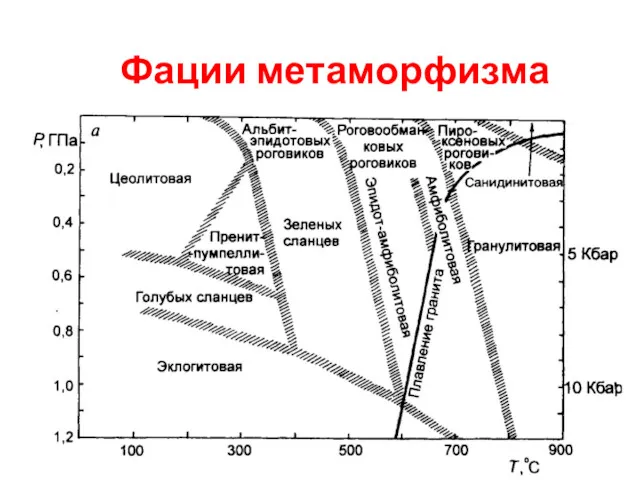 Фации метаморфизма
Фации метаморфизма Практическая работа. Химический состав клетки
Практическая работа. Химический состав клетки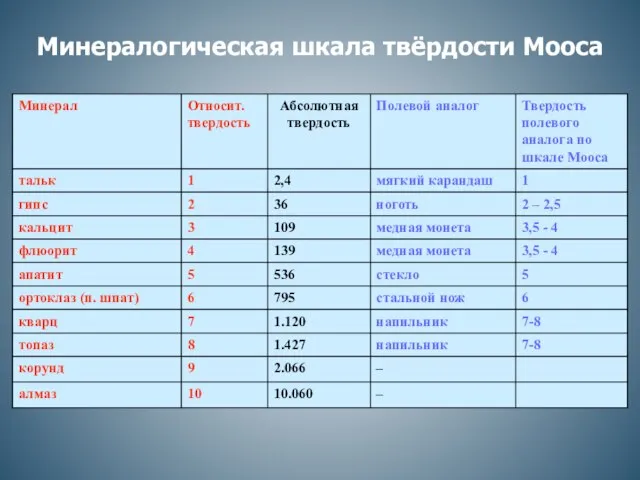 Минералогическая шкала твёрдости Мооса
Минералогическая шкала твёрдости Мооса Воздух и его состав. Урок-презентация. 8 класс
Воздух и его состав. Урок-презентация. 8 класс Теория электролитической диссоциации
Теория электролитической диссоциации Кислород
Кислород Химия и повседневная жизнь человека
Химия и повседневная жизнь человека Кристаллы. Формы
Кристаллы. Формы Электролитическая диссоциация. Гидролиз
Электролитическая диссоциация. Гидролиз Белки. Функции белков
Белки. Функции белков Сплавы металлов. 11 класс
Сплавы металлов. 11 класс Химические свойства. Оксиды, основания, кислоты и соли
Химические свойства. Оксиды, основания, кислоты и соли Целлюлоза
Целлюлоза Water
Water Методы оценки плотности и вязкости нефтей и нефтепродуктов
Методы оценки плотности и вязкости нефтей и нефтепродуктов