Слайд 2

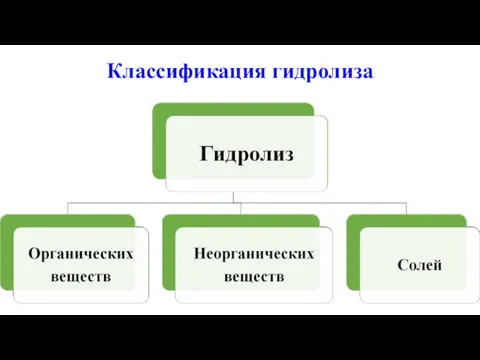
Гидролиз
Гидролиз – это один из видов химических реакций, где при взаимодействии
веществ с водой происходит разложение исходного вещества с образованием новых соединений.
Слайд 3
Слайд 4

Гидролиз органических веществ
В ходе гидролиза при участии пищеварительных ферментов:
БЕЛКИ расщепляются на
АМИНОКИСЛОТЫ.
ЖИРЫ — на ГЛИЦЕРИН и ЖИРНЫЕ КИСЛОТЫ.
ПОЛИСАХАРИДЫ ( например, крахмал и целлюлоза) — на МОНОСАХАРИДЫ (например, на ГЛЮКОЗУ ).
НУКЛЕИНОВЫЕ КИСЛОТЫ — на свободные НУКЛЕОТИДЫ.
Слайд 5

5. Гидролиз галогеналканов:
R-Cl + H2O t, OH R-OH + HCl
6. Гидролиз
сложных эфиров:
7. Гидролиз АТФ:
АТФ + H2O → H3PO4 + АДФ + Е (энергия, 40 кДж)
Слайд 6

Гидролиз неорганических веществ
Гидролиз солей – разновидность реакций гидролиза, обусловленного протеканием реакций
ионного обмена в растворах (водных) растворимых солей-электролитов.
Движущей силой процесса является взаимодействие ионов с водой, приводящее к образованию слабого электролита в ионном или молекулярном виде («связывание ионов»).
Слайд 7

Слайд 8

Соли образованные сильным основанием и слабой кислотой:
1. Ацетат калия:
CH3COOK + H2O
↔ CH3COOH + KOH
CH3COO- + K+ + H2O ↔ CH3COOH + K+ + OH-
CH3COO- + H2O ↔ CH3COOH + OH-
2. Карбонат натрия:
1 ступень: K2CO3 + H2O ↔ 2KHCO3 + KOH
2K+ + CO32- + H2O ↔ K+ + HCO3- + K+ + OH-
CO32- + H2O ↔ HCO3- + OH-
2 ступень: KHCO3 + H2O ↔ H2CO3 + KOH
K+ + HCO3- + H2O ↔ H2CO3 + K+ + OH-
HCO3- + H2O ↔ OH- + H2CO3 (H2O + CO2)
Слайд 9

Соли образованные слабым основанием и сильной кислотой:
1. Хлорид аммония:
NH4Cl + H2O
↔ NH3 ∙ H2O + HCl
NH4+ + Cl- + H2O ↔ NH3 ∙ H2O + H+ + Cl-
NH4+ + H2O ↔ NH3 ∙ H2O + H+
2. Сульфат меди (II):
1 ступень: 2CuSO4 + 2H2O ↔ (CuOH)2SO4 + H2SO4
2Cu2+ + 2SO42- + H2O ↔ 2(CuOH)+ + 2SO42- + 2H+
Cu2+ + H2O ↔ (CuOH)+ + H+
2 ступень: (CuOH)2SO4 + 2H2O ↔ Cu(OH)2 + H2SO4
2(CuOH)+ + SO42- + 2H2O ↔ 2Cu(OH)2 + 2H+ + SO42-
(CuOH)+ + H2O ↔ Cu(OH)2 + H+
Слайд 10

Соли образованные слабым основанием и слабой кислотой:
Ацетат аммония:
CH3COONH4 + H2O ↔
CH3COOH + NH3 ∙ H2O
CH3COO- + NH4+ + H2O ↔ CH3COOH + NH3 ∙ H2O
2. Ацетат алюминия:
Al(CH3COO)3 + H2O ↔ AlOH(CH3COO)2 + CH3COOH
Al3+ + 3CH3COO- + H2O ↔ AlOH2+ + 2CH3COO- + CH3COOH
Al3+ + CH3COO- + H2O ↔ AlOH2+ + CH3COOH
Слайд 11

Соли образованные сильным основанием и сильной кислотой:
Гидролизу не подвергаются (NaCl, K2SO4,
LiBr и так далее)










 Валентность и степень окисления
Валентность и степень окисления Химическая связь. Взаимное влияние атомов в молекуле
Химическая связь. Взаимное влияние атомов в молекуле Химические свойства кислот как электролитов
Химические свойства кислот как электролитов Фазовые превращения в стали при охлаждении
Фазовые превращения в стали при охлаждении Строение вещества. Химические элементы
Строение вещества. Химические элементы Геохимия стабильных изотопов, Радиоуглеродный метод
Геохимия стабильных изотопов, Радиоуглеродный метод Побочная подгруппа 6 и 7 групп
Побочная подгруппа 6 и 7 групп Химическая связь
Химическая связь Основные сведения о строении металлов и теории сплавов
Основные сведения о строении металлов и теории сплавов Углеводы. Моносахариды
Углеводы. Моносахариды Виды химических реакций
Виды химических реакций Separation amp confirmation
Separation amp confirmation Карбонаты
Карбонаты Hydrochloric acid HCl
Hydrochloric acid HCl Алкены. Общая характеристика, гомологический ряд, номенклатура, изомерия. Методы синтеза алкенов. Лекция 3
Алкены. Общая характеристика, гомологический ряд, номенклатура, изомерия. Методы синтеза алкенов. Лекция 3 Metode electrochimice. Generalităţi
Metode electrochimice. Generalităţi Синтетические методы получения лекарственных средств гетероциклического ряда антибиотики с четырехчленным азетидиновым ядром
Синтетические методы получения лекарственных средств гетероциклического ряда антибиотики с четырехчленным азетидиновым ядром Оксид фосфора P2O5
Оксид фосфора P2O5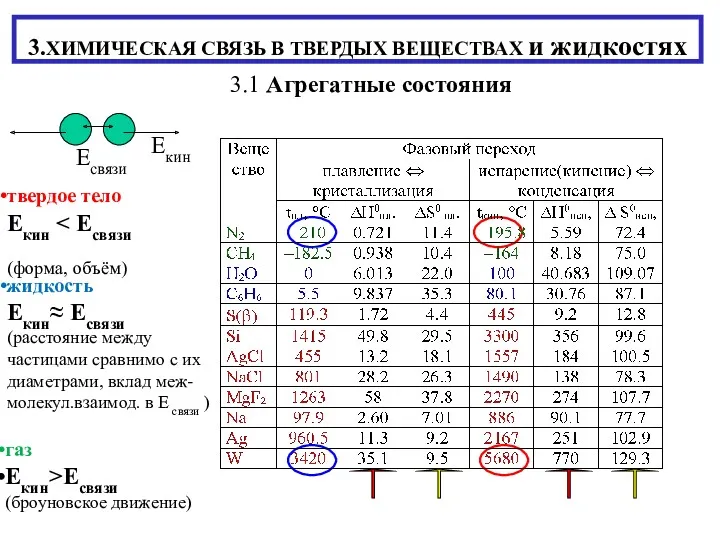 Химическая связь в твердых веществах и жидкостях
Химическая связь в твердых веществах и жидкостях Гидрохимические определения. Методы определения растворенного кислорода в воде
Гидрохимические определения. Методы определения растворенного кислорода в воде Углеводы. (Лекция 7)
Углеводы. (Лекция 7) Описание основных типов магматических горных пород
Описание основных типов магматических горных пород Электролиз растворов. Применение вытеснительного ряда металлов для прогнозирования продуктов электролиза
Электролиз растворов. Применение вытеснительного ряда металлов для прогнозирования продуктов электролиза Классы неорганических веществ. Лекция №2
Классы неорганических веществ. Лекция №2 Строение атома. Периодический закон Менделеева
Строение атома. Периодический закон Менделеева Характеристика химических элементов и химических реакций
Характеристика химических элементов и химических реакций Химические свойства основных неорганических соединений в свете ЭД и ОВР. 9 класс
Химические свойства основных неорганических соединений в свете ЭД и ОВР. 9 класс Чистые вещества и смеси
Чистые вещества и смеси